例談電解原理在高考題中的應用
江蘇 李宗來 李小娟
電解裝置實現了電能到化學能的轉化,使不能自發進行的反應在外在電壓的迫使下而發生。電解原理在生產生活中的應用非常廣泛,教材中涉及“氯堿工業”的電解飽和食鹽水、熔融電解法制備活潑金屬、精煉銅、電鍍以及金屬的電化學防護等。近年高考中電解原理的應用以新穎的形式與題材呈現,體現了高考命題在加強基本知識考查的同時,更加注重了試題的情景化、生活化、實用化,強化知識點的相互滲透與融合。本文賞析高考中電解原理在現今熱門領域的應用,以期引起重視并對其有更深入地認識與理解。(為節約篇幅,節選高考題相關部分)
一、運用電解原理處理生產中的廢水
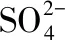

下列敘述正確的是
( )
B.該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品

D.當電路中通過1 mol電子的電量時,會有0.5 mol的O2生成
【答案】B

【總結提升】本題以電解水為基本知識點考查電解原理的應用,利用兩極不同的酸堿產物同時結合離子交換膜對酸性或堿性污水進行處理,或者在追求電荷平衡的促使下實現對污染物粒子的分離,同時產生目標副產物。
【例2】(2015·四川卷·4)用如圖所示裝置除去含CN-、Cl-廢水中的CN-時,控制溶液pH為9~10,陽極產生的ClO-將CN-氧化為兩種無污染的氣體,下列說法不正確的是
( )

A.用石墨作陽極,鐵作陰極



【答案】D

【反思預測】應用電解的原理處理生產中的廢水,可以直接將廢水中有害物質通過電解分別在陽、陰兩極上發生氧化和還原反應轉化成為無害物質以實現污水凈化;也可采用間接氧化和間接還原方式,即利用電解產生的具有氧化性或還原性的產物與廢水中的有害物質發生化學反應,生成不溶于水的沉淀物,以達到分離去除的目的。電解法具有可處理各種不同類型的廢水,適應性強、高效且無二次污染等特點,因此備受青睞并被廣泛應用,這也是高考命題的重要素材和方向,應引起重視。
二、運用電解原理處理生產中的廢氣
1.運用電解法高效去除H2S廢氣
【例3】(2018·全國卷Ⅰ·13)最近我國科學家設計了一種CO2+H2S協同轉化裝置,實現對天然氣中CO2和H2S的高效去除。示意圖如圖所示,其中電極分別為ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯電極區發生反應為



該裝置工作時,下列敘述錯誤的是
( )


C.石墨烯上的電勢比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需為酸性
【答案】C

【總結提升】圖形圖表在高考試題中出現的頻率很高,是題干信息的重要載體,考查考生的接受、吸收、整合化學信息的能力,要學會提取圖形圖表中相關信息,解答相關問題。本題首先仔細觀察電解裝置圖中表示物質變化的箭頭指向,然后通過物質的化合價的變化從而確定陰陽極,陽極物質失去電子、化合價升高、發生氧化反應,陰極物質得到電子、化合價降低、發生還原反應。同時結合圖象根據交換膜的類型、粒子的移動及電解質等條件書寫電極反應式。
2.運用電解法脫硝去除NOx廢氣
【例4】(2014·北京·26節選)NH3經一系列反應可以得到HNO3,如圖所示。

Ⅳ中,電解NO制備NH4NO3,其工作原理如圖所示,為使電解產物全部轉化為NH4NO3,需補充物質A,A是________,說明理由:________________。



【反思預測】廢氣是指人類在生產和生活過程中排出的有毒有害的氣體,因廢氣氣味大、毒性強,嚴重污染環境,影響人體健康。廢氣的種類很多,有H2S、SO2等硫化物,NH3和NO、NO2等氮化物以及苯、甲苯、甲醛等有機廢氣。其原理是讓廢氣通過電解直接或者間接發生氧化還原反應,從而轉化為無毒、無害有利用價值的物質。當今,應用電解原理對廢水、廢氣、廢渣進行處理,使之“變廢為寶”是解決環境問題、造福人類的有效方法,是極有應用前景的,這也是高考中此類試題持續關注的焦點之一。
三、運用電解原理制備物質
1.多元弱酸的酸式鹽、正鹽的制備
【例5】(2018·全國卷Ⅰ·27節選)焦亞硫酸鈉(Na2S2O5)在醫藥、橡膠、印染、食品等方面應用廣泛。回答下列問題:
(1)生產Na2S2O5,通常是由NaHSO3過飽和溶液經結晶脫水制得。寫出該過程的化學方程式:________________。
(2)制備Na2S2O5也可采用三室膜電解技術,裝置如圖所示,其中SO2堿吸收液中含有NaHSO3和Na2SO3。陽極的電極反應式為____________________。電解后,________室的NaHSO3濃度增加。將該室溶液進行結晶脫水,可得到Na2S2O5。





【變式練習】(2017·江蘇卷·16)鋁是應用廣泛的金屬。以鋁土礦(主要成分為Al2O3,含SiO2和Fe2O3等雜質)為原料制備鋁的一種工藝流程如下:

(1)“電解Ⅰ”是電解熔融Al2O3,電解過程中作陽極的石墨易消耗,原因是________________。
(2)“電解Ⅱ”是電解Na2CO3溶液,原理如圖所示。
陽極的電極反應式為________________。
,
陰極產生的物質A的化學式為________________。
【答案】(1)石墨電極被陽極上產生的O2氧化
2.運用電解原理制備能源燃料
【例6】(2015·福建卷·11)某模擬“人工樹葉”電化學實驗裝置如圖所示,該裝置能將H2O和CO2轉化為O2和燃料(C3H8O)。下列說法正確的是
( )

A.該裝置將化學能轉化為光能和電能
B.該裝置工作時,H+從b極區向a極區遷移
C.每生成1 mol O2,有44 g CO2被還原

【答案】B


【變式練習】(1)(2015·浙江卷·11)在固態金屬氧化物電解池中,高溫共電解H2O-CO2混合氣體制備H2和CO是一種新的能源利用方式,基本原理如圖所示。下列說法不正確的是
( )

A.X是電源的負極

D.陰、陽兩極生成的氣體的物質的量之比是1∶1
(2)(2016·浙江卷)研究證實,CO2也可在酸性水溶液中通過電解生成甲醇,則生成甲醇的反應發生在________極,該電極反應式是________________。
【答案】(1)D

【反思預測】首先根據有外接電源則判斷為電解池,同時可以根據電源的正、負極相連確定電解池的陰陽極,也可以通過電解質中粒子的移動方向確定陰陽極;還可以通過電解裝置中物質變化的箭頭指向,通過物質所含元素化合價的變化確定陰陽極。有機物中H(+1價)、O(+2價)再求C的平均價態,對于復雜的有機反應物的電極反應式可以先配平,再確定得失電子數目,因為也遵循原子守恒和電荷守恒。因此解讀電解裝置提供的信息,是解決問題的關鍵。能源燃料在生產生活中是不可或缺的,如何突破能源的匱乏制約著當今社會發展的瓶頸,是困擾已久的難題,通過電解在能量消耗較小的前提條件下制備清潔能源燃料是解決能源危機新的途徑與方向,這也是未來高考命題的熱點之一。
四、運用電解原理實現物質的分離提純
【例7】(2017·天津卷·7節選)某混合物漿液含有Al(OH)3、MnO2和少量Na2CrO4。考慮到膠體的吸附作用使Na2CrO4不易完全被水浸出,某研究小組利用設計的電解分離裝置(如圖),使漿液分離成固體混合物和含鉻元素溶液,并回收利用。回答Ⅱ中的問題。

Ⅱ.含鉻元素溶液的分離和利用
,
分離后含鉻元素的粒子是________;陰極室生成的物質為________(寫化學式)。


【反思預測】利用電解原理來分離、提純物質,如電解精煉銅,將粗銅作陰極,含Cu2+的溶液為電解液,通直流電,在陽極銅及比銅活潑的雜質金屬失電子,在陰極只有Cu2+得電子析出,從而提純了銅。也可以通過同性相斥、異性相吸在追求電荷平衡的促使下離子發生遷移,從而實現對物質的分離,判斷離子的移動方向除上述方法之外還可通過離子膜的種類及離子的消耗與生成,一般由離子生成的一極移向離子消耗的一極。電解法是實現物質簡單快速分離的一種有效手段,分離物質的同時得到副產物,具有超越一般分離方法的優點,已引起高考命題者的關注,因此要格外的重視。
五、運用電解原理實現二次電池的重復使用

( )

B.充電時釋放CO2,放電時吸收CO2

【答案】D

【變式練習】(2018·全國卷Ⅲ·11)一種可充電鋰-空氣電池如圖所示。當電池放電時,O2與Li+在多孔碳材料電極處生成Li2O2-x(x=0或1)。下列說法正確的是
( )

A.放電時,多孔碳材料電極為負極
B.放電時,外電路電子由多孔碳材料電極流向鋰電極
C.充電時,電解質溶液中Li+向多孔碳材料區遷移
【答案】D
【反思預測】二次電池又稱為充電電池或蓄電池,是指在電池放電(原電池)后可通過充電(電解池)的方式使活性物質激活從而可重復使用的電池。書寫電極反應式時,除了上述的方法與技巧外,要注意放電時原電池的負極電極反應式顛倒反應物與生成物,將原來的失去電子改為得到電子即為充電時電解池的陰極反應式,正極與陽極電極反應的書寫也同樣如此。二次電池融合了原電池與電解池的知識,綜合性強,在高考試題中一直高頻出現,只有掌握方法,把握原理、仔細分析才能準確應答各種不同新型的二次電池。
六、運用電解原理于金屬的防護
1.外加電流的陰極保護法
【例9】(2017·全國卷Ⅰ·11)支撐海港碼頭基礎的鋼管樁,常用外加電流的陰極保護法進行防腐,工作原理如圖所示,其中高硅鑄鐵為惰性輔助陽極。下列有關表述不正確的是
( )

A.通入保護電流使鋼管樁表面腐蝕電流接近于零
B.通電后外電路電子被強制從高硅鑄鐵流向鋼管樁
C.高硅鑄鐵的作用是作為損耗陽極材料和傳遞電流
D.通入的保護電流應該根據環境條件變化進行調整
【答案】C
【解析】A.鋼管表面不失電子,幾乎無腐蝕電流,故A正確;B.外電路中,電子從高硅鑄鐵流向電源正極,從電源負極流向鋼管樁,故B正確;C.高硅鑄鐵作為惰性輔助電極,不被損耗,故C錯誤;保護電流應根據環境(pH、離子濃度、溫度)變化,故D正確。
2.通過電解增加保護膜的保護法
【例10】(2017·全國卷Ⅱ·11)用電解氧化法可以在鋁制品表面形成致密、耐腐蝕的氧化膜,電解質溶液一般為H2SO4-H2C2O4混合溶液。下列敘述錯誤的是
( )
A.待加工鋁質工件為陽極
B.可選用不銹鋼網作為陰極

D.硫酸根離子在電解過程中向陽極移動
【答案】C

【反思預測】電解原理主要用于土壤、海水、河水等特殊環境下的金屬防護,主要途徑有:外加電流的陰極保護法,將被保護的金屬與電源的負極相連作陰極,惰性電極充當陽極,在外電壓的影響下,陰極表面積累了大量的負電荷,從而抑制其失去電子而被保護;或者通過電鍍應用電解原理在金屬表面鍍上一層金屬或者合金,既可以防腐又可以起到裝飾作用,一般將待鍍物作為陰極,鍍層金屬作為陽極,含鍍層金屬離子的溶液作為電解質,金屬離子在陰極得電子被還原形成均勻、光亮而致密的鍍層;也可通過電解使陽極氧化形成氧化膜增加保護層厚度達到防腐的目的。金屬的防腐是熱點的社會問題,是電化學知識在生產中應用的具體體現,將一直是高考關注的焦點之一。
綜上所述,高考復習中夯實基礎,在理解電解原理的同時注重知識點的應用至關重要。

