PD-L 1表達與食管癌患者臨床特征及預后關系的Meta分析
谷俊杰,邵亞娟,孫昭,趙林,白春梅
中國醫學科學院北京協和醫學院北京協和醫院腫瘤內科,北京100730
食管癌是世界上第八大常見惡性腫瘤,也是腫瘤相關的第六大死因[1]。食管鱗狀細胞癌(esophageal squamous cell carcinoma,ESCC)是食管癌最常見的組織學類型,占亞洲總患病人群的90%以上[2]。食管腺癌的發病率急劇上升,尤其是在西方國家。盡管食管癌的治療方法在放療、化療、靶向治療和免疫治療方面取得了重大突破,但是,食管癌患者的預后仍然較差,2年總生存率為20%~30%[3]。因此,為了改善食管癌患者的生存情況,尋找精確的生物標志物和新的治療靶點成為了食管癌治療領域的熱點。程序性死亡受體1(programmed cell death 1,PDCD1,也稱PD-1)屬于免疫球蛋白超家族中的CD28家族,主要表達于T淋巴細胞、B淋巴細胞和樹突狀細胞表面。程序性死亡受體配體1(programmed cell death 1 ligand 1,PDCD1LG1,也稱PDL1)和程序性死亡受體配體2(programmed cell death 2 ligand 2,PDCD2LG2,也稱 PD-L2)是 PD-1的兩種配體。PD-L1表達于活化的T淋巴細胞、B淋巴細胞、巨噬細胞、樹突細胞、成纖維細胞和其他某些腫瘤細胞的表面[4]。PD-1與PD-L1的結合可誘導活化T淋巴細胞的凋亡或衰竭[5]。PD-L1信號通路與腫瘤細胞的免疫逃逸密切相關[6-7]。有研究發現,PD-L1表達與多種惡性腫瘤患者的不良預后有關,包括非小細胞肺癌、胃癌、結直腸癌、腎細胞癌和乳腺癌[8-12]。研究表明,靶向PD-1/PD-L1通路的免疫檢查點抑制劑是在各種人類腫瘤的治療中極具發展前景的治療藥物[6]。已有一些關于PD-L1表達在食管癌患者預后中的價值的研究,但由于納入研究的患者數量均有限,PD-L1表達在食管癌患者預后中的意義尚存在爭議。因此,本研究探討了PD-L1在食管癌中的表達情況與患者臨床特征和預后的關系,旨在為食管癌的臨床治療提供參考依據,現報道如下。
1 研究方法
1.1 檢索策略
以“食管癌”“食管腫瘤““巴雷特腫瘤”“巴雷特癌”“PD-1”“PD-L1”“CD724”“B7-H1”“預后”“預測”為關鍵詞,由兩名研究人員獨立檢索PubMed、EMBASE、Medline和Cochrane臨床對照試驗中心注冊數據庫(ochrane central register of controlled trials,CENTRAL),并搜索谷歌學術和最新的會議。檢索策略基于《Cochrane干預措施系統評價手冊》的指導。符合要求的文獻納入標準:①原始研究中的患者均經組織病理學確診為食管癌;②采用免疫組織化學染色法檢測PD-L1在食管癌組織中的表達情況;③研究PD-L1的表達與食管癌患者總生存情況之間的關系。排除標準:原始文獻未采用Kaplan-Meier生存曲線進行生存分析,或數據不全,無法獲得風險比(hazard ratio,HR)數據。
1.2 文獻篩選、數據提取和質量評價
由兩名獨立的評審員按照文獻納入和排除標準篩選文獻,提取數據;若存在分歧,則通過與第3位評審員商議后達成共識。從每項登記的研究中提取以下信息:一般信息(包括第一作者的姓名、文獻的發表年份、文獻提取日期、文獻名稱、作者的出版物詳情)、研究所納入的患者數量、患者的臨床特征、免疫組織化學檢測方法、抗體、PD-L1陽性的臨界值、PD-L1陽性表達率、總生存期、估計HR、95%置信區間(confidence interval,CI)。若原始文獻未直接提供HR,本研究會通過電子郵件的方式向研究的作者發送請求。如果作者未給予回應,本研究會從生存曲線中提取數據。兩名研究人員使用隊列研究的紐卡斯爾-渥太華量表(Newcastle-Ottawa scale,NOS)對所納入的原始研究進行質量評估,若存在分歧,則采取討論的方式解決并達成共識。NOS通過研究人群選擇、可比性、暴露評價或結果評價3個評分部分對隨機對照研究、病例對照研究和隊列研究進行評價,共包含8個條目,對文獻質量的評價采用星級系統的半量化原則,滿分為9分,所有研究的NOS評分均在6分及以上的研究被認為是高質量研究。
1.3 統計學方法
匯總的HR及其相應的95%CI用于評估PD-L1表達與食管癌患者總生存情況的關系。若無HR和相應的95%CI,采用Parmar等[13]報道的方法對現有數據進行計算。匯總的比值比(odds ratio,OR)及其相應的95%CI用于評估PD-L1表達與食管癌患者臨床特征之間的關系。采用χ2檢驗(檢驗水準P<0.10)和I2檢驗(檢驗水準I2>50%)評估各項研究之間的異質性;P<0.10和I2>50%被定義為研究結果之間存在異質性;若存在異質性,則采用隨機效應模型合并分析數據,減少異質性對結果的影響;反之,則采用固定效應模型進行分析。采用Egger回歸法和Begg秩相關法對潛在的發表偏倚進行評估。采用Review Manager 5.3軟件和Stata 14.0軟件進行Meta分析。以P<0.05為差異有統計學意義。所有的P值和95%CI均是雙側檢驗結果。
2 結果
2.1 研究選擇及其特征
通過初步檢索,本研究共篩選出37項研究。通過閱讀文章題目和摘要,24條重復或與主題無關的文獻被剔除。對剩余13篇可能符合本研究納入標準的文獻全文進行詳細評估后,共12項符合納入標準的研究(包括2122例食管癌患者)被納入最終的Meta分析。所有研究均對總生存期有所記錄。根據NOS對12項研究進行質量評價,研究的質量評分為6~8分,研究的質量相對較高。(表1)
2.2 PD-L 1表達與食管癌患者預后的關系
PD-L1表達與食管癌患者的不良預后可能有關(HR=1.45,95%CI:1.15~1.84,P<0.01),死亡風險增加45%(圖1)。12項研究中僅有1項研究[14]納入的是關于食管腺癌(巴雷特食管癌)的研究,其他11項研究[15-25]均是關于PD-L1表達與食管鱗狀細胞癌患者總生存情況的關系的研究。因此,本研究進行了亞組分析,發現PD-L1表達與食管鱗狀細胞癌患者的不良預后可能有關(HR=1.39,95%CI:1.09~1.78,P<0.01),死亡風險增加39%(圖2)。
2.3 PD-L 1表達與食管癌患者臨床特征的關系

表1 2122例食管癌患者的基本臨床特征
食管癌患者食管癌組織中PD-L1的陽性表達與遠處轉移(OR=1.59,95%CI:1.07~2.35,P<0.05)和晚期(Ⅳ期)(OR=1.68,95%CI:1.05~2.69,P<0.05)有關,與食管癌位置為中上段(OR=0.78,95%CI:0.61~1.00,P=0.05)可能有關,但與性別(OR=0.94,95%CI:0.70~1.25,P>0.05)、分化程度(OR=0.69,95%CI:0.22~2.13,P>0.05)、浸潤深度(OR=0.01,95%CI:0.11~0.13,P>0.05)、淋巴結轉移(OR=1.74,95%CI:0.81~3.73,P>0.05)均無關。(圖3)
2.4 異質性分析
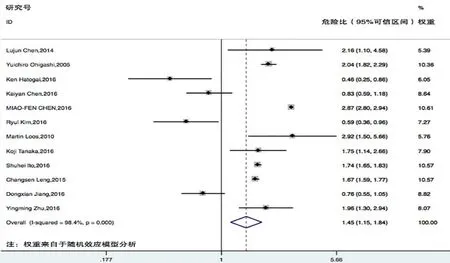
圖1 PD-L 1表達與食管癌患者預后風險相關性的森林圖
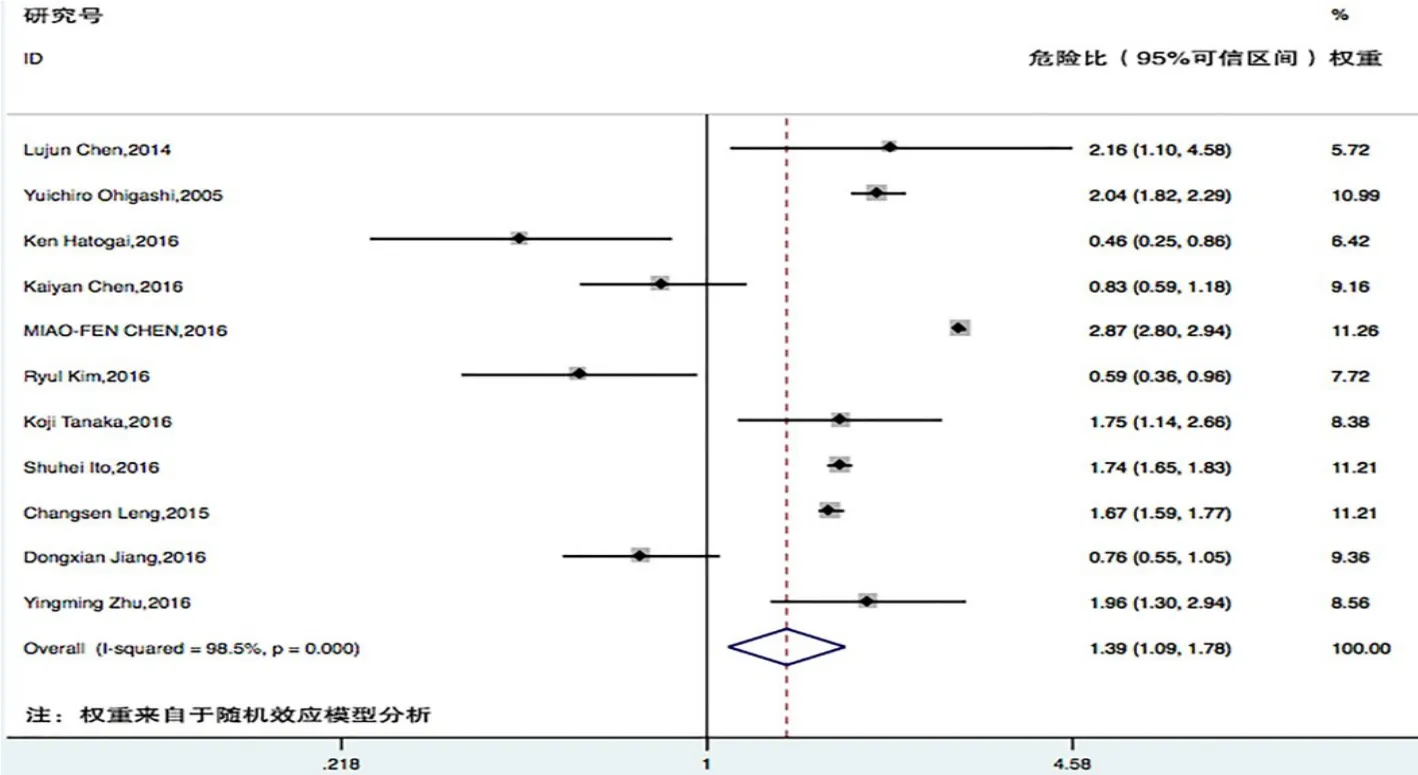
圖2 PD-L 1表達與食管鱗狀細胞癌患者預后風險相關性的森林圖

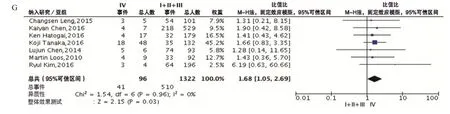
圖3 PD-L 1蛋白表達水平與食管癌患者臨床特征相關性的森林圖
采用χ2檢驗和I2檢驗分析了各項研究之間的異質性,其中,PD-L1表達與分化程度(P<0.01,I2=85%)、浸潤深度(P<0.01,I2=75%)和淋巴結轉移(P<0.01,I2=85%)的相關性分析之間存在異質性。因此,這些分析應用隨機效應模型,其他相關性分析使用固定效應模型。
2.5 發表偏倚和敏感性分析
采用Egger回歸法和Begg秩相關法對潛在的發表偏倚進行評估,結果顯示,各項研究間不存在發表偏倚(Egger’s test:P=0.058;Begg’s test:P=0.150)。
3 討論
PD-1/PD-L1信號通路在腫瘤的發生、發展中起著重要的作用。實體瘤組織中PD-L1陽性表達可促進腫瘤發生免疫逃逸,導致腫瘤患者預后不良[26]。既往研究認為PD-L1可能是潛在的預后標志物。然而,在食管癌中,PD-L1表達與預后之間的關系仍難以明確。多項研究表明,PD-L1表達與食管癌患者的不良預后有關[14-15,17-18,20,22-24],而其他研究未證實此結果[16,19,21,25]。
本研究通過匯總目前已發表的部分臨床研究,評估PD-L1表達與食管癌患者預后的關系,結果表明,PD-L1陽性表達可能與食管癌患者的不良預后有關,遠處轉移和晚期的食管癌患者更易出現PD-L1的陽性表達(P<0.05),中上段食管癌患者相比下段食管癌患者更傾向于PD-L1的陽性表達,但差異無統計學意義(P=0.05),而PD-L1的表達可能與性別、分化程度、浸潤深度、淋巴結轉移情況無關,分析其原因可能與樣本量不足有關。Qu等[27]進行了一項關于PD-L1表達與食管鱗狀細胞癌患者總生存期相關性的Meta分析,結果顯示,PD-L1陽性表達可能與ESCC患者的生存情況有關,但差異無統計學意義(HR=1.78,P>0.05),且PD-L1的表達情況與患者的臨床特征均無關。該Meta分析共包含8項研究,其中,有7項研究被本研究納入,一項低質量研究被本研究排除[28]。此外,本研究嚴格按照納入標準篩選文獻。為了更好地分析PD-L1表達與食管癌患者總生存情況的關系,納入標準明確要求原始文獻需能夠提供足夠的信息來估計關于OS的HR。因此,Jiang等[29]的研究因不符合本研究的納入標準而被剔除。
PD-L1過表達與食管癌患者的不良預后可能有關,提示PD-L1可能成為預測食管癌患者預后的新型生物標志物。PD-1/PD-L1信號途徑在腫瘤中的可能作用機制如下:首先,PD-L1可以通過下調磷酸化蛋白激酶 B(protein kinase B,PKB,又稱AKT)、磷酸化胞外信號調節激酶(extracellular signal-regulated kinase,ERK)和雷帕霉素靶蛋白(mechanistic target of rapamycin,MTOR)的表達以及上調人第10號染色體缺失的磷酸酶及張力蛋白同源的基因(phosphates and tensin homologue deleted on chromosome ten gene,PTEN)的表達從而調節誘導的調節性T細胞的生長、發育[7]。其次,PD-L1可能誘導免疫抑制性細胞因子白細胞介素-10(interleukin-10,IL-10)的產生,并在PD-L1與PD-1結合后促進調節性T細胞介導的免疫抑制[30-31]。最后,它可以誘導T淋巴細胞的凋亡、失能或耗盡,進而保護腫瘤細胞免于溶解[30-31]。
PD1/PD-L1信號通路的阻斷在惡性腫瘤的治療中發揮著積極的作用[32]。隨著個性化醫療的發展,迫切需要通過免疫生物標志物預測患者的生存情況和阻斷PD-1/PD-L1信號通路對腫瘤的治療效果。目前,一些評估PD-1抑制劑在食管癌中的安全性和有效性的臨床試驗正在進行。在KEYNOTE-028(NCT02054806)Ⅰ期臨床試驗的更新結果中,23例PD-L1陽性的食管癌患者采用PD-1抑制劑pembrolizumab進行治療,其中,12例患者(52.2%)的腫瘤消退,但中位無進展生存期尚未達到(5.5~11.8+)個月,這是第一個評價PD-1抑制劑在PD-L1陽性食管癌患者中有效性的研究[33]。在另一項CheckMate-032臨床試驗中,59例晚期或轉移性胃食管癌患者(其中包括9例食管癌患者)采用PD-1抑制劑nivolumab進行治療,疾病控制率為32.2%(19/59),緩解率為13.6%(8/59),其中,1例完全緩解,7例部分緩解;中位OS和中位PFS分別為5.0個月(95%CI:3.4~12.4個月)和1.4個月(95%CI:1.3~1.5個月)[34]。上述研究結果表明,PD-L1可能成為預測PD-1抑制劑對食管癌患者療效的指標[35]。本Meta分析發現,存在遠處轉移和晚期(Ⅳ期)的食管癌患者較不存在遠處轉移和早期(Ⅰ~Ⅲ期)的食管癌患者更易出現PD-L1陽性,而PD-L1陽性的食管癌患者可能從采用PD-1/PD-L1信號通路抑制劑的治療中獲益,表明PD-L1可能是食管癌患者預后的生物標志物,也可能對PD-1/PD-L1信號通路抑制劑對食管癌的臨床療效具有預測作用。
然而本研究仍存在一定的局限性:①納入文獻所提供的信息有限,本研究未分析TNM分期和治療策略與PD-L1表達的相關性,可能對研究結果產生影響;②不同研究中PD-L1陽性的臨界值不同,可能導致整體結果的異質性;③個別研究中的HR無法直接提取,本研究從Kaplan-Meier曲線中提取和估計其HR,可能會影響結果的準確性;④為了提高納入研究的質量,本研究僅納入英文文獻,可能導致發表偏倚;⑤由于食管癌在亞洲人群中相對多見,本Meta分析納入的研究以亞洲,尤其中國的研究為主,結論可能存在地域或種族因素的偏倚。盡管存在上述局限性,但是本Meta分析證明了PD-L1表達與食管癌患者生存情況的關系,可能有助于對食管癌患者進行更好的分層,進而提高PD-1/PD-L1信號通路抑制劑的療效。
綜上所述,PD-L1表達與食管癌患者預后不良、遠處轉移和晚期食管癌有關,并可幫助臨床醫師為食管癌患者選擇更合適的治療方案。為了進一步驗證這些研究結果,需要進行規模更大的同質性研究進行驗證。

