ε-聚賴氨酸鹽酸鹽與Nisin對蠟狀芽孢桿菌的協同作用及機理
史文艷 孫 震
(1.江南大學食品學院,江蘇 無錫 214122)
亞硝酸鹽可促進肉制品發色、形成特有風味、延長肉制品貨架期、抑制肉毒梭狀桿菌生長及毒素產生等優勢[1-5],只要符合GB 2760的規定限量,在肉制品加工中添加亞硝酸鹽是允許的。但亞硝酸鹽不僅對其他致病菌如蠟狀芽孢桿菌、金黃色葡萄球菌、產氣莢膜桿菌的抑制作用微弱[6],且存在潛在致癌風險[7-8],因此,研究開發出比亞硝酸鹽更安全的可用于肉制品的抑菌劑具有重要意義。
ε-聚賴氨酸鹽酸鹽(ε-PLH)具有廣譜抑菌性,不僅可抑制革蘭氏陽性菌(G+)及真菌,而且對部分革蘭氏陰性菌(G-)也有強烈抑制作用。乳酸鏈球菌素(Nisin)對G+菌具有較強抑制作用,特別是對可生成芽孢的細菌,但對G-基本無抑制作用。現有研究還未發現某種食品抑菌劑單獨使用就能有效抑制或殺死食品中所有微生物,抑菌劑復配使用不僅可降低單一抑菌劑使用量,而且還能增強抑制效果。本試驗旨在研究ε-PLH與Nisin的聯合抑菌作用及其機制,為ε-PLH和Nisin在低溫肉制品中的復合應用提供科學依據。
1 材料與方法
1.1 材料與儀器
1.1.2 材料與試劑
蠟狀芽孢桿菌(Bacilluscereus):江南大學食品學院實驗室保存;
營養肉湯培養基、平板計數培養基:國藥集團化學試劑有限公司;
ε-PLH:92.87%,江蘇一鳴生物股份有限公司;
乳酸鏈球菌素(Nisin):106IU/g,江蘇一鳴生物股份有限公司;
碘化丙啶PI染色液:50 μg/mL,含RNase,上海源葉生物科技有限公司;
堿性磷酸酶試劑盒、AKP試劑盒、ATP酶試劑盒、考馬斯亮藍試劑盒:南京建成生物工程研究所;
鹽酸:分析純,國藥集團化學試劑有限公司;
2,4-二硝基苯肼:分析純,上海阿拉丁生化科技股份有限公司;
DNP試劑:精確稱取594 mg 2,4-二硝基苯肼,溶于1 000 mL 2 mol/L HCl溶液中,搖勻完全溶解后,置于棕色瓶中,4 ℃保存備用。
1.1.3 儀器與設備
電子天平:FA2204B型,上海精科天美科學儀器有限公司;
手提式不銹鋼壓力蒸汽滅菌鍋:SYQ-DSX-280B型,上海申安醫療器械廠;
新世紀紫外可見光光光度計:T6型,北京普析通用儀器有限責任公司;
隔水式恒溫培養箱:GNP-9270型,上海精宏實驗設備有限公司;
超凈工作臺:ZHJH-C1209C型,上海智城分析儀器制造有限公司;
高速冷凍離心機:CR21GⅢ型,日本日立公司;
流式細胞儀:FACSCalibur型,美國BD公司;
電泳儀:1645050型,美國伯樂公司;
化學發光凝膠成像系統:ChemiDoc XRS+型,美國伯樂公司。
1.2 方法
1.2.1 菌懸液的制備 蠟狀芽孢桿菌用牛肉膏蛋白胨培養基進行增殖培養,臨用時用無菌磷酸緩沖鹽溶液(PBS)稀釋至所需菌濃度。
1.2.2ε-PLH、Nisin對蠟狀芽孢桿菌最小抑菌濃度(MIC)的測定 以蠟狀芽孢桿菌為研究對象,采用試管二倍稀釋法。以最后1根澄清試管內防腐劑的濃度計為能抑制蠟狀芽孢桿菌生長的最低濃度。同時測定600 nm 處菌懸液的吸光值,得到關于ε-PLH和Nisin劑量和抑菌率的關系。按式(1)計算抑菌率。
(1)
式中:
I——抑菌率,%;
A1——陽性對照組的吸光值;
A0——陰性對照組的吸光值;
A——試驗組的吸光值。
1.2.3ε-PLH、Nisin對蠟狀芽孢桿菌聯合作用效果的測定 采用棋盤法,用試管代替96孔板。37 ℃培養18 h后肉眼觀察結果,分光光度計測定600 nm處的吸光值,按式(2)計算分級抑菌濃度指數FICI,并判斷相互作用類型。
FICI=MIC(A聯合)/MIC(A單獨使用)+MIC(B聯合)/MIC(B單獨使用),
(2)
式中:
FICI——分級抑菌濃度指數;
MIC(A聯合)、MIC(B聯合)——分別表示聯合使用時Nisin和ε-PLH的最小抑菌濃度,mg/L;
MIC(A單獨使用)、MIC(B單獨使用)——分別表示Nisin和ε-PLH單獨使用時的最小抑菌濃度,mg/L。
FICI<0.5,協同作用;0.5
1.2.4 樣品的處理 蠟狀芽孢桿菌的菌懸液稀釋至106CFU/mL,加入ε-PLH與Nisin溶液,使菌懸液中抑菌劑的終濃度分別為1/4 MICε-PLH,1/4 MIC Nisin,1/8 MICε-PLH+1/8 MIC Nisin,以等量無菌PBS替代防腐劑作為空白對照。
1.2.5ε-PLH、Nisin對蠟狀芽孢桿菌蠟狀芽孢桿菌菌體活力的影響 根據文獻[9]修改如下:樣品經37 ℃培養4 h 后取出,加入PI染色液,避光作用15 min,流式細胞儀分析。
1.2.6ε-PLH、Nisin對蠟狀芽孢桿菌細胞壁完整性的影響 根據文獻[10]修改如下:樣品經37 ℃培養3 h后取1 mL菌液,4 ℃下3 500 r/min離心10 min。取100 μL上清,依次測定樣品的AKP的活性。
1.2.7 ε-PLH、Nisin對蠟狀芽孢桿菌ATPase活力的影響 根據文獻[11]修改如下:樣品于5 000 r/min下離心5 min后棄去上清液,無菌生理鹽水洗滌菌體并重懸;經超聲波破碎后,12 000 r/min冷凍離心20 min,所得上清液備用。用ATP酶試劑盒進行測定。
1.2.8ε-PLH、Nisin對蠟狀芽孢桿菌代謝過程中丙酮酸含量的影響 根據文獻[12],采用DNP法對蠟狀芽孢桿菌代謝過程中丙酮酸含量進行測定。所得丙酮酸含量的標準曲線方程為:y=0.040 1x+0.005 7,R2=0.999 6。
1.2.9ε-PLH、Nisin對蠟狀芽孢桿菌紫外吸收物的影響
根據文獻[13]的試驗方法,修改如下:菌懸液3 500 r/min 離心5 min,無菌PBS洗滌2次。37 ℃培養,于0,1,3,5,7,9,12 h取樣,經0.22 μm濾膜過濾,測定260 nm處的吸光值。
1.2.10ε-PLH、Nisin對蠟狀芽孢桿菌菌體蛋白的影響
根據文獻[14]的試驗方法,修改如下:37 ℃培養3,6 h 后取樣。3 500 r/min 離心10 min,取菌體沉淀,經PBS洗滌2次后用定量無菌水溶解,4 ℃下10 000 r/min 離心10 min,取上清液100 μL,加入25 μL上樣緩沖液,沸水浴5 min,上樣操作,進行SDS-PAGE電泳。
1.3 數據處理
Origin 9.0進行數據處理和分析,SPSS軟件進行顯著性分析。
2 結果與分析
2.1 ε-PLH與Nisin對蠟狀芽孢桿菌MIC的影響
通過肉眼觀察,得到ε-PLH、Nisin作用于蠟狀芽孢桿菌的MIC分別為12.5,6.25 mg/L。結合ε-PLH、Nisin對蠟狀芽孢桿菌作用的抑菌率(見表1)可看出,隨著ε-PLH、Nisin濃度的升高,抑菌率也逐漸增大,當ε-PLH、Nisin分別為12.5,100 mg/L時,可完全抑制蠟狀芽孢桿菌的生長。由此說明,通過僅肉眼觀察會造成很大的誤差,影響結果的準確性。
2.2 ε-PLH與Nisin對蠟狀芽孢桿菌聯合作用效果
ε-PLH與Nisin對蠟狀芽孢桿菌聯合作用效果見表2。
由表2可計算出,FICI=0.25,FICI<0.5,故ε-PLH與Nisin對蠟狀芽孢桿菌具有協同抑制作用。
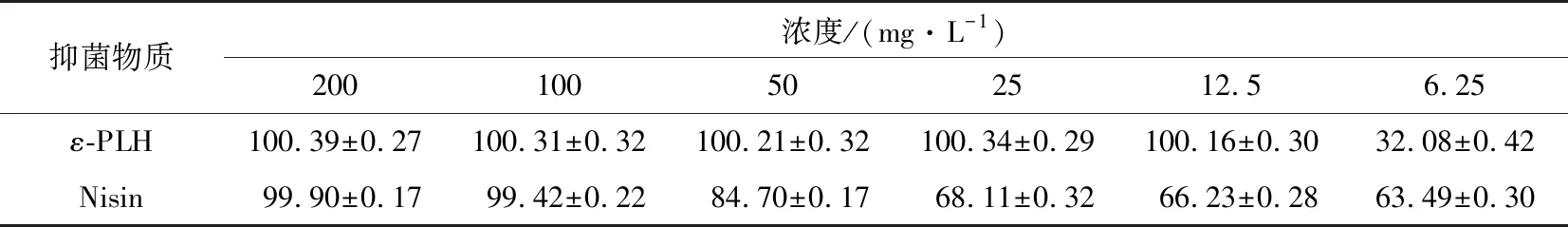
表1 ε-PLH、Nisin對蠟狀芽孢桿菌作用的抑菌率
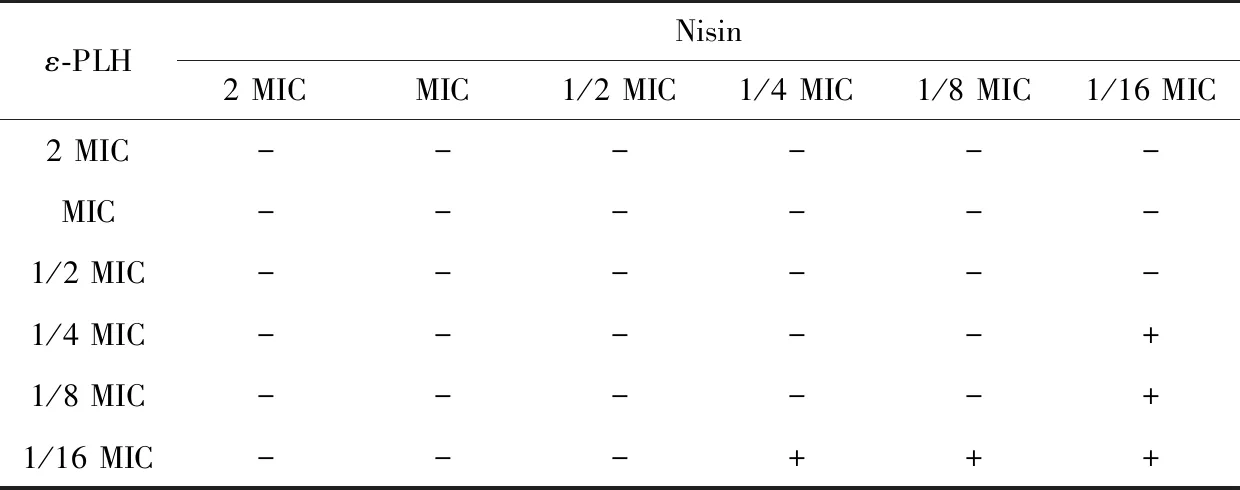
表2 ε-PLH與Nisin對蠟狀芽孢桿菌聯合作用效果
? “-”表示無菌落生長;“+”表示有菌落生長。
2.3 ε-PLH與Nisin對蠟狀芽孢桿菌細胞壁完整性的影響
細胞壁具有保護細胞抵抗外界不利因素、固定細胞外形、保證細胞完整性等功能。堿性磷酸酶通常位于細菌細胞壁與細胞膜之間,只有在細胞壁出現破損時,AKP才會從壁膜之間泄露出去。通過測定堿性磷酸酶的活性強弱,可判斷出菌體細胞壁被破壞的程度。
由表3可知,與對照組相比,經ε-PLH、Nisin處理過的蠟狀芽孢桿菌菌懸液中AKP含量均有所升高,尤其是ε-PLH、Nisin聯合作用時AKP活力最高,說明細胞壁結構被破壞程度大,細胞壁通透性增加,推測可能會影響蠟狀芽孢桿菌的生長和代謝活動。
ε-PLH、Nisin對蠟狀芽孢桿菌細胞膜的破壞作用與Chen等[15]所研究的大分子聚合抑菌劑對G+和G-細菌膜結構的破壞作用機制類似。其研究表明,由于細菌帶負電,抑菌劑具有高的正電荷密度,靜電相互作用很快使它們彼此接觸。當亞硝酸鹽細菌處于懸浮液中時,抑菌劑從細菌中置換表面二價離子如鈣和鎂,并與帶負電荷的磷脂膜結合,迅速中和甚至逆轉細菌的表面電荷,從而引起膜滲透性的輕微變化。該階段,抑菌劑與細菌的相互作用是可逆的,當抑菌劑濃度更高時,相對高的濃度可使膜蛋白變性并開始滲透磷脂雙層,膜滲透性的增加導致鉀離子泄漏,使膜結構進一步不穩定。最終,高濃度的殺菌劑導致細菌膜完全崩解,起到殺菌作用。
表3ε-PLH、Nisin對蠟狀芽孢桿菌的AKP含量的影響?
Table3Effectofε-polylysinehydrochlorideandNisinonAKPcontentofBacilluscereus(n=3)

組別AKP活力/(King Unit·g-1·Prot)空白對照0.78±0.02a1/4 MIC ε-PLH0.93±0.03c1/4 MIC Nisin1.09±0.03b1/8 MIC ε-PLH+1/8 MIC Nisin1.45±0.04d
? 不同字母表示差異顯著(P<0.05)。
2.4 ε-PLH與Nisin對蠟狀芽孢桿菌菌體活力的影響
碘化丙啶(PI)能夠透過死亡細胞或破損的細胞膜而對DNA進行染色,不能透過活細胞膜,故常用于鑒定死細胞。通過流式細胞儀檢測細胞數量和熒光強度的變化,可直觀得出菌體的存活率和損傷情況[16-17]。
由圖1可看出,與空白對照相比,經ε-PLH、Nisin作用后的蠟狀芽孢桿菌的熒光強度明顯增大,表明細胞壁膜結構均遭到破壞,細胞膜通透性增大。ε-PLH、Nisin聯合作用時熒光強度最大,菌體被破壞的程度最大,菌體活力最低,表明ε-PLH、Nisin 對蠟狀芽孢桿菌具有協同抑制作用。
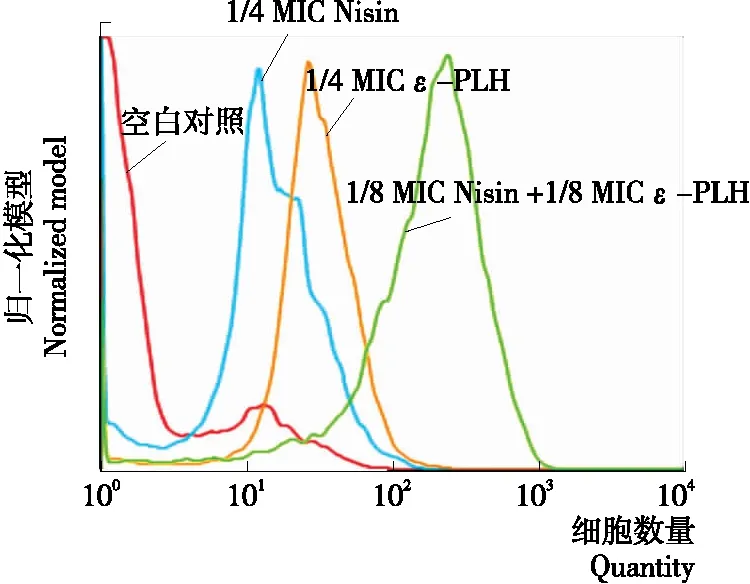
圖1 ε-PLH、Nisin作用蠟狀芽孢桿菌經PI染色后的
Figure 1 Flow cytometry analysis of ε-polylysine hydrochloride and Nisin acting on Bacillus cereus by PI staining
2.5 ε-PLH與Nisin對蠟狀芽孢桿菌ATPase活力的影響
ATPase存在于組織細胞及細胞器的膜上,在物質運送、能量轉換以及信息傳遞方面具有重要作用。通過檢測ATPase的含量,可以間接地反映出ε-PLH、Nisin對蠟狀芽孢桿菌能量代謝過程的影響。
由表4可看出,經過ε-PLH、Nisin處理過的蠟狀芽孢桿菌Na+K+-ATPase活力顯著下降,說明能量代謝過程受阻,經ε-PLH、Nisin聯合處理的蠟狀芽孢桿菌ATPase活力最低,結合對細胞壁的完整性的影響,推測可能是Nisin主要作用于破壞細胞膜結構而增加細胞壁膜的通透性,使ε-PLH更容易作用于蠟狀芽孢桿菌的內部結構,導致菌體代謝活動受阻,影響蠟狀芽孢桿菌的生長和代謝活動。
表4ε-PLH、Nisin對蠟狀芽孢桿菌Na+K+-ATPase活力的影響?
Table4Effectofε-polylysinehydrochlorideandNisinontheactivityofBacilluscereusNa+K+-ATPase(n=3)
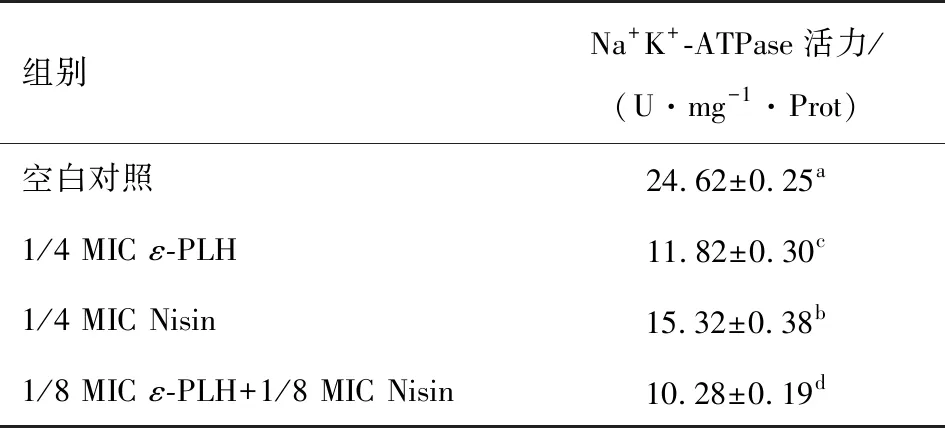
組別Na+K+-ATPase活力/(U·mg-1·Prot)空白對照24.62±0.25a1/4 MIC ε-PLH11.82±0.30c1/4 MIC Nisin15.32±0.38b1/8 MIC ε-PLH+1/8 MIC Nisin10.28±0.19d
? 不同字母表示差異顯著(P<0.05)。
2.6 ε-PLH與Nisin對蠟狀芽孢桿菌代謝過程中丙酮酸含量的影響
丙酮酸是機體代謝的中間產物,處于糖酵解途徑的末端,同時它又連接著EMP途徑和TCA循環。作為能量代謝的中間產物,丙酮酸含量的多少可間接反映代謝活動的進程。
由圖2可看出,蠟狀芽孢桿菌代謝過程中丙酮酸含量經歷了升高、下降再升高的過程。與對照組相比,經過1/4 MICε-PLH、1/4 MIC Nisin單獨處理過的蠟狀芽孢桿菌菌懸液中,丙酮酸含量變化不大;但經過1/8 MICε-PLH 與1/8 MIC Nisin聯合處理過的蠟狀芽孢桿菌菌懸液中,丙酮酸含量顯著下降,說明二者聯合作用影響甚至阻礙了蠟狀芽孢桿菌的能量代謝過程。
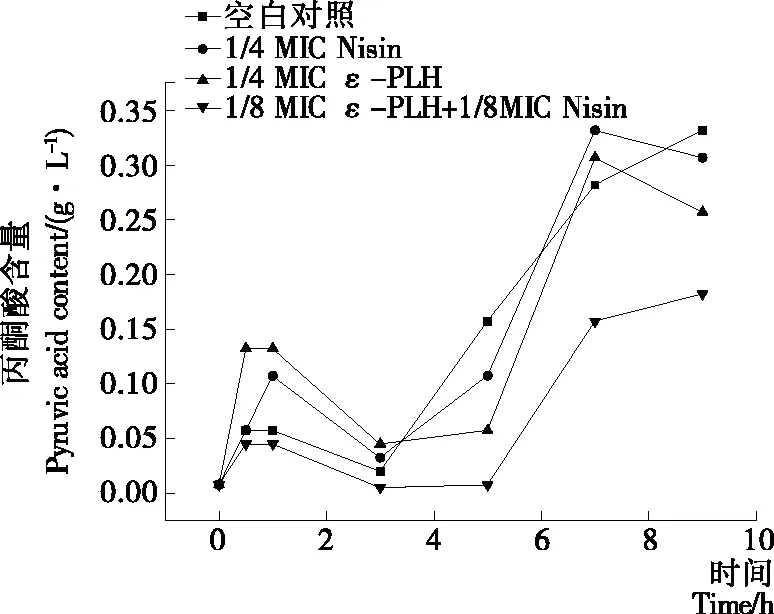
圖2 ε-PLH、Nisin對蠟狀芽孢桿菌代謝過程中丙酮酸
Figure 2 Effect ofε-polylysine hydrochloride and Nisin on pyruvate content in the metabolism ofBacilluscereus
2.7 ε-PLH與Nisin對蠟狀芽孢桿菌紫外吸收物的影響
核苷酸類物質在260 nm處有強吸收,如果細菌膜受損,可通過檢測260 nm處的吸光度而估計出從細胞質釋放的DNA和RNA的量,從而評定細胞膜的完整性。
由圖3可看出,對照組基本無紫外吸收,而經ε-PLH、Nisin處理后的蠟狀芽孢桿菌菌懸液的紫外吸收均有所增加,說明蠟狀芽孢桿菌的細胞膜結構受到了不同程度的破壞,導致細胞內容物的滲漏,從而進一步影響菌體代謝和生長。經ε-PLH、Nisin聯合處理后,菌懸液紫外吸收值最大,說明聯合使用后菌體細胞膜破損程度最高,與AKP結果相對應。從而進一步證明了ε-PLH與Nisin對蠟狀芽孢桿菌具有協同抑制作用,其中Nisin對蠟狀芽孢桿菌的細胞膜結構的破壞程度要強于ε-PLH,說明二者聯合使用時Nisin主要作用是破壞膜結構,而ε-PLH則是影響代謝活動。
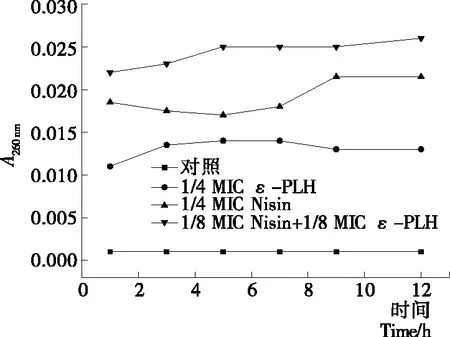
圖3 ε-PLH、Nisin對蠟狀芽孢桿菌紫外吸收物
Figure 3 Effect ofε-polylysine hydrochloride and Nisin on the content of UV absorption ofBacilluscereus
2.8 ε-PLH與Nisin對蠟狀芽孢桿菌菌體蛋白的影響
對菌體總蛋白的SDS-PAGE分析可證明抑菌劑能否影響和阻礙細胞內蛋白質的表達。
與對照組相比,經ε-PLH處理過的蠟狀芽孢桿菌菌體蛋白質(2,4,6,8泳道)中,小分子蛋白質尤其是<10 kDa分子量的蛋白質明顯增多,說明ε-PLH可能影響了蛋白質的合成和分解過程,可將大分子蛋白質分解成小分子蛋白質。經1/4 MIC Nisin處理后,電泳條帶無明顯變化;經1/8 MICε-PLH+1/8 MIC Nisin處理后,大分子量蛋白質條帶顏色變淺,小分子蛋白質增多且顏色加深,說明二者聯合作用對菌體的蛋白質表達和正常代謝有一定抑制作用,且這種作用隨著培養時間的延長而增強。
3 結論
ε-PLH、Nisin抑制蠟狀芽孢桿菌的最小抑菌濃度分別為12.5,6.25 mg/L,并且二者具有協同抑制作用。協同抑菌機理為:Nisin首先破壞細胞壁胞膜,當菌體的細胞膜受損后,半透性喪失、流動性減弱、細胞的內容物外泄。隨后ε-PLH進入細胞胞內,抑制了細胞膜上的ATP酶活力、影響蛋白的合成和表達、導致細胞內多種代謝途徑受阻,同時影響細胞膜的穩定性和多種酶的反應活性,達到協同抑菌的效果。后續研究可考慮在DNA分子水平或結合蛋白組學進一步探究ε-PLH、Nisin的協同抑菌機制。
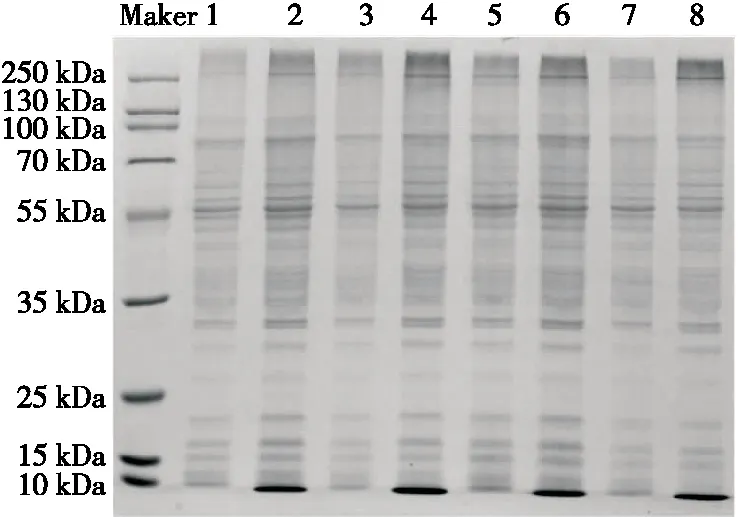
1~4分別為對照組,經過1/4 MIC ε-PLH,1/4 MIC Nisin以及1/8 MIC ε-PLH+1/8 MIC Nisin處理3 h后的電泳條帶;5~8分別為對照組,經過1/4 MIC ε-PLH,1/4 MIC Nisin以及1/8 MIC ε-PLH+1/8 MIC Nisin處理6 h后的電泳條帶。
圖4 ε-PLH、Nisin作用下蠟狀芽孢桿菌菌體蛋白的SDS-PAGE電泳
Figure 4 SDS-PAGE electrophoresis ofBacilluscereusbacterial protein under the action of ε-polylysine hydrochloride and Nisin

