等離子體活化冰對東方對蝦保鮮及品質的影響
艾春梅謝小本廖新浴蘇 遠高凌霄王玨帆劉東紅葉興乾丁 甜姜竹茂
(1. 煙臺大學生命科學學院,山東 煙臺 264005;2. 浙江大學生物系統工程與食品科學學院, 浙江 杭州 310058;3. 紹興咸亨食品股份公司,浙江 紹興 312000;)
東方對蝦(Penaeusorientalis)又稱大正蝦,“世界三大名蝦”之一,是中國主要的增殖養殖種類[1]。
在傳統方法中,蝦的儲存方式是將其放置在0~4 ℃的溫度下,或者在冷海水中保藏[2-3],雖然操作簡單,成本低,但貨架期短[4],在加工、儲存與運輸過程中容易腐敗變質。近年來國內外對蝦的保鮮技術也有廣泛的研究,Li等[5]利用高靜水壓力(HHP)處理白對蝦,以提高蝦體內多酚氧化酶(PPO)的失活率;Bono等[6]研究冷凍結合MAP技術與亞硫酸鹽處理(SUL)技術對紅魔蝦貯藏期間的相關品質進行對比;劉品[7]在研究中提到了低溫保鮮、化學保鮮、生物保鮮及酸性電解水保鮮等技術。
低溫等離子體活化水(PAW)是一種新型的殺菌技術,具有廣譜的殺菌特點。近幾年PAW在醫院消毒、水果的殺菌及肉質保鮮護色方面應用較多,還并未運用到肉制品方面保鮮。沈瑾等[8]研究了低溫等離子體活化水的殺菌效果及相關性能,結果顯示:每次制備活化水對金黃色葡萄球菌、大腸桿菌、銅綠假單胞菌,都有殺菌作用,殺滅對數值均>5.0。Ma等[9]利用非熱等離子體活化水對采后楊梅果實腐爛和品質的影響進行研究,結果顯示:PAW處理過的果實,腐爛率減少50%,貯藏結束,楊梅的品質也并未發生變化。因此,本試驗以等離子體活化冰貯藏東方對蝦,評估等離子體活化冰對蝦的保鮮效果和品質的影響,旨在開發出合適的等離子體活化冰的貯藏技術,為東方對蝦的加工貯藏提供理論依據。
1 材料與方法
1.1 材料
鮮活東方對蝦:重量為6~8 g/只,中國杭州三水蔬菜有限公司。
1.2 試劑
三氯乙酸、硫代巴比妥酸(TBA)、氯仿、乙二胺四乙酸(EDTA)、無水乙醇、鹽酸、氫氧化鈉、氯化鈉:分析純,國藥集團化學試劑有限公司;
PCA培養基:生化試劑,青島高科技工業園海博生物技術有限公司;
高氯酸、甲基紅、溴甲酚綠:分析純,上海阿拉丁生化科技有限公司。
1.3 儀器與設備
恒溫水浴鍋:SHJ-6AB型,常州金壇良友儀器有限公司;
介質阻擋放電等離子發生儀:CTP-2000K型,南京蘇曼科技有限公司;
色差儀:WSD-Ⅲ型,北京康光儀器有限公司;
質構儀:TA-XT2i型,英國Stable Micro System公司;
電導率儀:DDS-22C型,杭州陸恒生物科技有限公司;
便攜pH計:pHB-1型,上海三信儀表廠;
高速低溫離心機:HC-3018R型,安徽中科中佳科學儀器有限公司;
分光光度計:722N型,上海儀電科學儀器股份有限公司;
恒溫培養箱:LRH-250型,上海—恒科技有限公司;
全波長酶標儀:1510型,賽默飛世爾(上海)儀器有限公司;
全自動凱氏定氮儀:ZDDN-111型,浙江托普儀器有限公司;
拍打式均質機:I Mix?型,法國iMAX公司。
1.4 方法
1.4.1 等離子體活化冰制備方法 使用介質阻擋放電式等離子體發生儀運用離子水不間斷處理5 min,收集2 L后裝入無菌自封袋,在-20 ℃冰箱避光保存待用。純水制冰同法。
1.4.2 樣品處理與貯藏方法 將蝦放入托盤中,分別在蝦上下鋪上純水碎冰(A組)與等離子體碎冰(B組),分為2組,每組冰量2 L。置于20 ℃下放置,每隔12 h換一次冰,并在不同貯藏時間(0,1,2,3,4,5,6 d)條件下,對蝦進行品質分析。
1.4.3 等離子體活化冰揮發動力學研究方法 純水制備等離子體中過氧化氫、OH自由基及活性氧等活性物質在冰藏過程中發揮重要作用,根據等離子體活化冰貯藏期的pH、電導率、氧化能力以及過氧化氫含量隨貯藏時間的變化,以判斷其等離子體活化冰的穩定性[10]53-83。
1.4.4 對蝦在等離子體活化冰貯藏期的品質
(1) pH測定:使用pH計測定。每組隨機取3只蝦剪成碎肉,取5 g蝦肉置于100 mL錐形瓶,加45 mL去離子水,浸泡30 min,每5 min攪勻1次,之后取濾液測定pH值,每次測定3個平行。
(2) 硫代巴比妥酸(TBA)檢測:參照遲海等[11]的試驗方法處理樣品,采用外標法標定蝦肉中TBA含量,在532 nm處測定吸光度值,根據標準曲線,以每1 kg肉中丙二醛的mg來表示。每次測定3個平行。
(3) 揮發性鹽基氮(TVB-N)檢測:按照GB 5009.228—2016《食品安全國家標準 食品中揮發性鹽基氮的測定》執行,每次測定3個平行。
(4) 菌落總數檢測:按照GB 4789.2—2016《食品安全國家標準 食品微生物學檢驗 菌落總數測定》執行,每次測定3個平行。
(5) 細菌多樣性檢測:使用第二代基因組測序方法[12-13]對蝦中的菌群進行分析,尋找其中是否存在食源性致病菌[14],提取不同處理組蝦的DNA進行測序,結果與文庫對比分析計算出細菌的菌屬及其在所有菌屬中的占比。
(6) 硬度檢測:試驗使用質構儀(圓柱探針直徑5 mm,型號P5)進行測定,測前速率1 mm/s,測試速率5 mm/s,測后速率5 mm/s,感應力5 g,試樣變形50%,在室溫下進行TPA分析。每次測定3個平行。
(7) 色差檢測:試驗使用色差儀測定對蝦蝦頭的亮度L,紅綠a,藍黃b值,根據式(1)計算總色差值,每次測定3個平行。
(1)
式中:
L0——儀器經自檢及零點、白板校正后貯藏蝦頭的L值;
a0——儀器經自檢及零點、白板校正后貯藏零點蝦頭的a值;
b0——儀器經自檢及零點、白板校正后貯藏零點蝦頭的b值。
1.5 數據處理
數據采用Origin繪圖,采用SPSS進行統計分析。
2 結果與分析
2.1 等離子體活化冰的揮發動力學研究
2.1.1 等離子體活化冰貯藏期pH變化 根據圖1可以看出,B組貯藏過程pH一直恒定在3左右,且平行性較好,主要原因是等離子活化冰在貯藏過程中產生硝酸、亞硝酸等[10]60-64,具有較好的穩定性。
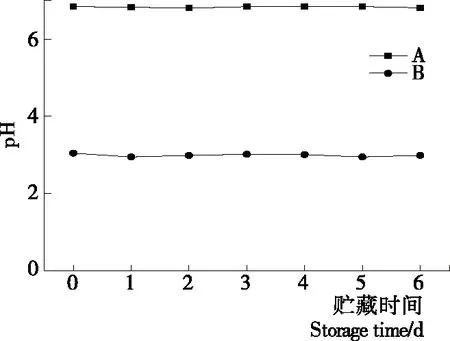
圖1 A組與B組貯藏期pH值變化
2.1.2 等離子體活化冰貯藏期電導率變化 如圖2所示,在整個貯藏期內,B組數值上遠遠大于A組,A組電導率為1.8~2.4 μS/cm,B組的電導率在第0天時為429.3 μS/cm,后續在1~6 d時直線下降。
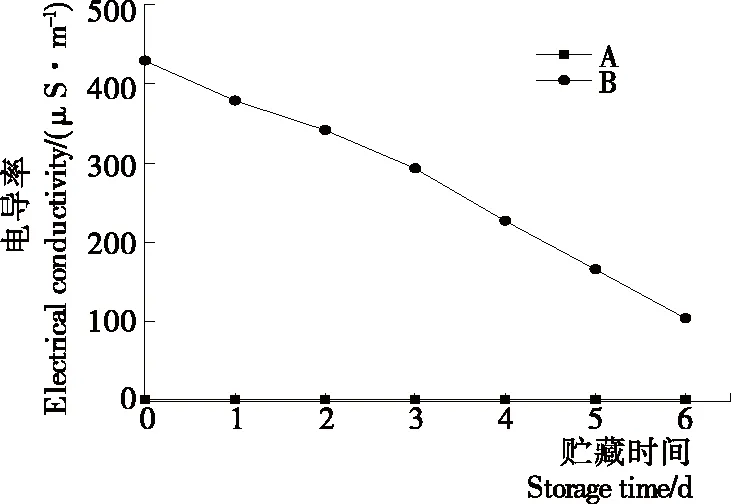
圖2 A組與B組貯藏期電導率值變化
2.1.3 等離子體活化冰貯藏期氧化還原電位與過氧化氫含量變化 由圖3可知,在整個貯藏期內,A組的氧化還原電位幾乎保持恒定,B組氧化還原電位隨著貯藏時間的延長呈下降趨勢。貯藏時間第0天的氧化還原電位是484 mV,第1天的氧化還原電位是442 mV,下降了42 mV,與郭儉[10]55-83的研究結果一致。
如圖4所示,與氧化還原電位相比,過氧化氫濃度與氧化還原電位變化趨勢一致,A組的過氧化氫濃度幾乎保持恒定,B組過氧化氫濃度隨著貯藏時間的延長呈下降趨勢,但貯藏時間在第6天時,過氧化氫濃度與A組相同。
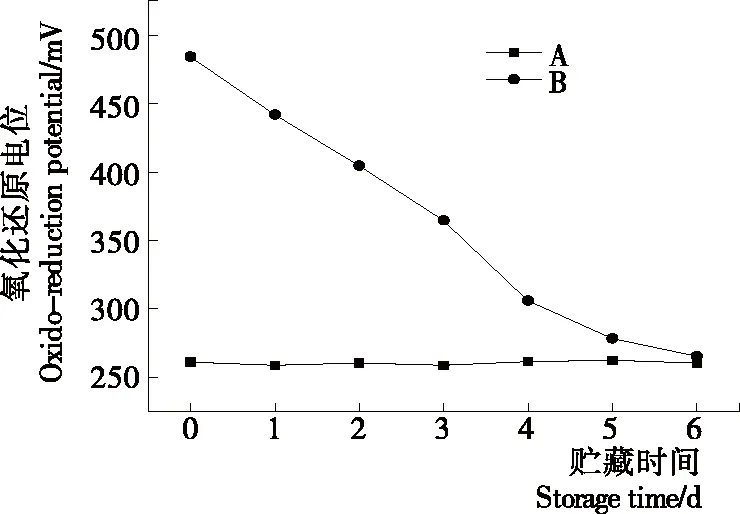
圖3 A組與B組貯藏期氧化還原電位變化
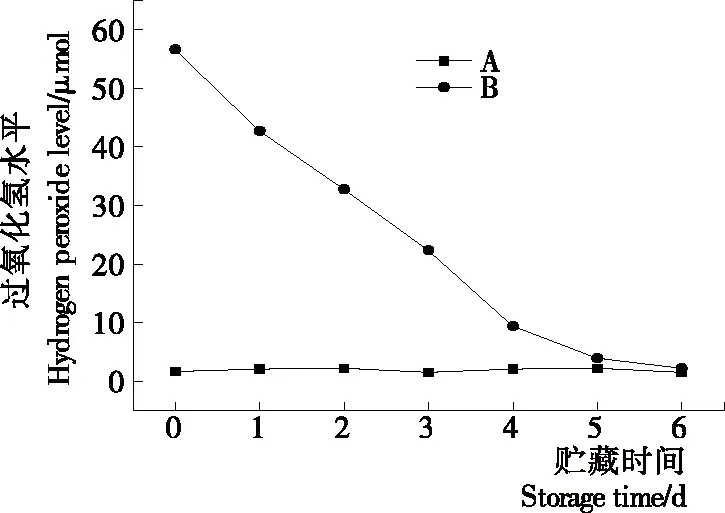
圖4 A組與B組貯藏期過氧化氫濃度變化
Figure 4 Changes of hydrogen peroxide concentration during the storage period of group A and group B
綜合等離子體活化冰在貯藏期4個指標的變化,等離子體活化冰中的過氧化氫的含量較穩定,并能以一定的速率揮發。在儲存期內,等離子體活化冰氧化還原電位始終高于標準值222 mV,儲存期內保持有一定的氧化能力,有利于破壞細菌蛋白質與核酸結構,從而抑制細菌生長[15]。
2.2 對蝦貯藏期的品質分析
2.2.1 等離子體活化冰貯藏中蝦的pH值變化 如圖5所示,2個處理組蝦的pH值均由中性逐漸上升變為弱堿性,這與其他保鮮劑處理對蝦的結果相符合[16]。前3 d 2組相差不明顯,到第6天,2組蝦的pH差值增大至0.4,B組蝦的pH達到最大值7.53,而A組蝦的pH值達到7.94。說明等離子體活性物質可以抑制細菌分解蛋白質與含氮化合物,進而造成蝦肉堿性增大。
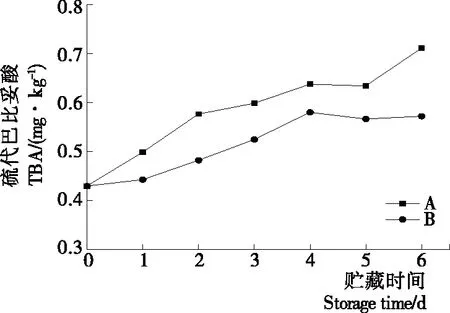
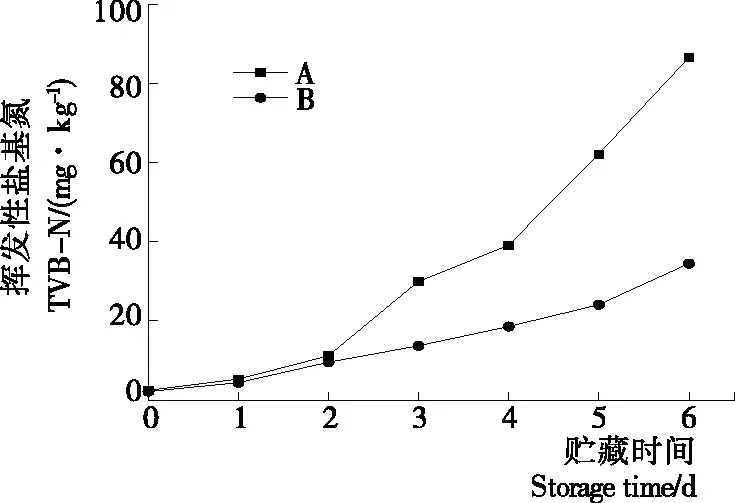
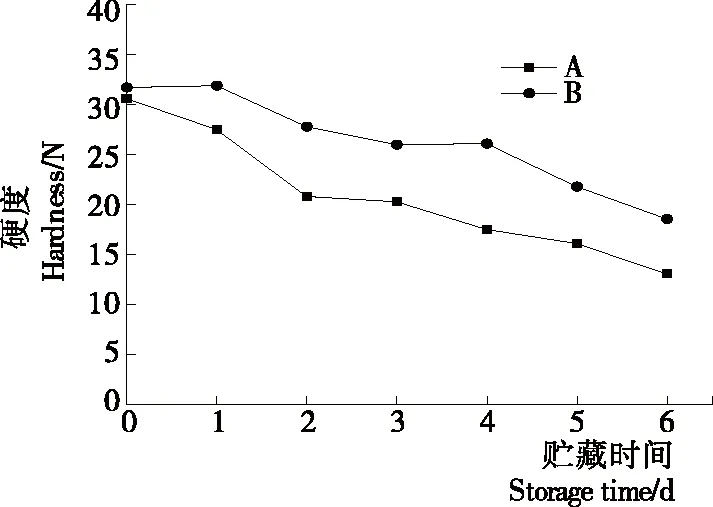
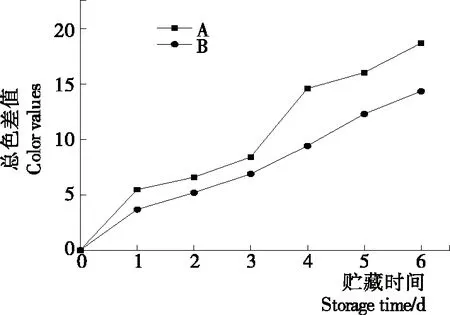
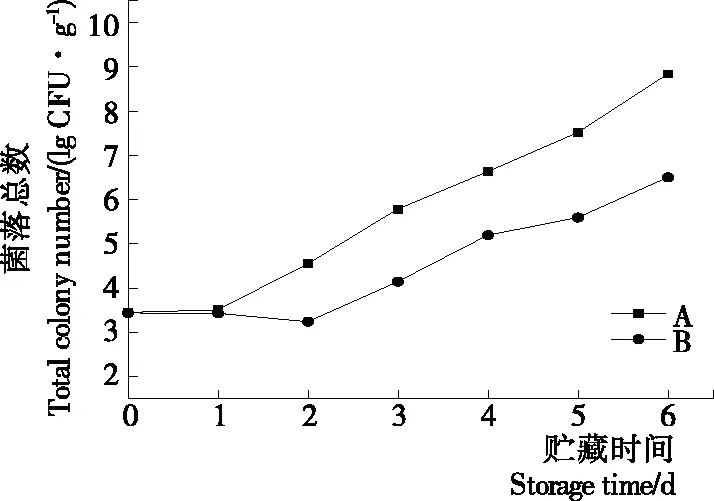
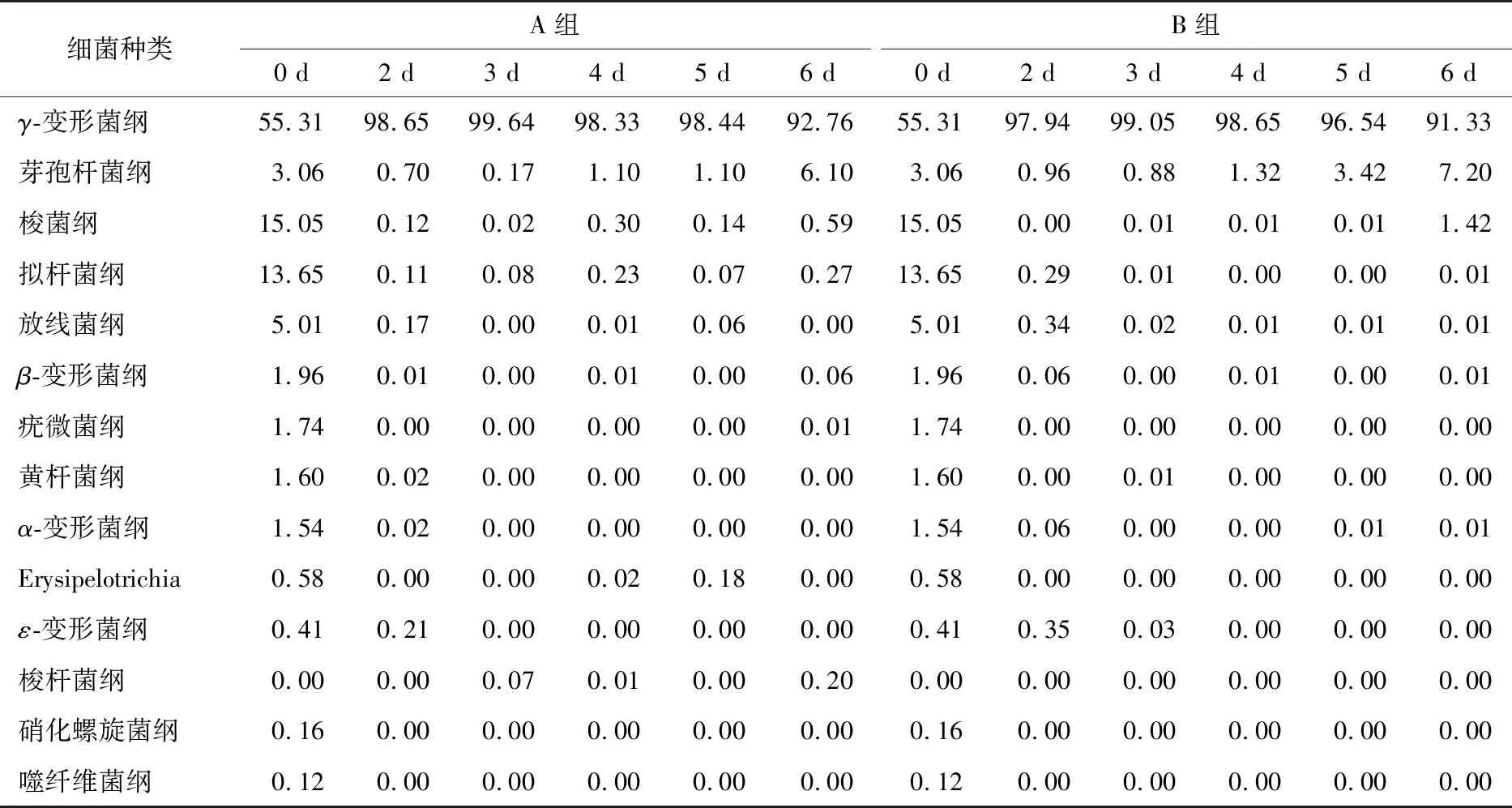
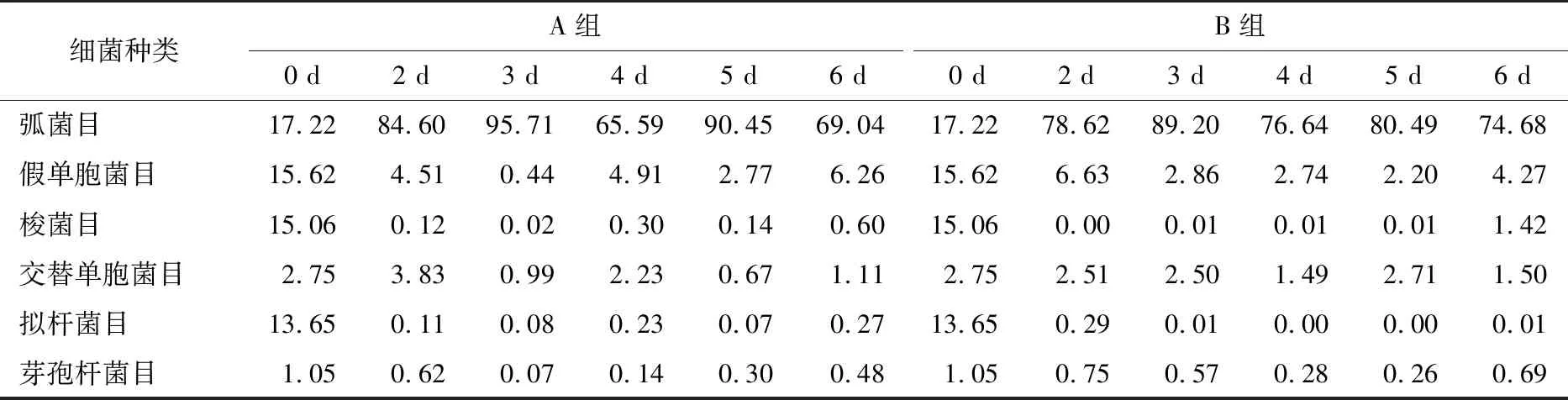
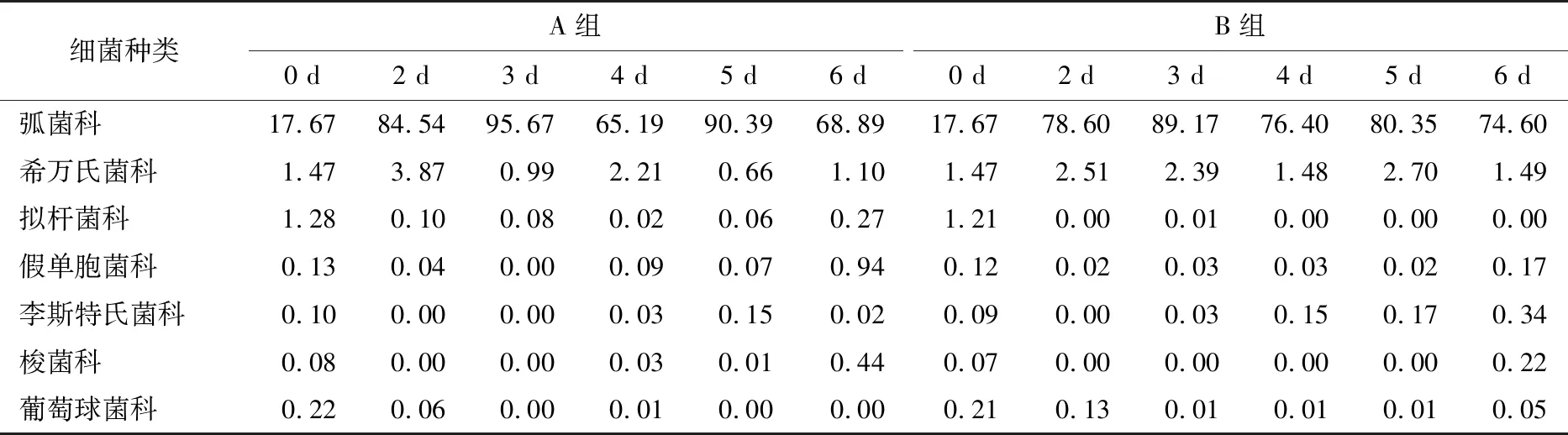
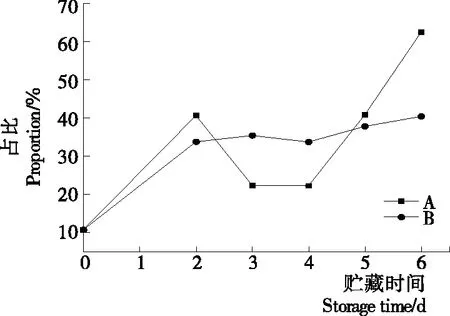
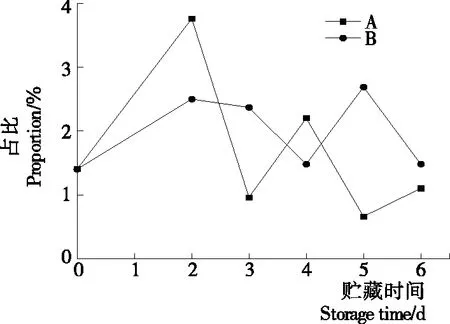
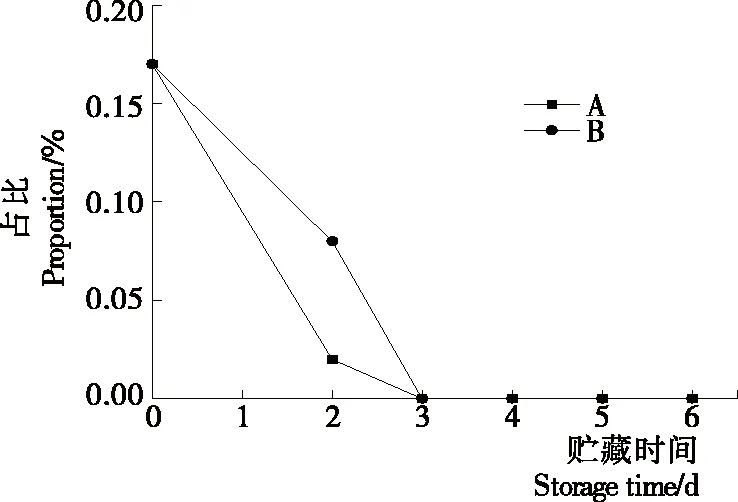
2.2.2 等離子體活化冰貯藏中蝦的TBA及TVB-N值變化 由圖6可知,TVB值隨著貯藏時間的延長而逐漸上升。A組蝦的TBA值在貯藏期0~4 d中緩慢增長,而B組在第5~6天TBA含量再無增長,整個貯藏期內B組TBA數值始終 圖5 A組與B組貯藏期對蝦pH值變化 圖6 A組與B組貯藏期對蝦TBA值變化 如圖7所示,在貯藏期0~2 d 2組蝦的TVB-N值差別較小。在第3天時,A組蝦的TVB-N值達到了29.9 mg/kg,超過了GB 2733—2015《食品安全國家標準 鮮凍動物性水產品》中對合格蝦的鮮度等級要求(20 mg/kg),之后迅速增長,在貯藏第6天達到最高值(86.4 mg/kg)。而B組蝦在貯藏期內TVB-N值增長緩慢,在第4天才達到18.1 mg/kg,符合GB 2733—2015對蝦揮發性鹽基氮的鮮度等級要求,到第6天B組蝦的TVB-N值上升速率遠遠小于A組的。表明等離子體冰抑制TVB-N機理可能與等離子體對蝦表面的腐敗希瓦氏菌、弧菌與銅綠假單胞菌細菌的生長抑制和殺滅效果有關[18]。 2.2.3 等離子體活化冰貯藏中蝦的硬度變化 如圖8所示,硬度值在貯藏第0天時有最高值,之后隨著貯藏時間延長,2組蝦的硬度都逐漸下降,符合蝦保藏過程中的硬度變化規律。試驗期間B組蝦的硬度值始終高于A組的,說明B處理對蝦對硬度下降有延緩作用,其作用機理可能是對蝦在貯藏期間等離子體活化冰可以有效地抑制微生物生長[17,19],減緩微生物分解蝦肉蛋白,從而降低蝦肉蛋白的變質[20-21],使得硬度緩慢下降。 圖7 A組與B組貯藏期對蝦TVB-N值變化 圖8 A組與B組貯藏期對蝦硬度值變化 2.2.4 等離子體活化冰貯藏中蝦的色差變化 由圖9可知,在試驗期內2組蝦的總色差值均呈上升趨勢且趨勢較為一致,B組蝦的色差總值始終低于A組。在貯藏期1~3 d時,B組蝦的總色差值與A組蝦的相差1.5~2.0,在貯藏期第4天以后,總色差值數值差擴大到5.0以上。證明等離子體活化冰貯藏在一定期限內可以有效地抑制蝦保存過程中的黑變。 2.3.1 等離子體活化冰貯藏中蝦的菌落總數測定變化 根據圖10,貯藏期內2組蝦的菌落總數均呈上升趨勢且趨勢較為一致,B組菌落總數始終低于A組。說明等離子體活化冰貯藏處理可以抑制微生物的生長。抑制細菌生長的機理可能是,等離子體產生的羥基自由基和臭氧等強氧化性活性物質,使細菌細胞壁肽聚糖分子關鍵化學鍵斷裂[10]55-84,并引起細菌內蛋白質或者核酸損傷[22-23]。 2.3.2 等離子體活化冰貯藏中蝦中細菌多樣性分析 對第二代高通量測序結果分析發現,蝦中主要細菌為γ變形菌綱細菌,貯藏期內γ-變形菌綱菌所占比例最多,占比為55.31%。在貯藏期內,2組蝦中的γ-變形桿菌綱的占比始終高于90%,B組的γ-變形菌綱占比比A組低2%~4%(表1)。說明B組貯藏處理對蝦中的γ-變形菌綱(Gammaproteobacteria)細菌的生長有明顯的控制作用。在γ-變形菌綱中,B組貯藏處理對弧菌目(Vibrionales)細菌生長的控制作用最明顯。貯藏第0天時,弧菌目在所有目中占比17.22%。在貯藏期2~3 d內,B組弧菌目占總菌比例對比A組要低6%~8%(表2)。從細菌科等級水平上對比分析發現,等離子體活化冰對γ-變形菌綱中弧菌目中弧菌科(Vibrionaceae)細菌生長有明顯抑制作用,貯藏期內B組弧菌科細菌占比與A組對比,B組弧菌科比A組低10%左右(表3)。 圖9 A組與B組貯藏期對蝦色差值變化 2.3.3 等離子體活化冰貯藏對蝦中致腐菌與致病菌的控制作用分析 采用細菌基因二代測序在細菌屬等級上分析蝦類產品中常見的致腐菌(類腸膜明串珠球菌、枝芽孢桿菌、少動鞘氨單胞醇菌、陰溝腸桿菌、腐敗希瓦氏菌、熒光假單胞菌和棲冷克呂沃爾菌[24])和致病菌(副溶血性弧菌、沙門氏菌、金黃色葡萄球菌、單增李斯特菌、創傷弧菌[25-26])共12種菌屬在貯藏期內在所有菌群中的含量占比與變化。 圖10 在貯藏期對蝦菌落總數變化 (1) 其中枝芽孢桿菌、腸膜明串珠球菌、呂沃爾菌、少動鞘氨單胞醇菌、棲冷克、沙門氏菌、單增李斯特菌及其菌屬未有明顯檢出。 (2) 弧菌屬細菌廣泛存在于海水與魚、貝等海產品中,因此弧菌屬細菌有明顯檢出。弧菌屬中存在霍亂弧菌、副溶血弧菌、創傷弧菌、溶澡弧菌、擬態弧菌等幾種與人類感染性腹瀉有關的細菌[27],對人體生命健康威脅較大。由圖11看出,弧菌屬貯藏第0天時占比10.73%,貯藏期第6天A組弧菌屬占比62.52%,B組為40.45%,2組之間差值最大達到22.07%。 表1 貯藏期對蝦不同種類綱的細菌占比變化 表2 貯藏期對蝦不同種類目的細菌占比變化 表3 貯藏期對蝦不同種類科的細菌占比變化 圖11 貯藏期對蝦中弧菌屬占比變化 Figure 11 Variation in the proportion ofVibriogenus in bacterial population on shrimps during storage change (3) 希瓦氏菌屬、假單胞菌菌屬和葡萄球菌屬都有檢出,但量較少。由圖12可知,貯藏過程中,A組和B組希瓦氏菌屬菌屬占比變化差別較小。圖13中,對蝦中假單胞菌菌屬在貯藏期0~6 d,A組占比變化幾乎>B組,到貯藏第6天2組之差為0.79%。在圖14中,對蝦在貯藏第3天開始,2組葡萄球菌屬占比變化趨于0。 綜上所述,等離子體活化冰貯藏處理對弧菌屬控制效果較明顯,對假單胞菌屬細菌生長有一定抑制作用,但作用較小,對抑制葡萄球菌屬、希瓦氏菌屬細菌生長未見明顯作用。 圖12 貯藏期對蝦中希瓦氏菌屬菌屬占比變化 Figure 12 Variation in the proportion ofShewanellagenus in bacterial population on shrimps during storage 圖13 貯藏期對蝦中假單胞菌菌屬占比變化 Figure 13 Variation in the proportion ofPseudomnasgenus in bacterial population on shrimps during storage 圖14 貯藏期對蝦中葡萄球菌菌屬占比變化 Figure 14 Variation in the proportion ofStaphylococcusgenus in bacterial population on shrimps during storage 等離子體活化冰可以有效地抑制貯藏期對蝦微生物的生長速度,對γ-變形菌綱弧菌目生長抑制效果較為明顯。其次,在蝦貯藏期間等離子體活化冰可以有效地抑制蝦脂質氧化與蛋白質分解,延緩鮮蝦的腐敗過程,延長對蝦的貨架期,且不會對蝦的感官(如硬度)造成不良影響。 等離子體活化冰在對蝦貯藏過程中,冰的性質穩定,其存在的活性成分能相對穩定地存在于冰中,并以較恒定的速率從固態冰中揮發,對產品施加影響,不會產生有害物質。但利用等離子體活化冰貯藏東方對蝦,其機理尚不明確,有待進一步研究。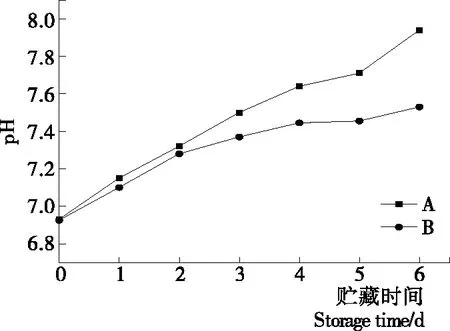
2.3 微生物檢測
3 結論

