石膏中氧化鈣的測定
王雪艷
(新疆維吾爾自治區有色地質勘局706隊 阿勒泰 836500)
目前測定鈣的方法有很多,如EDTA滴定法(鈣黃綠素作指示劑)、原子吸收光譜法、離子選擇性電極等。通過試驗本方法采用鈣指示劑作為指示劑,EDTA標準溶液滴定,準確度更高,精密度更好。
1 實驗部分
1.1 主要試劑與儀器
(1)酸式滴定管。
(2)鹽酸羥胺(50g/L):5克鹽酸羥胺溶于100mL水中,搖勻。
(3)三乙醇胺:(1+1)水溶液。
(4)KOH(200 g/L):20克KOH溶于100mL水中,搖勻。
(5)鈣指示劑:鈣紫紅素0.1g,加無水硫酸鈉10g,研磨均勻。(6)鹽酸溶液:(1+1)。(7)鹽酸溶液:(1+9)。(8)硝酸銀溶液:10g/L。(9)剛果紅試紙。
(10)氧化鈣標準溶液:稱取1.7844g在150℃烘干過的高純碳酸鈣置于250mL燒杯中,加水100mL,再緩慢加入20mL(1+1)鹽酸微熱溶解,煮沸趕盡二氧化碳待完全溶解后置于1000mL容量瓶中,搖勻。此溶液為1.000mg/mL氧化鈣。
截至目前,項目區水資源論證工作成效顯著,為項目區水資源管理決策提供了重要依據,同時增強了項目區水資源和生態環境保護意識,促進了經濟發展與資源環境保護的雙贏。此外,作為一項重大系統工程,東北四省區節水增糧行動項目水資源論證管理工作的實施,探索了農業灌溉項目水資源論證工作技術政策與管理經驗,為加強全國農業節水灌溉項目水資源論證工作管理闖出了一條新路。
(11)EDTA 標準滴定溶液(0.02mol/L):稱取3.72g基準EDTA于500mL燒杯中,加水300mL溶解,并移入1000mL容量瓶中,加水稀釋至刻度,搖勻。
標定:移取20.00mL氧化鈣標準溶液于250mL三角瓶中,加50mL水,再加10mL KOH(200 g/L)溶液,少許鈣指示劑,用EDTA標準滴定溶液滴定至酒紅色變為純藍色為終點,計算每mLEDTA標準滴定溶液相當于氧化鈣的量。按式(1)計算EDTA標準滴定溶液濃度。

式中:
T-每毫升EDTA標準滴定溶液相當于氧化鈣的質量,mg/mL;
m-氧化鈣標準量,mg;
V-消耗EDTA標準滴定溶液體積,mL。
1.2 實驗方法
試樣溶液的制備:稱取0.5000g試樣,置于250mL燒杯中,用水潤濕后加入50mL(1+1)的鹽酸,蓋上表面皿,將燒杯置于電熱板上加熱微沸30min,取下冷卻,用慢速定量濾紙過濾,用熱水沖洗杯壁及沉淀3次,再用熱的(1+9)鹽酸洗滌燒杯及沉淀3~4次,再用溫水洗凈燒杯和不溶物直至用(10g/L)Ag-NO3溶液檢驗無氯離子。濾液用250mL容量瓶承接,用水稀釋至刻度,搖勻。
氧化鈣含量的測定:分取以上濾液20mL于錐形瓶中,加80mL水,加1mL(50g/L)鹽酸羥胺,再加1mL(1+1)三乙醇胺,投入一小片剛果紅試紙,用(200 g/L)KOH調至溶液在12~13pH值范圍內,放入鈣指示劑少許,用EDTA滴定至溶液由酒紅色變為純藍色,記下EDTA標準滴定溶液消耗的毫升數,計算氧化鈣的含量。
隨同實驗做3份空白試驗取平均值計算空白試樣中氧化鈣的含量。
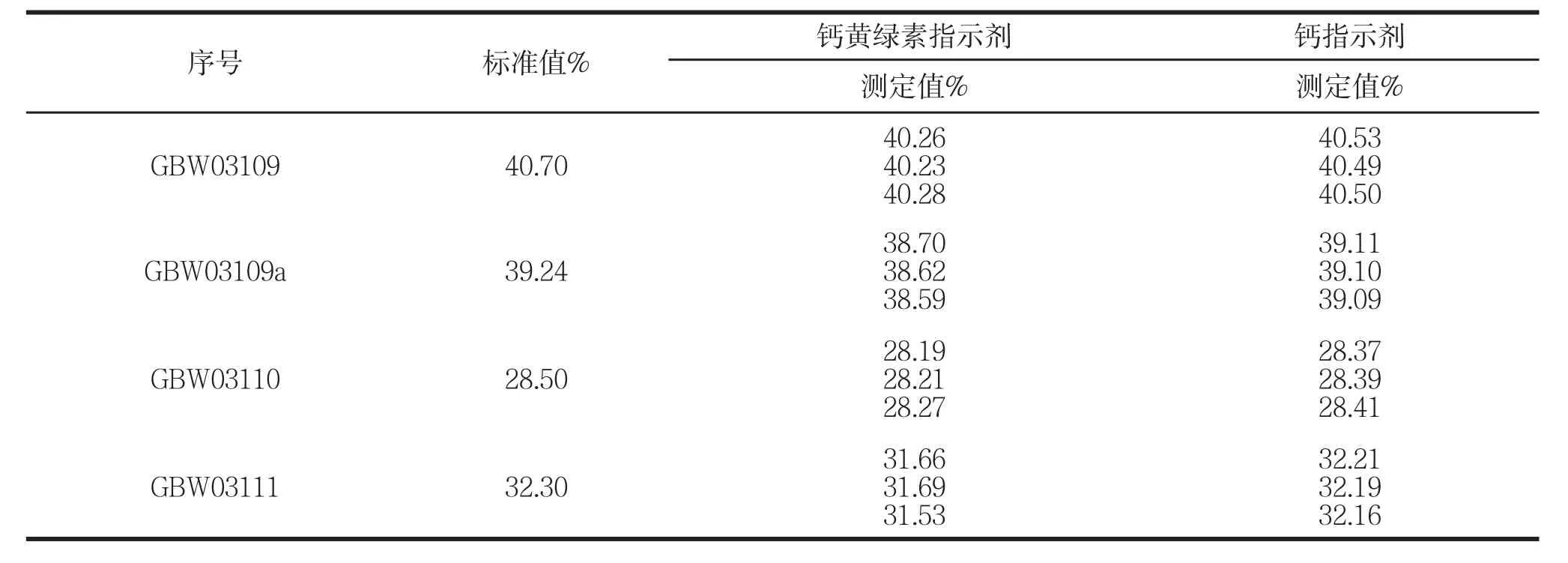
表1 兩種指示劑對比實驗
按式(2)計算樣品中氧化鈣的量。
1.2.1 結果計算

式中V1-滴定鈣時試樣溶液消耗EDTA標準滴定溶液體積,mL;
V0-滴定鈣時試樣空白消耗EDTA標準滴定溶液體積,mL;
V-試樣溶液總體積,mL;
T-每mlEDTA標準滴定溶液相當于氧化鈣的質量,mg/mL;
M-試樣量,g;
V2-分取試樣溶液體積,mL。
2 結果討論
2.1 指示劑的選擇
表1是分別用鈣黃綠素作指示劑和用鈣指示劑作指示劑在相同條件下測得的結果。
2.2 pH值的選擇
用EDTA滴定Ca2+鈣指示劑做指示劑,這一反應只有在12~13pH值范圍內指示劑與鈣離子生成的絡合物才穩定,顯示紅色,到了滴定終點時,溶液顯示為藍色。在這個范圍之外,都顯示指示劑自身的顏色,無法判斷滴定終點。
3 結論
實驗結果表明:相同條件下,溶液在12~13pH值范圍內用鈣指示劑作為指示劑測定值更接近標準值,由于石膏中某些雜質的影響,測定值與國標方法測得值有點偏差,但是用鈣指示劑作示劑滴定終點溶液顏色變化更容易辨別,且準確度更高;所以測定鈣用鈣指示劑值得推廣。

