辛烯基琥珀酸酐復合超聲改性提高雞蛋全蛋液熱穩定性
曹文慧,徐麗娜,李 彤,張華江*,遲玉杰,劉媛媛,姜雪寒
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
隨著人們對高蛋白食品需求的不斷增加,全蛋液在食品加工業中的應用范圍也逐漸擴大。但由于蛋內蛋白極易變性,在加工中全蛋液的熱凝固溫度必須控制在62~67 ℃[1],導致全蛋液的加工工藝以及滅菌都受到溫度的限制,全蛋液自身的熱敏性使其應用受到很大的局限。因此近些年來國內外蛋品方面的學者大多把通過外部手段提高雞蛋全蛋液的熱穩定性作為研究的熱點。
目前,國內外的研究主要集中在通過酶、化學和物理方法修飾雞蛋蛋白,以改善其熱穩定性。劉劍秋等[2]用復合蛋白酶水解雞蛋1 h,可將其熱凝固溫度提高至75 ℃。劉俊梅等[3]的實驗結果表明用5 U/mg堿性蛋白酶水解蛋清蛋白4 h,其熱穩定性達到最高。Lydia等[4]用糖和鹽處理全蛋液可使其在80 ℃高溫下加熱2 min不變性。Ong等[5]研究發現琥珀酸酐可以暴露賴氨酸殘基進行琥珀酰化反應,起到修飾蛋白質進而提高熱穩定性的效果。然而大多數研究表明,現有的處理手段對雞蛋蛋白熱穩定性的改善效果不夠明顯,需進一步優化。所以探究一種更好的處理手段也就尤為必要。目前國內外利用琥珀酸酐化學改性修飾蛋白的實例較多,但辛烯基琥珀酸酐(octenyl succinic anhydride,OSA)修飾蛋白質以提高其熱穩定性的研究還相對較少。OSA是烯烴和順丁烯二酸酐反應制得的高活性化學改性劑,含有與琥珀酸酐相似的兩個二羧酸酐基,且經過水解仍含有疏水性基團。OSA對蛋白質的改性作用主要是由于其在改性過程中產生的電荷會影響蛋白質的靜電和空間位阻[6],從而使得蛋白質的二級結構和三級結構發生變化,通過這種電荷-排斥反應解離蛋白質聚集體,進而改善雞蛋蛋白的熱穩定性。超聲處理是一種物理加工方法,在溶液最小程度引入空氣的情況下,超聲波的使用通過氣溶膠的形成和塌陷產生熱量和氣蝕[7],可能使蛋白質部分變性。但Arzeni等[8]發現僅用超聲波處理的再水化蛋清粉末的熱穩定性并沒有得到改善。而Yang Xue等[9]通過超聲輔助α-淀粉酶提高了大米蛋白熱凝固溫度,Hegg等[10]研究表明超聲與十二烷基硫酸鈉和月桂酸等結合可改善弱堿性卵白蛋白的熱穩定性。因此本研究通過預熱、超聲與OSA修飾相結合的技術手段使得全蛋液形成穩定的絡合物,在高溫環境下,這種絡合物可以防止蛋白質的進一步解開,從而使蛋白質之間在疏水締合的同時將大的聚集體最小化,以此來改善雞蛋蛋白質分散體的熱穩定性[11]。首先,經過預熱的全蛋液通過OSA化學改性,OSA水解的二羧酸極性部分可能在蛋白質之間發生靜電排斥,對提高熱穩定性有一定的價值。其次,在超聲處理期間其疏水基團會部分松動或暴露,OSA的8 個碳尾可能與暴露的疏水部分相互作用,且超聲可以提高OSA的溶解度和分散性,優化OSA的修飾程度[11],使得全蛋液熱凝固溫度進一步升高,從而使雞蛋全蛋液在食品加工行業中得到更廣泛的應用。
1 材料與方法
1.1 材料與試劑
雞蛋 哈爾濱家樂福超市;OSA 天津市致遠化學試劑有限公司。
1.2 儀器與設備
ALC-310.3電子分析天平、pHS-3C精密pH計 北京賽多利斯儀器系統有限公司;DK-98-II電熱恒溫水浴鍋天津市泰斯特儀器有限公司;恒溫磁力攪拌器 常州國華電器有限公司;721-分光光度計 上海元析儀器有限公司;F-4500熒光分光光度計 日本日立公司;GL-21M離心機 上海市離心機械研究所。
1.3 方法
1.3.1 改性全蛋液的制備工藝流程
全蛋液→63 ℃加熱5 min→達到溫度后,4 min時加入OSA(1%、2%、4%、5%、10%、15%、20%,以蛋液質量計)→調節pH值至8.5→琥珀酰化3 h→調節pH值至6.5→超聲處理(40 kHz、400 W、50 ℃,8 min)→改性全蛋液。
1.3.2 緩沖液的配制
配制pH 7.4的磷酸鹽緩沖液:稱取7.9 g NaCl、0.2 g KCl、0.24 g KH2PO4和1.8 g K2HPO4,溶于800 mL蒸餾水中,用HCl調節溶液的pH值至7.4,最后加蒸餾水定容至1 L。保存于4 ℃冰箱中即可。
1.3.3 聚合物分散性指數及粒徑的測定
分別將加入不同添加量OSA處理的樣品用高速均質機以9 500 r/min均質1 min后,4 000 r/min離心20 min,取上清液100 μL用蒸餾水稀釋50 倍,利用激光粒度儀測定聚合物分散性指數(polymer dispersity index,PDI)及粒徑。操作參數:溫度25 ℃、角度90°、波長632.8 nm。
1.3.4 濁度的分析
分別吸取濁液標準溶液0、0.5、1.25、2.5、5、10 mL和12.5 mL,置于50 mL比色管中,加水至標線。搖勻后即得濁度依次為0%、4%、10%、20%、40%、80%、100%的系列標準溶液。在660 nm波長處測定吸光度并繪制標準曲線。
將不同OSA添加量處理的樣品(稀釋至50 mL)倒入比色皿中,以蒸餾水作空白,利用分光光度計在660 nm波長處對樣品的吸光度進行測定,通過對照標準曲線得到稀釋后樣品濁度。樣品濁度按式(1)計算。

1.3.5 全蛋液流變性質的測定
采用Bohlin Gemini2旋轉流變儀,在25 ℃下,選擇2°/40 mm平板系統,1 mm平板間距,測定超聲-辛烯基琥珀酰化全蛋液的流變行為。
全蛋液靜態流變的測定:剪切速率為0~100 s-1。將所測得的表觀黏度與剪切速率用冪律方程進行擬合,如式(2)所示。

式中:η為表觀黏度/(Pa·s);K為黏性系數;ε為剪切速率/s-1;n為流動指數。
全蛋液動態流變的測定:對樣品進行小振幅掃描,測定樣品的彈性模量(G′)、黏性模量(G”)、損耗角正切(tanδ)。測定參數:掃描頻率0.1~40 Hz;應變力1%。
1.3.6 溶解性的測定
將處理后樣品取其上清液10 mL,于7 500 r/min下離心20 min,吸取5 mL上清液,采用Folin-Ciocalteu法[12]測定上清液中蛋白質量,蛋白質的溶解度按式(3)計算。

1.3.7 差示掃描量熱法測定熱穩定性
稱取5.00~8.00 mg樣品于鋁坩堝內,樣品均勻平鋪于坩堝底部,密封后放入差示掃描量熱(differential scanning calorimetry,DSC)儀樣品室內[13]。測定程序為:將樣品以10 ℃/min的升溫速率從20 ℃加熱到120 ℃,進行全蛋液熱變性分析。
1.4 數據統計與分析
每個樣品進行3 次重復實驗,通過SPSS 19.0軟件對測得的單因素試驗數據進行方差分析,采用t檢驗進行顯著性分析,顯著性水平為P<0.05,采用Origin 8.0軟件作圖。
2 結果與分析
2.1 不同OSA添加量對全蛋液粒徑分布及PDI的影響
全蛋液通過預熱、超聲與OSA修飾相結合形成穩定的絡合物,在同一溫度不同OSA添加量、同一OSA添加量不同溫度下表現出不同的分散狀態。PDI反映蛋白質分子之間以及蛋白質和水分子之間作用力的改變:PDI越小,說明蛋白質顆粒粒徑分布范圍較小[14]。具體測定結果如表1、2所示。
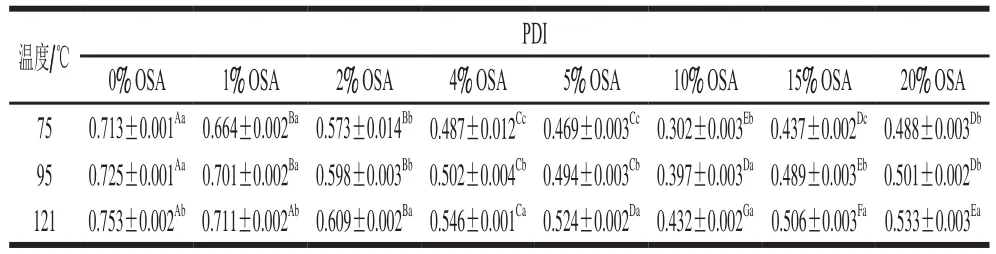
表1 未超聲條件下OSA添加量對全蛋液PDI的影響Table 1 Effect of OSA dosages on PDI of liquid whole egg without ultrasonic treatment

表2 超聲條件下OSA添加量對全蛋液PDI的影響Table 2 Effect of OSA dosages on PDI of liquid whole egg with ultrasonic treatment
由表1、2可以看出,同一溫度下,隨著OSA添加量的增加,全蛋液PDI逐漸降低。表2中,75 ℃下,OSA添加量由0%增加至10%時,全蛋液PDI由0.501降為0.196(P<0.05);且在95 ℃和121 ℃下,OSA添加量由0%增加至10%時,全蛋液PDI由0.521和0.541分別減少至0.326和0.378(P<0.05)。結果表明OSA的加入使得全蛋液PDI顯著減小(P<0.05),分散體系中粒徑分布范圍縮小,顆粒分散性較好[15],這可能是由于OSA的酰化作用降低了全蛋液的整體PDI,且與表1中未超聲的辛烯基琥珀酰化全蛋液相比顆粒分散效果更好,因此,也可能是超聲處理使得全蛋液通過靜電作用得到修飾,降低了顆粒之間的相互作用,從而減小了顆粒粒徑的分布范圍[16]。當OSA添加量由10%增加至20%時,75 ℃下超聲-辛烯基琥珀酰化全蛋液的PDI由0.196升為0.239(P<0.05);且在95 ℃和121 ℃下,超聲-辛烯基琥珀酰化全蛋液PDI分別由0.326和0.378升至0.352和0.391(P<0.05)。隨著OSA的添加量增加,分散體系中縮小的粒徑分布范圍又逐漸擴大,這可能是由于OSA添加量的逐漸增加使得蛋白質顆粒不易分散,顆粒總數增多,粒徑分布范圍變寬,且OSA添加量越大,酰化作用越劇烈,使得處理后全蛋液的蛋白質分散體系中大顆粒數越多[17]。同一添加量時,隨著溫度的升高,全蛋液的PDI呈增大的趨勢,OSA添加量為10%時,雞蛋全蛋液在75 ℃溫度下PDI為0.196,95 ℃為0.326,121 ℃為0.378,差異顯著(P<0.05)。同一添加量不同溫度整體PDI排列順序為:PDI75℃<PDI95℃<PDI121℃,說明對于相同OSA添加量,溫度升高可以提高全蛋液PDI,表明蛋液粒徑分布寬度增加,復合物大分子在溶液中的分散指數增大,溶液中顆粒分散性較差[18],這可能是由于加熱誘導蛋白質變性,使得蛋白質分子間相互作用增強,顆粒更容易聚集,顆粒粒徑增大。
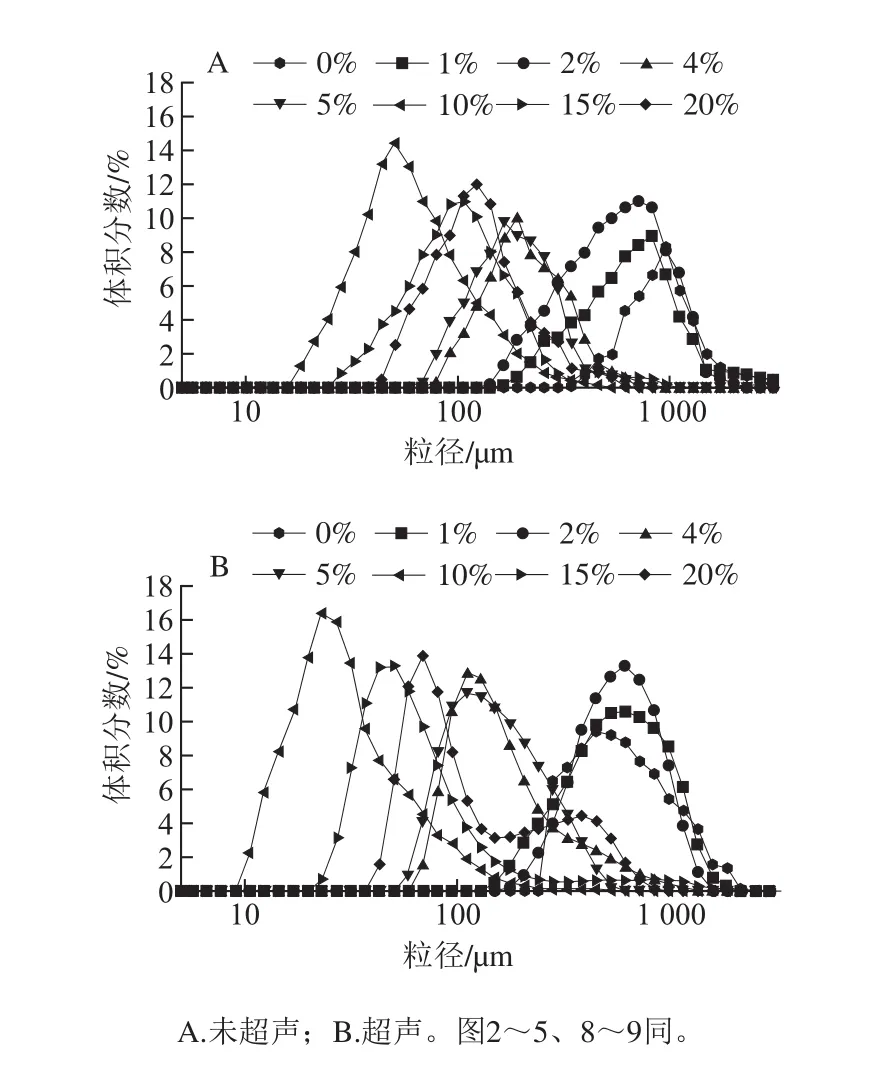
圖1 不同OSA添加量對75 ℃全蛋液粒徑分布的影響Fig. 1 Effect of OSA dosages on particle size distribution of liquid whole egg at 75 ℃
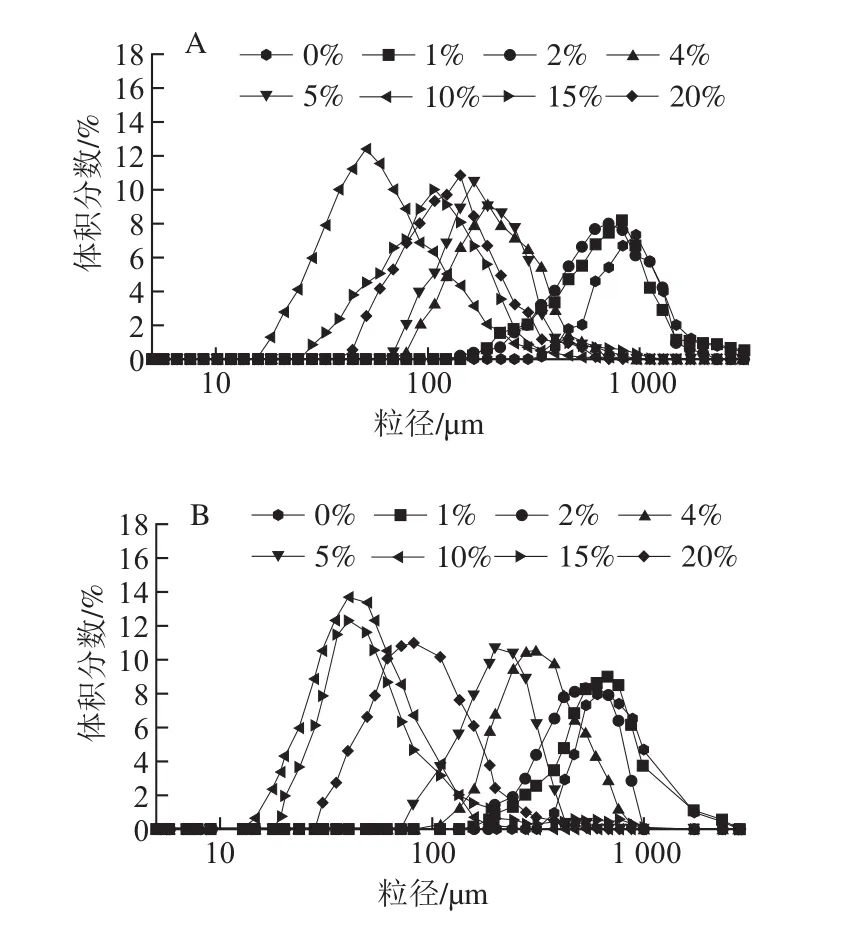
圖2 不同OSA添加量對95 ℃全蛋液粒徑分布的影響Fig. 2 Effect of OSA dosages on particle size distribution of liquid whole egg at 95 ℃

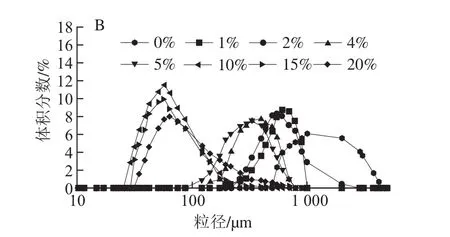
圖3 不同OSA添加量對121 ℃全蛋液粒徑分布的影響Fig. 3 Effect of OSA dosages on particle size distribution of liquid whole egg at 121 ℃
綜合圖1~3可以看出,經OSA酰化處理后,隨著OSA添加量的增加,粒徑分布均逐漸左移,而且體積分數逐漸增大,這說明OSA使得全蛋液中大顆粒數量減少,大顆粒被分散成了小顆粒,分散體系分散性加強。當OSA添加量為10%時,3 種溫度下的未超聲與超聲-辛烯基琥珀酰化全蛋液均表現為粒徑最小,體積分數峰值達到最高。而繼續加入OSA,分子粒徑變大,這可能是由于過量OSA致使展開的疏水基團暴露形成可溶性復合物引起[19]。當OSA添加量相同時,隨著溫度的升高,粒徑分布向右偏移且體積分數下降。在超聲條件下,75 ℃時,添加10%的OSA,粒徑分布在10.1~342.0 μm之間且分散體系顆粒峰位在21 μm,隨著溫度的升高,峰位向粒徑較大處偏移。當加熱到95 ℃時,OSA添加量為10%時的峰位達到40.01 μm。而溫度到121 ℃時,OSA添加量為10%時的峰位則偏移至56.78 μm。這可能是由于加熱使得蛋白質肽鏈逐漸展開,發生變性,形成不規則粒子,從而致使粒徑增大[20]。也可能是由于全蛋液受熱會引起分子結構發生變化,在其分子表面分布著大部分的疏水氨基酸,加熱使得蛋白質之間相互作用增強,蛋白質顆粒更容易聚集,小顆粒的數量減少導致體積分數減小,大顆粒出現使得峰寬變寬[21]。但在3 種溫度下,經過超聲-辛烯基琥珀酰化處理后的全蛋液粒徑均比未經處理的小,且向左偏移的趨勢明顯,這說明此手段能夠在一定程度上改善全蛋液的受熱穩定性。
2.2 不同OSA添加量對全蛋液濁度的影響
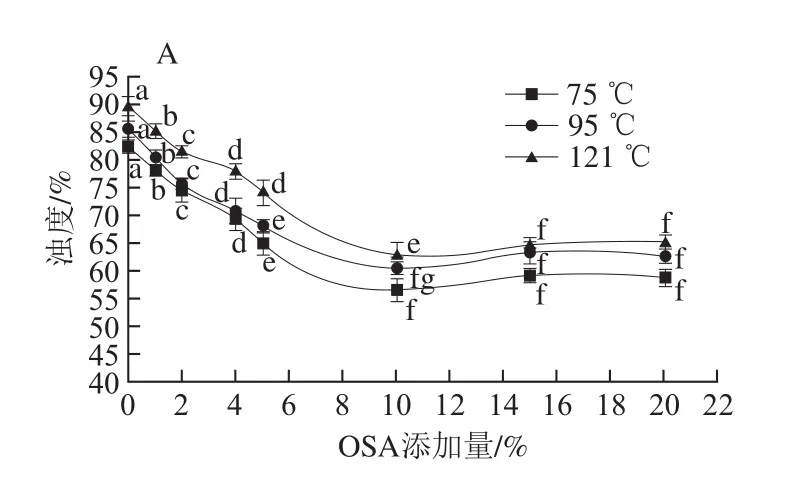

圖4 OSA添加量對全蛋液濁度的影響Fig. 4 Effect of OSA dosages on turbidity of liquid whole egg
濁度指因樣品的吸收或顆粒的散射而造成透射光的衰減,可以反映粒子的大小,表征溶液體系中顆粒的聚集程度和穩定性[22]。圖4表示不同溫度下未超聲與超聲-辛烯基琥珀酰化全蛋液濁度的變化。與未經處理的全蛋液相比,未超聲與超聲-辛烯基琥珀酰化全蛋液在3 個溫度環境下濁度均呈下降趨勢。且在超聲時,同一溫度下,隨著OSA添加量的增加,濁度逐漸降低:75 ℃時,全蛋液濁度由OSA添加量為0%時的79.8%降低為OSA添加量為10%時的45.6%;95 ℃時,全蛋液濁度由OSA添加量為0%時的81.2%降低為OSA添加量為10%時的57.5%;121 ℃時,全蛋液濁度由OSA添加量為0%時的85.7%降低為OSA添加量為10%時的58.9%,且差異顯著(P<0.05)。這可能是由于預熱誘導蛋白質結構部分解開折疊使其與OSA更完全地結合,同時超聲處理可以有效地提高體系的乳化效應,形成均勻的乳狀體系[23],從而使濁度逐漸降低。也可能是隨著蛋白質分子逐漸溶解,可溶性蛋白含量增加使得全蛋液濁度降低。而繼續添加OSA會使經超聲處理的全蛋液濁度有所回升:OSA添加量為15%,溫度分別為75、95、121 ℃時,全蛋液濁度分別為47.4、59.8、60.6;添加OSA增至20%,溫度分別為75、95、121 ℃時,全蛋液濁度分別為46.8、60.3、59.7,均顯著增大(P<0.05)。這可能是由于全蛋液中的游離羧基部分水解而導致pH值下降,接近雞蛋蛋白等電點,發生變性聚集,濁度變大[24]。且同一添加量下隨著溫度的升高,超聲-辛烯基琥珀酰化全蛋液濁度雖在升高,但均低于未處理樣液。這可能與雞蛋蛋白在高溫下發生的聚集作用有關,但超聲-辛烯基琥珀酰化會減速蛋白可溶性聚集物的形成,從而使得全蛋液濁度降低,受熱不易變性,熱穩定性提高。
2.3 不同OSA添加量對全蛋液流變學性質的影響
2.3.1 全蛋液的靜態流變性質
靜態流變學可以研究單一方向穩態剪切作用下聚合物流體的流動和形變,全蛋液的黏度與流變性質的變化會影響其加工、運輸、設備的清洗等過程,而且會影響最終產品的品質。OSA添加量對全蛋液靜態流變性質的影響結果如圖5所示。
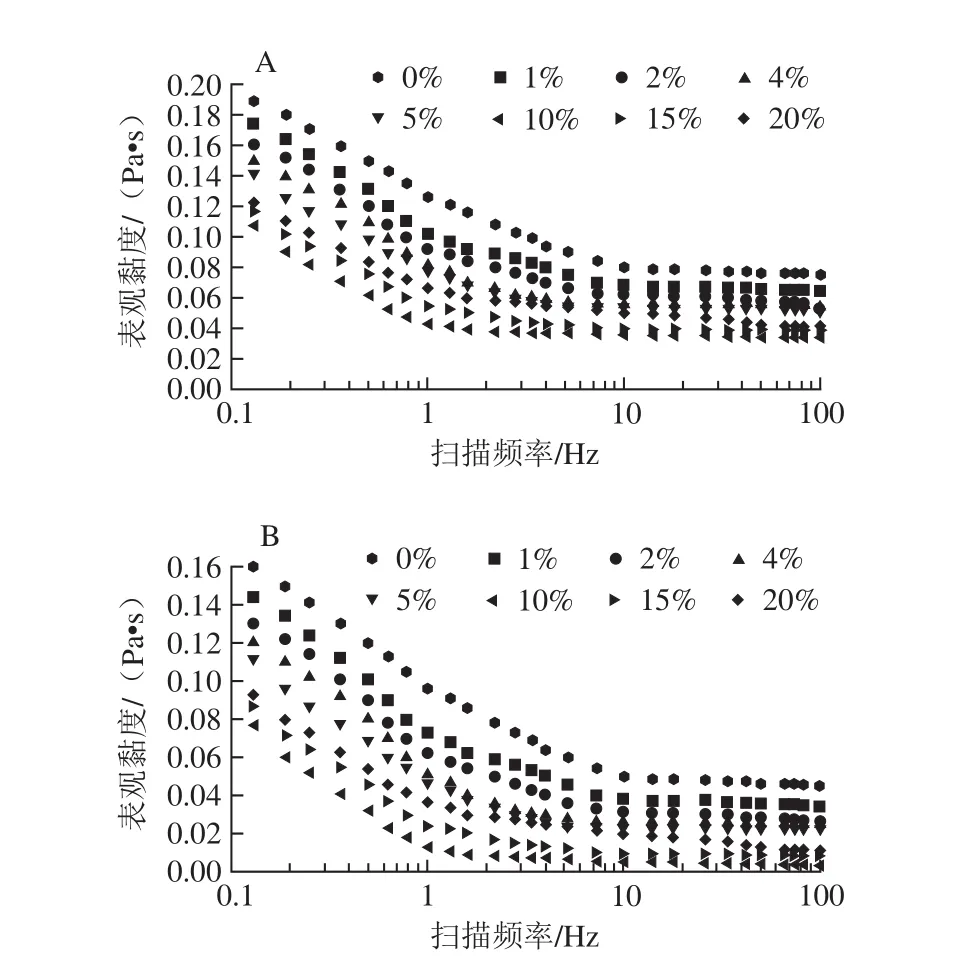
圖5 OSA添加量對全蛋液靜態流變性質的影響Fig. 5 Effect of OSA dosages on static rheological properties of liquid whole egg
圖5為全蛋液黏度在未超聲和超聲條件下隨掃描頻率及OSA添加量變化的曲線圖。隨著掃描頻率的增加,全蛋液表觀黏度均呈下降趨勢。當掃描頻率小于1時,黏度表現為線性下降;而當掃描頻率繼續增大時,黏度下降趨勢趨于平緩。從圖5中還可以看出,在OSA添加量為0~10%范圍內,隨著OSA添加量逐漸增大,全蛋液表觀黏度逐漸變小,在10%時,表觀黏度最低,說明OSA的添加使得全蛋液發生改性并分散了其聚集,這可能是由于全蛋液的靜態流變性質與分子鏈的長短和聚集程度有關,支鏈越少,聚集程度越小的液體越容易發生剪切稀化,導致黏度下降,流動性增強[25]。繼續添加OSA至15%、20%時,表觀黏度又表現為逐漸增大,這可能是由于過量的OSA導致改性后的全蛋液又發生了變性并開始聚集[26]。但總體來看,與未經處理以及未超聲酰化的全蛋液相比,經OSA與超聲復合改性全蛋液的黏度降低,流動性增強,表明超聲-辛烯基琥珀酰化復合改性可以有效改善全蛋液的流變性質。
2.3.2 全蛋液的動態流變性質
動態流變學可以研究周期動態作用下聚合物流體的流動和形變,其中G′、G′′和tan δ是重要的指標參數[27],圖6、7分別為未超聲和超聲時不同OSA添加量全蛋液的G′與G′′頻率掃描圖以及掃描頻率為20 Hz時的tan δ結果。
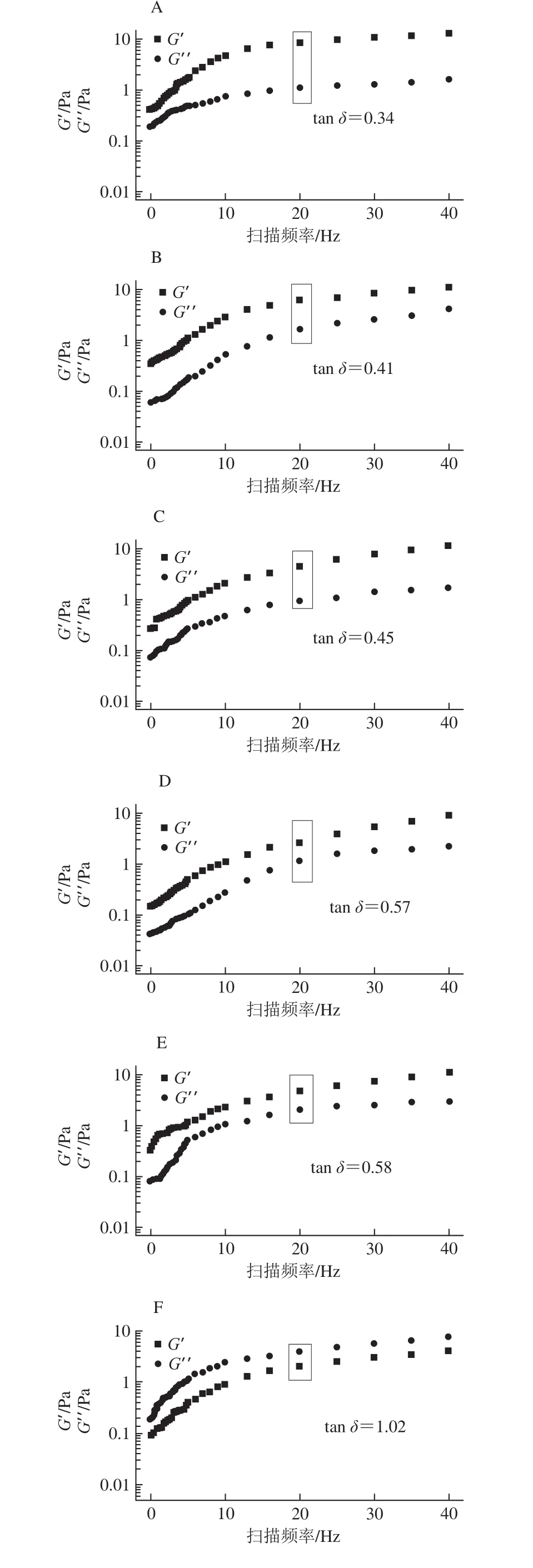
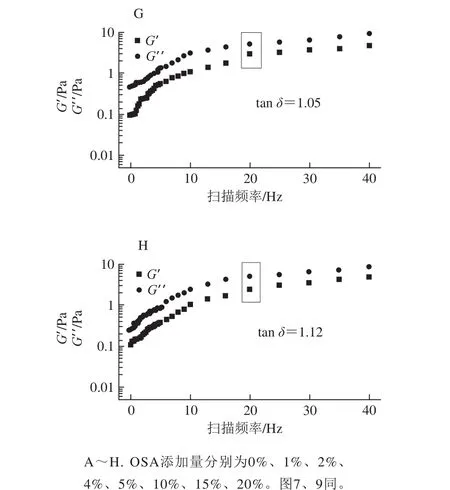
圖6 未超聲條件下不同OSA添加量全蛋液的G′與G′頻率掃描圖及tan δFig. 6 G′ and G′′ versus frequency curves and tan δ of liquid whole egg modi fied with different dosages of OSA without ultrasonic treatment


圖7 超聲條件下不同OSA添加量全蛋液的G′與G′頻率掃描圖及tan δFig. 7 G′ and G′ versus frequency curves and tan δ of liquid whole egg modi fied with different dosages of OSA with ultrasonic treatment
由圖6、7可知,未超聲與超聲-辛烯基琥珀酰化全蛋液的G′與G′′均隨著掃描頻率的增大而增加。對比兩組圖發現,OSA添加量為0%、1%、2%、4%、5%時,全蛋液G′′<G′(tan δ<1),說明其表現出類固體的性質,與凝固性酸奶的特性相似;而當OSA的添加量達到10%、15%、20%時,全蛋液的G′′>G′(tan δ>1),說明此時其表現的是流體性質。全蛋液由“類固體”向“流體”的轉變說明其發生改性全蛋液體系中高聚物的含量減少,類固體特性逐漸減弱[28],穩定性不再容易受加熱影響,且在超聲時效果更明顯,這可能是由于OSA與超聲復合改性使蛋白質之間的相互作用得到改善,非極性蛋白間的相互作用減弱,從而對全蛋液的動態流變產生影響。tan?δ由未處理時的0.56增加到最佳狀態的OSA添加量(10%)時的1.12,而且在加入10% OSA時,G′與G′′總體較其他條件下小,這可能是由于全蛋液中蛋白質分子間相互作用力的減弱以及聚集體的分散都會促使全蛋液體現更低的G′與G′′[29],進而表現出更好的流體性質,為全蛋液的進一步深加工提供有利條件。
2.4 不同OSA添加量對全蛋液溶解性的影響

圖8 OSA添加量對全蛋液溶解性的影響Fig. 8 Effect of OSA dosages on solubility of liquid whole egg
全蛋液的溶解性是其與溶劑相互作用平衡的熱力學表現形式,也是衡量熱穩定性的關鍵因素[30]。雞蛋受熱時,其蛋白質之間發生疏水相互作用而變化和沉淀。研究表明,溫度的提高會使得蛋液中的可溶性蛋白濃度降低,全蛋液穩定性降低。因此為了提高全蛋液的熱穩定性,需要減小溫度對其溶解性的影響。由圖8可見,當OSA添加量在1%、2%、4%、5%、10%時,同一溫度下的未超聲與超聲-辛烯基琥珀酰化全蛋液溶解度隨著添加量增加而顯著提高(P<0.05),且OSA添加量為10%時全蛋液溶解度達到最高,在超聲條件下分別為90.6%(75 ℃)、89.7%(95 ℃)和86.6%(121 ℃),差異顯著(P<0.05)。這可能是因為隨著OSA琥珀酰化程度的增強,雞蛋蛋白分子結構中不斷引入親水性基團,蛋白質分子部分展開,暴露的極性基團增多,使得其分子表面形成一種水化層[31],蛋白質在水中溶解度隨之而增加,再加上超聲處理的空化作用使可溶蛋白成分分散到溶劑中,使疏水性多肽部分展開朝向脂質而極性部分朝向水相[32];同時超聲處理可以使
蛋清和蛋黃充分混合形成均一體系,有助于提高蛋白質的溶解度。而當OSA添加量達到15%、20%時,同一溫度不同添加量下,全蛋液溶解度又趨向降低,在超聲條件下,75 ℃時全蛋液溶解度分別為89.2%(OSA添加量為15%)和87.1%(OSA添加量為20%);95 ℃時全蛋液溶解度分別為88.3%(OSA添加量為15%)和86.8%(OSA添加量為20%);121 ℃時全蛋液溶解度分別為85.7%(OSA添加量為15%)和85.1%(OSA添加量為20%),與添加10% OSA相比顯著降低(P<0.05)。這可能是由于辛烯基琥珀酰化增加到一定程度后,展開的蛋白質分子通過疏水相互作用形成聚集體導致蛋白質在水中的溶解性降低并趨向飽和[33]。
2.5 不同OSA添加量對全蛋液熱穩定性的影響

表3 未超聲條件下不同OSA添加量全蛋液的DSC分析結果Table 3 DSC analysis of liquid whole egg modified with different dosages of OSA without ultrasonic treatment

表4 超聲條件下不同OSA添加量全蛋液的DSC分析結果Table 4 DSC analysis of liquid whole egg modified with different dosages of OSA with ultrasonic treatment
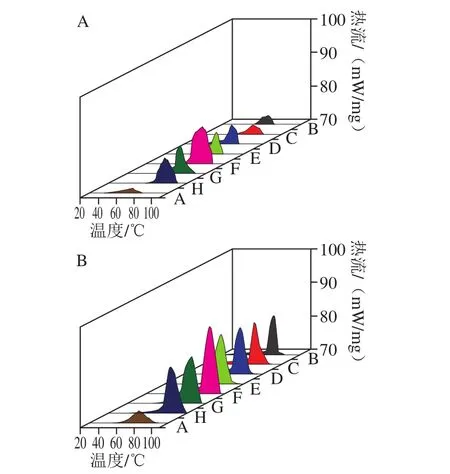
圖9 不同OSA添加量全蛋液的DSC掃描結果Fig. 9 DSC results of liquid whole egg modified with different dosages of OSA
DSC法用于測量蛋白的熱變性溫度(Tp)和熱焓。本實驗通過測定不同OSA添加量下雞蛋全蛋液的熱變性溫度與熱焓值來評價其熱穩定性。測定結果如表3、4和圖9所示。
表3、4反映了OSA對全蛋液熱穩定性的影響。經過OSA酰化處理的全蛋液熱變性溫度及熱焓均提高,且均在OSA為10%時達到最高,超聲與OSA酰化結合處理時熱變性溫度從73.41 ℃(OSA添加量為0%)升高到95.91 ℃(OSA添加量為10%);熱焓從36.1 J/g(OSA添加量為0%)增大至83.1 J/g(OSA添加量為10%),說明超聲-辛烯基琥珀酰化處理后,蛋白質構象發生變化,蛋白質結構更加穩定。這可能是由于辛烯基琥珀酰化改性將琥珀酰基(HOOCCH2CH2—CO—)共價交聯到蛋白質中賴氨酸殘基的ε-氨基上,琥珀酰基上有一個親水性極強的羧基,從而將蛋白質的氨基陽離子用陰性的琥珀酰基封閉,蛋白質凈負電荷增加,正電荷減少[34]。增加的凈負電荷使得疏水作用所需的自由能增加,進而阻止了蛋白質結構展開。也可能是由于OSA中羧基與蛋白質中氨基的相互作用使得蛋白質分子間聚集程度增加[35]。而全蛋液的熱變性過程與氫鍵斷裂有關,變性的蛋白質分子結構展開,與折疊狀態相比,全蛋液中的氫鍵斷裂所需的自由能降低從而容易發生熱變性[36];因此全蛋液蛋白質分子之間的聚集程度越強,氫鍵斷裂所需的自由能越大,越難發生熱變性。從圖9可以看出,隨著OSA添加量的增加,峰形越來越尖銳,這說明OSA使得全蛋液的熱焓逐漸變大,同時說明其熱穩定性得到了改善。在超聲且OSA添加量為10%時,熱變性溫度達到最大,為95.91 ℃,且峰形最尖銳,這可能是因為折疊的蛋白質分子內部陰離子與陽離子基團之間存在分子內引力[37],聚集程度達到最大,而繼續加入OSA會使得蛋白質內部疏水基團暴露,蛋白質之間發生強烈的靜電排斥,疏水性增加,蛋白質結構又會漸漸伸展[38],則會引起熱變性溫度下降,熱焓降低,熱穩定性下降。
3 結 論
通過OSA與超聲復合處理全蛋液,發現全蛋液的靜態流變和動態流變特性均發生變化,主要表現為黏度降低,流動性增強,出現類固體向流體轉變的現象,從而降低了受熱對全蛋液穩定性的影響,這表明OSA與超聲復合處理可對全蛋液蛋白起到改性的效果,提高熱穩定性,有利于全蛋液的實際應用。同時從PDI以及粒徑的分布現象發現超聲-辛烯基琥珀酰化改性全蛋液分散體系中粒徑分布范圍縮小,顆粒分散性較好。75、95、121 ℃下全蛋液的溶解性和濁度也都得到了改善,且均在OSA添加量為10%時表現為最佳,溶解度分別為90.6%、89.7%和86.6%,濁度分別為45.6%、57.5%和58.9%。通過DSC分析發現,在添加10% OSA處理與超聲處理結合時,全蛋液的熱變性溫度由未經處理時的73.41 ℃增加到95.91 ℃,且熱焓由36.1 J/g增大到83.1 J/g。綜上所述,在OSA添加量為10%時與超聲結合改性可以使得全蛋液的熱變性溫度提高,增強其熱穩定性。

