基于網絡藥理學的六味地黃丸治療冠心病的分子機制研究*
楊志華,劉 琰,閆海峰,姬艷蘇,王淑萍△
(1.天津中醫藥大學,天津 301617;2.武警特色醫學中心,天津 300162)
冠心病是我國最常見的心血管疾病之一,歸屬中醫學“胸痹”“真心痛”的范疇,臨床多以胸背痛、胸中窒悶、心悸、氣短為主要表現。流行病學調查顯示,我國冠心病人數高達1 100萬,且死亡率呈上升趨勢[1]。本病的發生多與外感寒邪、飲食不節、情志失調、勞倦內傷、年老體虛等因素有關[2],好發于40歲以上的中老年人[3],《素問·陰陽應象大論》中記載:“年四十,而陰氣自半也,起居衰矣。”人至中年,腎氣自半、精血漸衰、腎陰虧虛,不能濡養五臟之陰,心脈失于濡養而發為胸痹,腎陰虛是冠心病發生發展的重要病理基礎[4]。
六味地黃丸原名“地黃丸”,被譽為“補陰方藥之祖”,首載于宋·錢乙《小兒藥證直決》,系錢乙從《金匱要略》的腎氣丸中減去桂枝、附子而成,由熟地黃、山茱萸、山藥、牡丹皮、澤瀉、茯苓6味藥物組成,具有填精滋陰補腎之功效,主治腎陰不足證[5]。有醫家從腎論治冠心病,運用六味地黃丸加減治療冠心病取得很好的臨床療效[6-9]。由于中藥及其復方具有多成分、多靶點、多通路協同作用的特點,這種復雜性使其作用機制不明確。網絡藥理學是指將藥物作用網絡與生物網絡整合在一起,分析藥物在此網絡中與特定節點或模塊的相互作用關系,從而理解藥物和機體相互作用的科學[10],從整體觀角度認識藥物與疾病間的相互作用[11]。本文通過運用網絡藥理學探討六味地黃丸治療冠心病的藥物成分及可能的分子作用途徑,通過建立“藥物成分-靶點-通路”之間的關系,分析該方治療冠心病的作用機制,以期為冠心病相關的基礎實驗研究及六味地黃丸的臨床合理應用提供理論依據。
1 材料與方法
1.1 六味地黃丸活性成分的篩選 運用中藥系統藥理學數據庫和分析平臺(TCMSP,http://tcmspw.com/tcmsp.php)篩選六味地黃丸全方中熟地黃、山茱萸、山藥、茯苓、澤瀉、牡丹皮的所有化學成分,建立六味地黃丸全方中藥化學成分數據庫。藥物在人體內要經過吸收、分布、代謝和排泄(ADME)過程才能到達靶器官發揮其治療作用,基于口服生物利用度(oralbioavailability,OB)、類藥性(Drug-likeness,DL)是篩選藥物的關鍵參數,以ADME參數中的OB≥30%、類藥性DL≥0.18[13-14]為限制條件進行初步篩選,匯總結果、去除重復、刪除沒有相關信息的化學成分,即為六味地黃丸治療冠心病相關的生物活性成分。
1.2 六味地黃丸活性成分的潛在靶蛋白的收集及網絡構建 根據已篩選的六味地黃丸全方中藥活性成分,通過TCMSP平臺檢索與候選化合物相關的潛在靶點,并通過 Uniprot數據庫(http://www.uniprot.org/)將預測出的靶點蛋白名轉換為基因名。將篩選的潛在靶點導入Cytoscape3.2.1軟件,構建6味中藥及其化學成分、潛在靶點的網絡可視化圖。
1.3 冠心病相關靶點的篩選 利用TTD、Drugbank、DisGeNET數據庫進行檢索,數據庫以“coronary heart disease”為檢索詞,收集與冠心病相關的靶點,并刪除假陽性和重復基因,最終確定冠心病相關靶基因。
1.4 構建六味地黃丸治療冠心病的相關網絡圖 采用Cytoscape3.2.1軟件構建六味地黃丸治療冠心病的相關網絡圖。將篩選的六味地黃丸的活性成分及其靶點導入Cytoscape 3.2.1軟件,構建“中藥-化合物-靶點”網絡。為明確六味地黃丸潛在靶點與冠心病相關靶點之間的相互作用,將藥物靶點與疾病靶點取交集,篩選出六味地黃丸與冠心病的共同靶點,通過Cytoscape3.2.1建立冠心病相關性的“化合物-靶點-冠心病”網絡。其中的節點(node)代表化合物、靶蛋白或疾病,邊(edge)代表這些節點之間的互作關系,即某個成分與靶點或靶點與疾病之間的聯系。
1.5 蛋白-蛋白相互作用網絡構建 將篩選到“疾病-藥物成分”共同靶點導入String數據庫(https://string-db.org/),構建蛋白-蛋白相互作用網絡,將物種設置為“Homo sapiens”,為確保數據的可靠性,蛋白最低相互作用閾值設為“highest confidence”(>0.9),對蛋白相互作用進行篩選,將結果保存成TSV格式,保留文件中node1、node2和Combined score數據并導入Cytoscap3.2.1軟件,分析蛋白相互作用網路。
1.6 GO功能富集分析和KEGG通路富集分析 生物學信息注釋數據庫(DAVID,https://david.ncifcrf.gov/summary.jsp,Version 6.8)[12]是支持大規模的基因/靶蛋白列表分析的穩定網絡數據庫,能夠找出最顯著富集的生物學注釋,被用來進行GO生物過程富集分析和KEGG代謝通路富集分析,以進一步研究六味地黃丸治療冠心病靶蛋白群的協同作用情況。將藥物與冠心病共同靶點導入DAVID數據庫,對共同靶點進行GO富集分析和KEGG通路分析,設定閾值P<0.05,篩選排名靠前的生物過程或通路。
2 結果
2.1 六味地黃丸的活性成分篩選與ADME分析 本研究通過TCMSP數據庫對六味地黃丸6味中藥已報道的化學成分進行檢索,共收集以OB≥30%、DL≥0.18為參數進行初步篩選,結果為熟地黃2個,山茱萸20個,山藥16個,茯苓15個,澤瀉10個,牡丹皮11個,刪除重復成分5個,剔除沒有相關信息成分26個,共有43個入血活性成分有良好的口服生物利用度和類藥性,見表1。將藥物成分及作用靶點導入Cytoscape 3.2.1軟件進行可視化分析,見圖1。共包括6味中藥,43種化學成分,208個潛在靶點。橢圓節點代表靶點,三角形節點代表化學成分,八邊形節點代表中藥。水綠色、紅色、淺藍色、黃色、綠色、紫色三角形節點分別代表熟地黃、山藥、山茱萸、澤瀉、茯苓、牡丹皮的化學成分。Sitosterol(谷甾醇)是熟地黃、山茱萸、牡丹皮、澤瀉4味中藥共有的化學成分,stigmasterol(豆甾醇)是熟地黃、山茱萸、山藥3味中藥共有的化學成分。
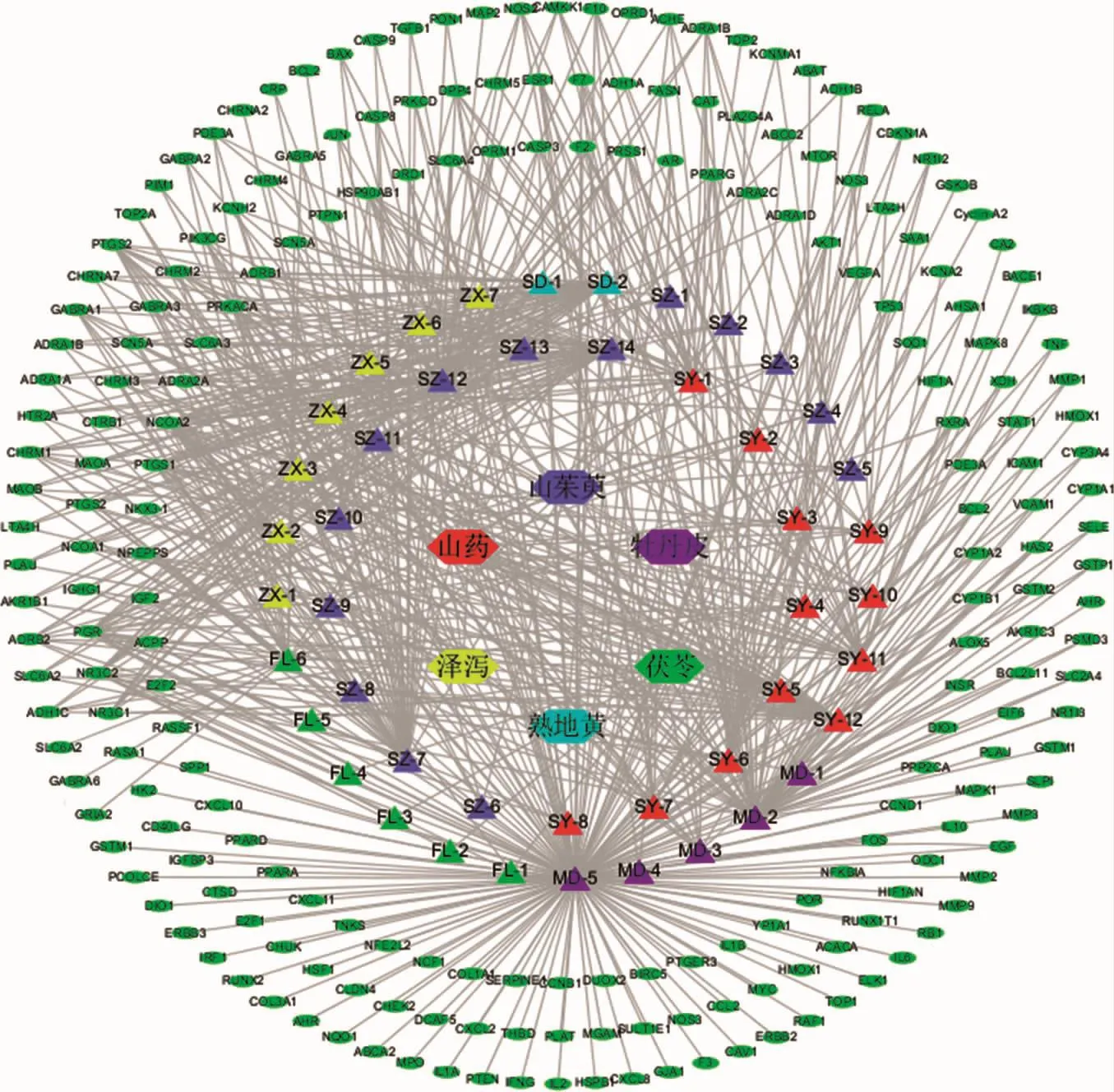
圖1 六味地黃丸-化合物-靶點相互作用網絡
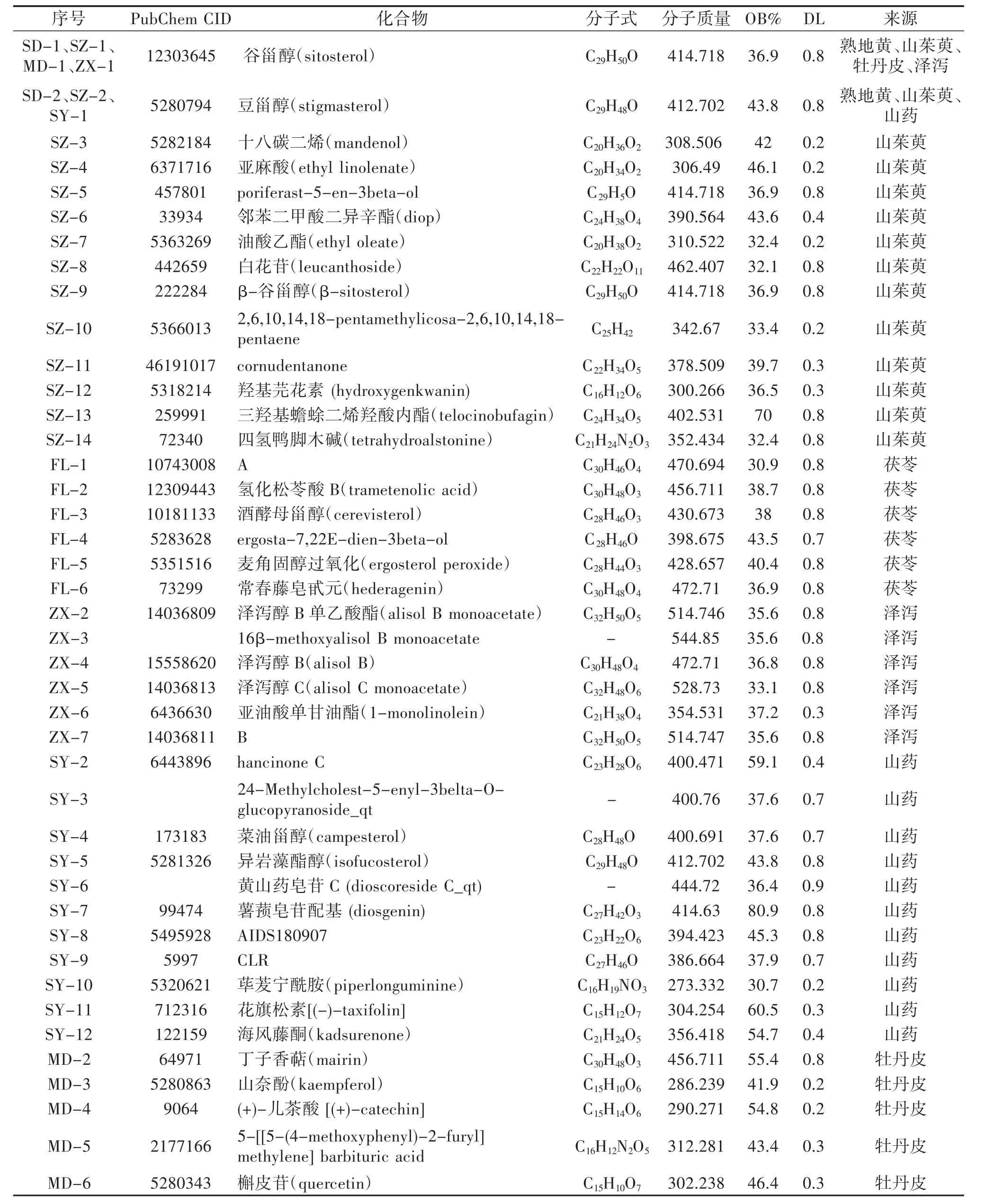
表1 六味地黃丸活性化合物信息
2.2 六味地黃丸中藥與冠心病相關靶點網絡構建與PPI網絡構建 通過TTD、Drugbank、DisGeNET數據庫進行檢索,獲得冠心病相關的靶點996個。將996個疾病靶點與208個藥物成分靶點輸入Venny 2.1軟件繪制韋,得到二者共同靶點85個,A代表冠心病靶點,B代表六味地黃丸潛在靶點,見圖2。通過Cytoscape3.2.1軟件建立中藥-靶點-疾病(traditional Chinese medicine-Target-Disease,C-T-D)網絡圖,見圖3,共包括6味中藥,1種疾病,85個靶點,最外層藍色橢圓形節點代表共同靶點。將85個共同靶點輸入STRING數據平臺,分析PPI網絡9(圖4)。該網絡由75個節點(10個節點未在網絡中)、195條邊組成。其中,節點的大小由自由度決定,自由度越大,節點越大。圖中節點顏色根據自由度進行設定,顏色從綠色逐漸到紅色的改變自由度逐漸增大,同一類的節點顏色相近;邊的粗細由介數決定,介數越大,邊越粗。其中腫瘤壞死因子(Tumor necrosis factor,TNF,度=22)、蘇氨酸蛋白激酶(threonine-protein kinase,AKT1,度=16)、白細胞介素 6(Interleukin-6,IL6,度=15)、血管內皮生長因子 A(Vascular endothelial growth factor A,VEGFA,度=14)、(Retinoic acid receptor RXR-alpha,RXRA,度=12)、白細胞介素 8(In-terleukin-8,CXCL8,度=12)、細胞腫瘤抗原 p53(Cellular tumor antigen p53,TP53,度=12)、原癌基因 c-Fos(Proto-oncogene c-Fos,FOS,度=12)等靶蛋白度值大,與其他靶蛋白相互作用強,在網絡中發揮了關鍵作用。由此推測,這些蛋白可能是六味地黃丸治療冠心病的關鍵靶蛋白。
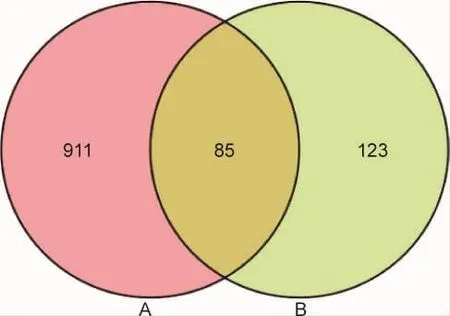
圖2 冠心病靶點與六味地黃丸靶點Venn圖

圖3 六味地黃丸與冠心病共同靶點網絡圖

圖4 PPI網絡構建
2.3 GO生物學過程富集分析 對六味地黃丸治療冠心病的相關靶點進行GO生物學過程分析,取P值最小的前20個生物學過程,見表2。GO生物學過程富集分析結果提示,39個靶點參與細胞組分(45.9%),13個靶點參與了信號通路傳導(15.3%),8個參與了炎癥反應(9.4%),13個靶點參與了RNA聚合酶II啟動子調控(15.3%),6個靶點參與了調控血管生成(7.1%),12個靶點參與了DNA復制(14.1%),10個靶點參與了DNA轉錄(11.8%)等。由此可知,六味地黃丸可能通過調節多種生物過程治療冠心病。

表2 GO功能富集分析
2.4 六味地黃丸KEGG代謝通路富集分析 利用David平臺對篩選出的核心靶點進行KEGG通路富集分析,共獲得90條富集結果,其中P<0.01,與冠心病密切相關的前20條信號通路包括癌癥通路、腫瘤壞死因子(TNF)、缺氧誘導因子-1(HIF-1)、雌激素(Estrogen)、toll樣受體(TLRs)、磷脂酰肌醇 3-激酶-蛋白激酶(PI3K/Akt)、核因子(NF-κB)、環鳥苷酸依賴的蛋白激酶(cGMP-PKG)、環磷酸腺苷(cAMP)、血管內皮生長因子(VEGF)、絲裂原活化蛋白激酶(MAPK)等信號通路,見表3。這提示六味地黃丸通過作用于多條信號通路、多靶點來治療冠心病,且這些通路之間存在著復雜的相互作用關系。
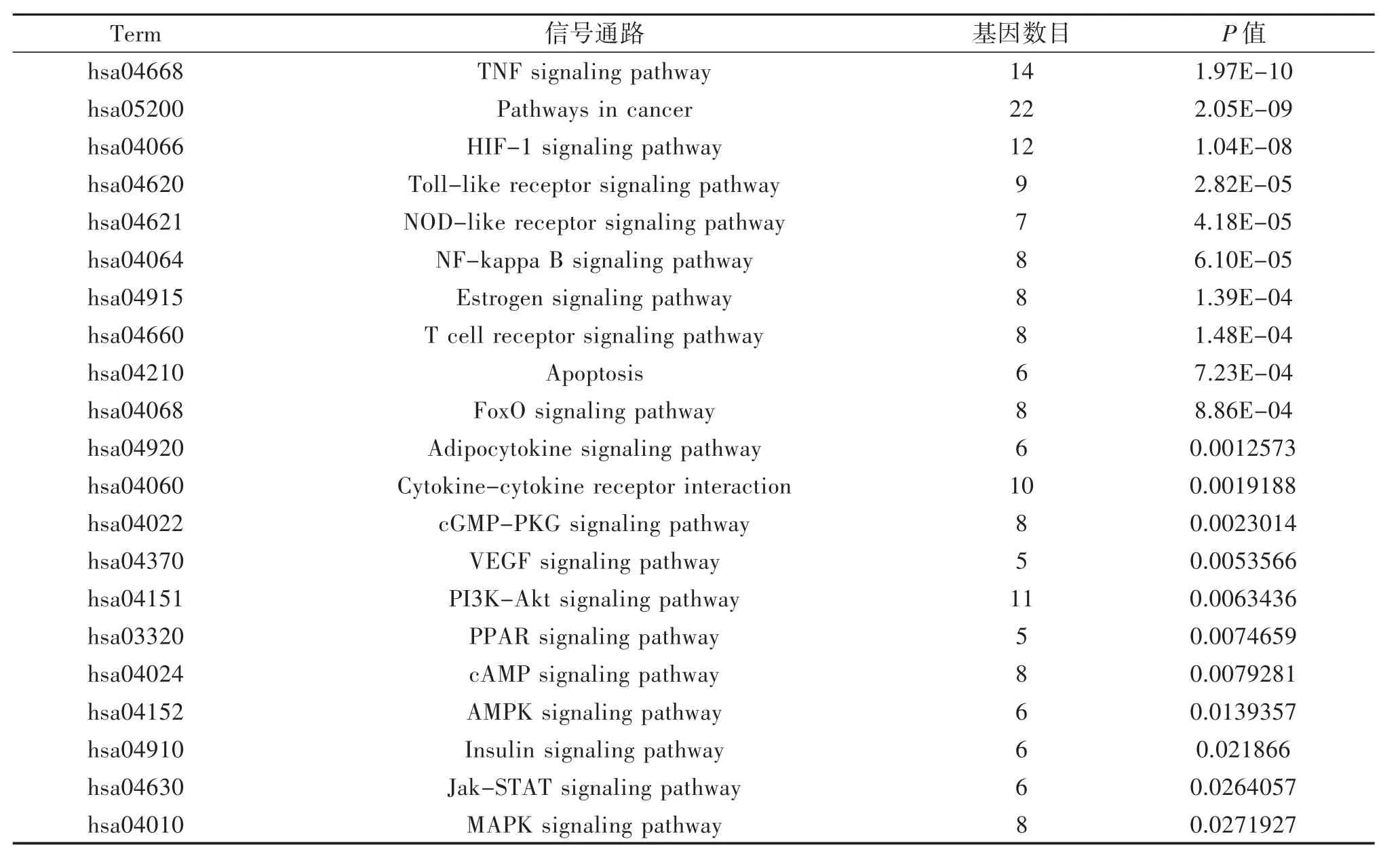
表3 靶點通路富集結果
3 討論
冠心病是冠狀動脈由于各種原因發生粥樣硬化,導致血管狹窄或閉塞,使心肌缺血缺氧或壞死引起的心臟病,也稱缺血性心臟病。其主要危險因素包括高血壓、血脂異常、糖尿病、肥胖和超重、吸煙、遺傳因素等[3],近10余年我國冠心病發病率呈明顯上升趨勢[15]。六味地黃丸是中醫臨床治療冠心病的經典方,現代藥理研究表明,熟地黃[16]、山藥[17]具有抗氧化作用,澤瀉具有降血壓、降血脂、降血糖、抗炎、抗氧化、保護血管內皮的功能[18],牡丹皮可以降血糖[19]、保護心血管[20-21],山茱萸具有降血糖、降血脂的作用[22],茯苓具有抗炎作用[23]。雖然對六味地黃丸6味中藥主要成分的藥理學作用已基本明確,但作為復方研究其治療冠心病的潛在靶點和可能作用機制卻鮮見報道。
本研究經過初步篩選得到74個六味地黃丸的生物活性成分,剔除重復和沒有相關信息的成分后最終獲得43個生物活性成分,對應成分靶點208個,冠心病靶點996個,二者共同靶點85個。通過對85個靶蛋白進行 PPI 分析發現,TNF、AKT1、IL6、VEGFA、RXRA、CXCL8、TP53、FOS 等靶蛋白度值大,說明這些靶蛋白在六味地黃丸治療冠心病過程中發揮著關鍵的作用,揭示了六味地黃丸可能通過抗炎、抗氧化、保護血管內皮等多途徑來治療冠心病。
GO富集分析結果顯示,六味地黃丸治療冠心病主要涉及細胞分裂、氧化應激、物質代謝、DNA復制及其轉錄等生物學過程,蛋白、受體、轉錄因子、激素、信號分子等多種物質參與,說明六味地黃丸治療冠心病是一個十分復雜的生物學過程。
KEGG通路富集分析結果顯示,六味地黃丸治療冠心病相關的信號通路包括TNF、HIF-1、PI3K/Akt、Estrogen、TLRs、NF-κB、cGMP-PKG、cAMP、VEGF等。冠心病是一種復雜的慢性炎癥性疾病,相關研究表明,炎癥反應和免疫反應在冠心病的發生、發展及其預后過程中發揮著極其重要的作用[24]。TNF-α是人體內介導炎癥反應、調節細胞和體液免疫的主要細胞因子,其血清水平可以反應機體炎癥反應狀況,TNF-α與冠心病密切相關[25],并且血清TNF-α水平與冠心病嚴重程度密切相關[26]。缺氧誘導因子-1(HIF-1)是低氧狀態下組織細胞產生的一種核蛋白,用于維持氧穩態的關鍵物質[27],當心肌缺血缺氧時HIF-1α表達增加,促進血管新生,增加心肌血供,對保護心肌具有重要意義[28]。PI3K/Akt信號通路具有廣泛的生物學作用,參與調節細胞周期、能量代謝、物質合成等途徑,是治療冠心病、代謝紊亂等多種疾病的重要靶點[29]。此外,PI3K/Akt信號通路可通過抑制糖原合酶激酶-3(glycogen synthase,GSK-3)的活性,增加心肌對葡萄糖的攝取和脂代謝來實現保護心臟的作用[30],韓軍等[31]通過激活 PI3K/Akt信號通路,降低IL-6、TNF-α的活性,減輕炎癥反應,保護心肌。Estrogen可以通過調節脂質代謝、抑制炎癥反應、減輕心肌缺血損傷及保護血管內膜等方面預防冠心病[32],雌激素水平降低,心血管疾病和動脈粥樣硬化進展的風險在絕經后顯著增加[33]。TLRs是一種Ⅰ型跨膜蛋白受體,能夠介導天然免疫和獲得性免疫反應,其介導炎癥反應、調控免疫反應、參與細胞凋亡、斑塊穩定性及血管重塑等動脈粥樣硬化過程,與冠心病有密切的關系[34]。核因子κB(NF-κB)信號通路與冠心病的發生發展過程密切相關[35],其在調節動脈粥樣硬化(atherosclerosis,AS)的炎癥反應中起關鍵作用,曹選超等[36]發現NF-κB高表達的患者可能存在嚴重的冠脈狹窄,NF-κB信號通路經多種刺激因子誘導后,在下游調節白細胞介素相關基因,凋亡抑制因子等多種基因的表達,不僅參與機體免疫調節、炎癥反應及腫瘤等生理病理過程,還參與感染、細胞周期調控、細胞分化及凋亡等[34]。現有的研究結果證明,cGMP-PKG信號通路對于調控心血管系統的正常功能起著重要的作用,其在調節血壓、抑制動脈粥樣硬化和抗再狹窄、抗血管損傷、調節調節血管平滑肌細胞的收縮和舒張、抑制心肌細胞肥大等方面發揮重要作用[37-38]。cAMP是傳遞生命信息的重要物質,與心肌細胞的抗缺血、抗氧化及抗損傷能力密切相關,其可增強心肌細胞收縮力,增加心輸出量,在一定程度上減輕了心肌缺血[39]。KEGG通路富集結果提示,六味地黃丸可能通過抑制炎癥反應、抗氧化應激、抗心肌缺血、保護血管內皮、調節脂代謝等途徑治療冠心病。
綜上所述,本研究通過運用網絡藥理學方法,將網絡數據庫、藥理學等多學科相結合,從系統生物學角度揭示六味地黃丸的中藥藥理作用,從多角度探索了六味地黃丸治療冠心病的可能作用機制,預測了六味地黃丸治療冠心病的潛在靶點和信號通路,為其臨床應用及進一步驗證其藥理作用機制提供理論基礎。

