中高溫α-淀粉酶熱穩定性的研究進展
曹慧慧,胡珈瑋,桂 波,王進軍
(揚州大學 環境科學與工程學院,江蘇 揚州 225172)
1 引言
α-淀粉酶是一種液化型、內切型淀粉酶,作用于淀粉時以無規則的方式切開其內部α-1,4糖苷鍵,使得淀粉粘度快速下降成為液化淀粉且不再與碘有呈色反應,生成物為糊精以及少部分還原糖,由于產生的還原糖在光學結構上是α-型,因此該水解酶被稱作α-淀粉酶。目前對于常溫、中溫和耐高溫α-淀粉酶的分級溫度尚沒有一個嚴格的界定,一般認為最適反應溫度在60 ℃以上的為中高溫型α-淀粉酶,在啤酒釀造、酒精工業、紙漿和造紙業等行業中應用廣泛,耐高溫α-淀粉酶甚至在95~105 ℃間依然可以保持高酶活,其更大的耐熱潛力仍有待探究。淀粉的酶轉化工業包括三個步驟——糊化、液化與糖化[1]。在高溫下加熱淀粉溶液即可達到淀粉糊化的目的,而液化和糖化過程需要相應酶的參與,此時為了避免過長的冷卻時間,就需要一批在較高溫度下仍能保持相對穩定的淀粉酶,因此篩選或改造出熱穩定性高的α -淀粉酶對淀粉轉化工業的發展進步具有重大意義。
2 α-淀粉酶的來源
如今應用于工業上的中高溫α-淀粉酶大多是微生物來源。來源于動物、植物、微生物的α-淀粉酶其酶解適溫分別在40~50 ℃、35~40 ℃、60 ℃以下,當然,微生物界由于生存環境遍布火山深海、極地荒漠等條件極端的地區,不乏具有極端嗜熱、耐酸堿、耐低溫等特性的α-淀粉酶產生菌。如某些生存在火山口、溫泉、堆肥區等高溫環境中的微生物,體內含有豐富的熱穩定性酶,有待探尋和研究。細菌、真菌(絲狀真菌)、酵母菌以及放線菌等微生物都能產生α—淀粉酶,其中能夠滿足工業生產條件并已經投入應用的α-淀粉酶多來源于細菌和絲狀真菌。
2.1 細菌α-淀粉酶
細菌α-淀粉酶在淀粉加工業中主要是起到液化和降低淀粉粘度的作用。芽孢桿菌屬通常被認為是中高溫α -淀粉酶的優良生產菌屬,如枯草芽孢桿菌(Bacillussubtilis)、地衣芽孢桿菌(Bacilluslicheniformis)、解淀粉芽孢桿菌(Bacillusamyloliquefaciens)、嗜熱脂肪芽孢桿菌(Bacillusstearothermophilus)等,表1所列為部分芽孢桿菌屬來源的α -淀粉酶及其最適反應溫度。

表1 芽孢桿菌屬來源的α -淀粉酶及其最適反應溫度
2.2 真菌α-淀粉酶
相較于細菌,真菌來源的α-淀粉酶可以水解麥芽三糖,生成麥芽糖和其他低聚寡糖,因此廣泛應用于麥芽糖漿的生產工業中。真菌α-淀粉酶的反應溫度多在50~55 ℃間,反應溫度溫和、耐熱性較低,少部分具有耐熱性質的真菌α-淀粉酶在60 ℃以上的作用溫度下仍能保持良好的熱穩定性。與中性酶相比,耐熱性淀粉酶在液化、糖化等淀粉深加工過程中能夠避免在中溫反應條件下極易發生的染菌問題并且降低了生產成本[12]。表2為部分真菌來源的α-淀粉酶及其最適反應溫度。
3 影響α-淀粉酶熱穩定性的因素及提高方法
3.1 影響α-淀粉酶熱穩定性的因素
α-淀粉酶本質上是一種擁有催化功能的蛋白質,各種不利環境條件如高低溫、輻射、抑制劑的存在等都會影響其催化活性,尤其是在一定高溫條件下極易失活,這種對熱的不穩定性嚴重影響其應用。任何可能會致使酶蛋白空間結構發生變化的因素都會影響到酶的熱穩定性,如酶液中底物的濃度、反應液的pH值、添加劑種類和濃度等。當水解淀粉的反應液中能夠保持較高的淀粉濃度,酶的熱穩定性和活力都會有所提高;霉菌中的黑曲霉在偏酸性條件下的熱穩定性要明顯高于中堿性條件下的,而米曲霉則相反,在pH值為2.5、55 ℃條件下活性幾乎完全喪失,而在pH值為7.0條件下可15 min不失活[19]。研究發現,反應液中加入羧酸類添加劑如二苯基乙酸鈉可以提高α-淀粉酶的熱穩定性使得高溫下半衰期延長,且該特性隨著羧酸鏈長增加而增加[20]。

表2 部分真菌來源的α-淀粉酶及其最適反應溫度
3.2 提高α-淀粉酶熱穩定性的途徑
從根本上說,α-淀粉酶的熱穩定性與其在高溫狀態下多肽鏈的特性和空間立體結構的變化有關,所以利用蛋白質工程技術對酶進行理性設計是如今提高酶熱穩定性或達成其他特質的改造目的最根本性的方法。研究表明,一些熱穩定性良好的α-淀粉酶在分子水平上有幾點共同的特征。
(1)Ca2+、Zn2+等金屬離子結合位點的存在。當在降解淀粉的反應液中加入部分Ca2+時,很多α-淀粉酶的熱穩定性會得到明顯提高,說明了α-淀粉酶對鈣離子的依賴性[21]。如來源于地衣芽孢桿菌的α-淀粉酶具有優良的催化活力和耐熱性能而被廣泛應用,但卻十分依賴于Ca2+。在趙熒等[22]的研究中,發現Ca2+不僅參與α-淀粉酶的催化作用,還能對酶結構起穩定作用。曾靜等[23]對一來源于極端嗜熱古生菌KOD1的α-淀粉酶Apk A進行氨基酸序列分析后,對其多個Ca2+結合位點進行定點突變,結果顯示突變體在90 ℃和100 ℃下的熱穩定性均有明顯下降,原酶在90 ℃下半衰期為5 h,而突變體只有2 h,表明原酶中的具有高親和力的Ca2+結合位點對該酶熱穩定性具有重要意義。曾靜等[24]同樣基于定點突變技術向一嗜熱α-淀粉酶Apk A的兩個氨基酸殘基中引入PFA的Zn2+結合位點,構建一雙位點突變體,其中PFA是目前已知的耐熱性最強的α-淀粉酶。結果顯示該突變體的熱穩定性有顯著提升,在90 ℃下的熱失活半衰期由5h提高至10,100 ℃下半衰期達到80 min,為原酶的十倍。
(2)較多的氫鍵數目。楊倩等[25]對一米根霉產α-淀粉酶ROAmy的氨基酸殘基進行了定點突變,幾株突變體的酶活及耐熱性能都有顯著的提高,其中一性能優秀的突變體G128L/K269L/G393P在55 ℃下的熱失活半衰期提升約為原酶的5.63倍,經過結構分析,得出在特定位置引入脯氨酸以及增加氫鍵數目可能對酶熱穩定性提高具有重要意義的結論。
除此之外,α-淀粉酶分子內緊湊的空間結構,α-螺旋的穩定結構,相較于不耐熱α-淀粉酶更多的疏水性氨基酸等特征都有利于酶的熱穩定性。
除了在分子水平上對α-淀粉酶進行定點突變、修飾酶的遺傳特性等從根本上改造酶的方法外,通過添加熱穩定劑來提高α-淀粉酶耐熱性是一種簡單有效的方法。在王愛平[26]的研究中,發現α-淀粉酶的失活過程符合一級失活動力學方程:A=Amaxexp(-Kpt),其中Amax為初始酶活,Kp為失活系數。而在加入熱穩定劑(醋酸鈣、乳酸鈉、殼聚糖、L-組氨酸)后,該酶的熱失活動力學不再嚴格符合上述反應式,失活速度有不同程度的減緩。各熱穩定劑對該酶在高溫下的半衰期有很大影響,已知原酶在70 ℃的半衰期為1.8 min,表3為加入不同熱穩定劑后α-淀粉酶在70 ℃下的半衰期及提高倍數。
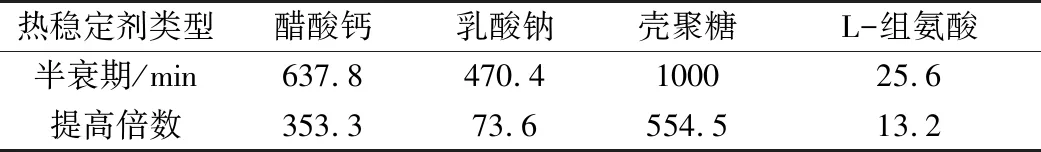
表3 70 ℃不同熱穩定劑對α-淀粉酶的效果

