萊菔硫烷對常氧條件下成骨細胞活性的影響
陳巧鳳 聞博 謝俊杰 曾冰
福建醫科大學附屬泉州第一醫院骨科,福建 泉州 362000
萊菔硫烷(sulforaphane, SFN)是一種含硫化合物(異硫氰酸酯,ITC),來自十字花科蔬菜,如西蘭花和西蘭花芽[1],幾項研究報道[2]指出,ITC具有抗腫瘤、抗炎和抗氧化活性的作用。SFN的抗氧化功能是由增強核因子2(Nrf2)依賴性誘導的血紅素加氧酶1(HO-1)介導的,保護細胞免受氧化應激的損傷[3-4]。SFN由于具有能夠通過激活Nrf2信號傳導途徑誘導產生一定濃度的抗氧化酶的能力,已經受到了大量的關注,是Nrf2-ARE信號通路最有效的誘導劑之一[5]。
但是在2000年,即SFN出現后8年,Gamet等[6]第一次報道了SFN參與線粒體的變化。SFN似乎存在著相互矛盾的行為:SFN可以誘導癌細胞線粒體的有害變化,最終會通過細胞凋亡導致細胞死亡,但是它也可以保護非癌細胞線粒體免受氧化攻擊,從而阻止了細胞死亡[7],萊菔硫烷的這些作用與其調節線粒體活性變化有關。以往的文獻都集中在SFN對氧化應激條件下細胞的作用,筆者將探索在常氧條件下SFN對成骨細胞的作用,并探討其可能的機制。
1 材料與方法
1.1 材料
1.1.1 細胞來源:成骨細胞hfob1.19購于吉妮歐生物有限公司(中國)。
1.1.2 主要試劑及耗材:RPMI-1640(SH30809.01B/500 mL,Hyclone,美國); 胎牛血清(SV30087.03/500 mL,Hyclone,美國); 雙抗(SV30010/100 mL,Hyclone,美國); 胰酶(SH30042.01/100 mL,Hyclone,美國); PBS(SN331,南京生興生物技術有限公司,中國); DMSO(C6295-50 mL,Sigma,中國); 萊菔硫烷(SFN)(sbj-i0631/20 mg,南京森貝伽生物科技有限公司,中國); MTT(5 g,Bisharp,中國); PI-AnnexinV-FITC細胞凋亡檢測試劑盒(EMS500FI/300 T,eBioscience,中國); 活性氧檢測試劑盒(DCFH-DA, S0033,上海碧云天生物技術有限公司,中國)。
1.1.2 主要儀器和設備:CO2細胞孵育箱(Thermo公司,美國); 厭氧培養箱(Thermo公司,美國);多功能酶標儀(SpectraMax M5,MD公司,美國); 流式細胞儀(FACSCaliburBD Biosciences,美國); 高速離心機(Thermo公司,美國); 熒光分光光度計(上海棱光,中國)。
1.1.3 藥液配制:萊菔硫烷(SFN)用二甲基亞砜(DMSO)溶解配制成100 mmol/L的儲存液,分裝后儲存于-20 ℃。根據實驗需要,使用時用1640完全培養液分別按照1∶20 000、1∶10 000、1∶5 000的比例稀釋成最終濃度為5、10、20 μmol/L,直接加入到培養皿或培養板中。
1.2 實驗方法
1.2.1 細胞培養:hfob1.19細胞是貼壁細胞,培養在含15%胎牛血清、100 U/mL青霉素、100 μg/mL鏈霉素的1640培養基中,置于34 ℃,含5% CO2的細胞培養箱中。當hfob1.19細胞長至80%~90%時,去除培養基,加入PBS沖洗1~2次。去除PBS后,加入1 mL胰酶消化1~3 min,加入3 mL完全培養基中和胰酶終止消化,將消化的細胞轉移至15 mL離心管中,1 000 r/min, 離心5 min。倒掉上清后,加入3 mL培養基重懸細胞,1∶3傳代至培養皿中培養。當hfob1.19細胞長至80%~90%時,去除培養基,加入PBS沖洗1~2次,去除PBS后,加入1 mL胰酶消化1~3 min,加入培養基重懸細胞,用血球計數板對細胞進行計數,六孔板每孔種2×106個細胞,將細胞搖晃均勻,放入培養箱中培養。常氧培養過夜后,根據實驗分組分別加入SFN 0、5、10、20 μmol/L,分別培養24 h和48 h。
1.2.2 MTT檢測細胞增殖:用血球計數板計5 000個細胞分別加入96孔板中。根據實驗分組分別加入SFN 0、5、10、20 μmol/L,分別培養24 h和48 h 后,去掉培養基,每孔加入50 μL MTT,在細胞培養箱中繼續培養約3 h。每孔加入150 μL DMSO,搖晃均勻,在570 nm處測定吸光度。
1.2.3 流式檢測細胞凋亡:在六孔板中分別種2×106個細胞,根據實驗分組分別加入SFN 0、5、10、20 μmol/L,分別培養24 h和48 h 后,用胰酶消化收集細胞。用預冷的PBS洗三次細胞,4 ℃,1 000 r/min離心5 min,棄上清。加入1 mL binding buffer洗細胞,4 ℃,1 000 r/min離心5 min,棄上清。加入100 μL binding buffer重懸細胞,加入5 μL PI和5 μL FITC-Annexin V,混合均勻,常溫避光孵育15 min,加入400 μL binding buffer混勻,立刻用流式細胞儀檢測。
1.2.4 檢測細胞內ROS形成:hfob1.19細胞進行培養過夜后,根據實驗分組分別加入SFN 0、5、10、20 μmol/L,分別培養24 h和48 h,常規消化細胞,收集細胞沉淀,制備細胞懸液。按照1∶1 000用無血清培養液稀釋DCFH-DA,使終濃度為10 μmol/L。收集細胞后懸浮于稀釋好的DCFH-DA中,細胞濃度為100萬~2 000 萬/mL,37 ℃細胞培養箱內孵育20 min。每隔3~5 min顛倒混勻一下,使探針和細胞充分接觸。用無血清細胞培養液洗滌細胞3次,以充分去除未進入細胞內的DCFH-DA。使用488 nm激發波長,525 nm發射波長,在熒光分光光度計檢測熒光強度。
2 結果
2.1 MTT檢測細胞增殖
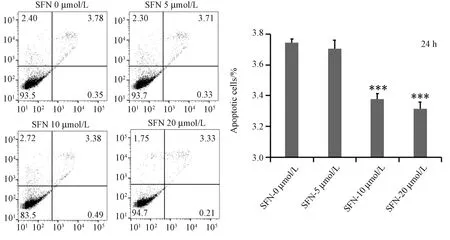
圖2 常氧條件下不同濃度SFN作用hfob1.19細胞24 h細胞流式細胞儀檢測結果(與0 μmol/L SFN組相比,***P<0.001)Fig.2 Results of different concentrations of SFN on hfob1.19 cells for 24 h by flow cytometry
24 h組的OD值分別為0.63±0.02,0.77±0.04,0.91±0.04,0.85±0.01,而48 h組的OD值分別為0.53±0.04,0.65±0.04,0.82±0.02,0.76±0.04。結果表明,在常氧條件下,當SFN作用濃度為5 μmol/L 和10 μmol/L 時細胞的OD值增加明顯,當濃度為20 μmol/L 時曲線趨于平緩甚至下降(圖1)。實驗至少獨立重復3次,數據以均數±標準差表示。

圖1 常氧下不同濃度SFN作用hfob1.19的OD值Fig.1 OD values of hfob1.19 cultivated under normoxia conditions with different concentrations of SFN addition
2.2 流式檢測細胞凋亡
經流式細胞儀檢測細胞凋亡后發現24 h組的細胞凋亡率分別為3.76%、3.71%、3.38%、3.33%,與0 μmol/L SFN組對比,10 μmol/L、20 μmol/L 組有統計學意義; 在常氧條件下SFN濃度為10 μmol/L、20 μmol/L時,細胞凋亡減少明顯。與0 μmol/L SFN組對比,實驗組之間有統計學意義(P<0.001),見圖2; 48 h組的細胞凋亡率分別為4.02%、3.49%,3.33%,3.09%,結果顯示與0 μmol/L SFN組對比,各組均有統計學意義(P<0.001),見圖3; 在常氧條件下,5 μmol/L、10 μmol/L、20 μmol/L SFN分別作用于成骨細胞時,細胞凋亡減少。實驗至少獨立重復3次,數據以均數±標準差表示。
2.3 檢測細胞內ROS形成
24 h組的細胞ROS值分別為3 152.67±118.73,2 762.33±75.25,2 384.67±100.52, 2 165.67±196.02; 48 h組的細胞ROS值分別為3 762.33±74.65,3 291±90.02,2 956.67±78.27,2 746.33±82.08。結果顯示,不同濃度的SFN會降低細胞內的活性氧水平,在濃度為10 μmol/L、20 μmol/L 時,降低更為明顯。實驗至少獨立重復3次,數據以均數±標準差表示。見圖4。
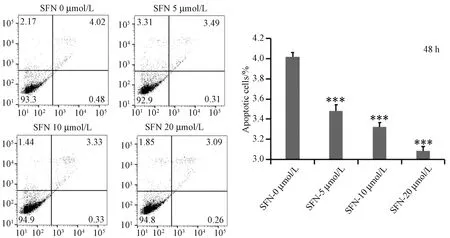
圖3 常氧條件下不同濃度SFN作用hfob1.19細胞48 h細胞流式細胞儀檢測結果(與0 μmol/L SFN組相比,***P<0.001)Fig.3 Results of different concentrations of SFN on hfob1.19 Cells for 48 h by flow cytometry
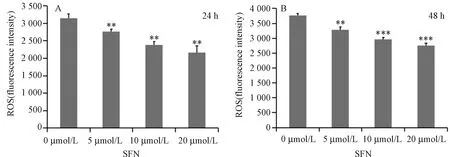
圖4 常氧條件下不同濃度SFN作用成骨細胞24 h和48 h后hfob1.19細胞內活性氧水平(A:24 h組;B:48 h組。與0 μmol/L SFN組相比,**P<0.01,***P<0.001)Fig.4 The intracellular levels of reactive oxygen species of hfob1.19 cells were detected after different concentrations of SFN acted for 24 h and 48 h on normoxic conditions
3 討論
氧化應激的概念最早源于人類對衰老的認識。1956年英國學者Harmna首次提出自由基衰老學說,該學說認為自由基(free radical)攻擊生命大分子造成組織細胞損傷,是引起機體衰老的根本原因,也是誘發腫瘤等惡性疾病的重要起因。缺血再灌注損傷是許多疾病(急性心肌梗塞,中風)或手術環境(移植,止血帶相關手術)的常見并發癥,其會產生氧化應激,有潛在的有害和致殘后果。缺血再灌注在骨科各種臨床操作中都能遇到,比如骨折愈合期間損傷血管的修復及新生血管的形成和生長,其產生的作用將影響成骨細胞的增殖和礦化。實驗[8]表明,缺氧及缺氧再復氧環境會降低成骨細胞活性,增加細胞凋亡率,而且缺氧再復氧環境會加重缺氧狀態下成骨細胞損傷。
目前對于成骨細胞缺氧的機制及治療研究較多,萊菔硫烷在實驗中也證實具有抗氧化還原的作用,在骨折愈合及骨質疏松的治療中有作用,但其對常氧下成骨細胞作用未見報道。
萊菔硫烷的抗氧化作用主要是通過Nrf2-ARE 信號通路發揮重要作用。Nrf2 核轉位并且結合核酸序列上的抗氧化反應元件ARE,活化 Nrf2-ARE信號通路并啟動下游的Ⅱ相解毒酶、抗氧化酶系等的轉錄,從而減輕活性氧和親電子物質引起的細胞損傷,使細胞處于穩定狀態,維持機體氧化還原動態平衡[9]。萊菔硫烷的最大特點是其由于中心碳的親電性而引起化學反應性的異硫氰酸酯基團,異硫氰酸酯基團與含硫、氮和氧的親核試劑容易發生反應[10]。細胞中最常見的是異硫氰酸鹽與蛋白質中的半胱氨酸殘基和谷胱甘酸結合的可逆反應[11],它可以誘導轉錄因子Nrf2轉移到細胞核中,細胞核隨后與抗氧化劑反應元件結合,導致抗氧化基因的轉錄,包括血紅素加氧酶1,NAD(P)H醌氧化還原酶1,谷胱甘肽-S-轉移酶和谷氨酸半胱氨酸連接酶[12]。萊菔硫烷是Ntf2途徑的有效激活劑,可以調節許多抗氧化酶,防止氧化損傷。
線粒體是有氧細胞體內的能量發生器,為細胞提供大部分的ATP。當ATP充足時,體內需求/產生與電子傳遞鏈的最佳能力相結合。當體內處于低氧或者受到外部條件刺激時(比如氧化應激狀態),需氧細胞在代謝過程中產生一系列活性氧簇(reactive oxygen species,ROS),包括:過氧化氫(H2O2)、氧自由基(02-)、羥自由基(0H-)等[14]。ROS產生增加,糖酵解和ROS形成之間存在正反饋[13],消耗大量的ATP[15]。在生理條件下,ROS形成和抗氧化系統消除之間有一個平衡[16],常氧培養下成骨細胞內的活性氧隨時間變化不大,細胞凋亡比例也少。本實驗發現在常氧培養條件下,不同濃度的萊菔硫烷均有降低體內活性氧,減少細胞凋亡的作用。但筆者認為在常氧條件下培養的成骨細胞產生的活性氧對機體影響并不大,常氧下萊菔硫烷的抗氧化還原臨床意義不大。
在細胞增殖方面,SFN濃度為5 μmol/L、10 μmol/L 時可促進細胞的增殖,但當濃度提升到20 μmol/L,細胞增殖曲線趨于平緩甚至有所下降。考慮其原因,可能此時萊菔硫烷的應用改變了線粒體的結構和功能,影響了成骨細胞的活性。大量文獻報道,萊菔硫烷通過參與線粒體復合物氧化損傷、細胞凋亡的線粒體途徑、線粒體膜電位改變、線粒體生物合成以及內質網-線粒體紊亂等途徑調控線粒體代謝。Sohel 等[17]在不同濃度的SFN誘導顆粒細胞(GC)中的抗氧化和凋亡作用的實驗中發現SFN 濃度為2 μmol/L 和10 μmol/L 時沒有觀察到線粒體活性的變化;然而,在高濃度(20 μmol/L)下顯著降低了線粒體的活性。低濃度的SFN激活與細胞存活途徑相關的基因,而高濃度誘導參與抗增殖和凋亡途徑的基因的表達。Zanichelli等[18]證明低濃度的SFN(0.25~5 μmol/L)促進了人類間充質干細胞的增殖并保護它們免于細胞凋亡和衰老,而較高濃度(20 μmol/L)具有細胞毒性作用,導致細胞進入細胞周期停滯,程序性細胞死亡和衰老。
因此,SFN是否在不同的細胞生存條件下發揮不同的藥物作用,還是直接與細胞結合,發生代謝調控作用,這些都是未來進一步研究的熱點,也將為臨床在常氧條件下是否需要使用抗氧化劑及抗氧化劑使用劑量等提供參考。
4 結論
在常氧培養條件下,低濃度的萊菔硫烷可促進細胞的增殖,濃度升高反而會抑制細胞增殖;萊菔硫烷對成骨細胞可以起到抗氧化作用。

