自體全血注射對自體血清皮膚試驗陽性的難治性慢性自發性蕁麻疹患者嗜堿性粒細胞FcεRⅠ與CD63表達的影響
羅金成 陳曙光 劉文英 徐艷 宋志強
陸軍軍醫大學第一附屬醫院皮膚科,重慶 400038
自體血清皮膚試驗(autologous serum skin test,ASST)陽性的慢性自發性蕁麻疹(chronic spontaneous urticaria,CSU)患者的癥狀和體征較ASST陰性CSU患者更重,更容易對抗組胺治療抵抗,病程也更長,其治療在臨床上是一大棘手問題[1]。10%~50%的慢性蕁麻疹患者對常規劑量抗組胺治療反應欠佳,有學者將其定義為慢性難治性蕁麻疹[2]。國內外研究[3-6]證實,自體全血注射(autologous whole blood injection,AWBI)和自體血清注射有助于改善ASST陽性的慢性蕁麻疹患者的臨床癥狀,但其作用機制尚不清楚。國外已有報道CSU患者外周血嗜堿性粒細胞數目與病情嚴重程度負相關[7]。新近研究發現,奧馬珠單抗治療慢性蕁麻疹的療效機制與其顯著下調嗜堿性粒細胞FcεRⅠ受體的表達有關[8]。我們觀察AWBI治療前后CSU患者嗜堿性粒細胞FcεRⅠ與CD63表達的變化,旨在闡明AWBI治療的可能機制。
對象與方法
一、研究對象
1.研究對象:2017年11月至2018年6月陸軍軍醫大學第一附屬醫院皮膚科門診收治的ASST陽性難治性CSU患者80例。
2.納入標準:①臨床診斷為CSU,風團和瘙癢反復發作持續6周以上;②ASST陽性(反應等級>++);③采用一種抗組胺藥遵循藥品說明書推薦劑量規范治療2周以上而不能有效控制病情[周蕁麻疹病情活動程度(UAS7)≥16分][9];④年齡12~70歲;⑤自愿參加臨床試驗研究且能夠按臨床研究方案執行。另外,在篩選ASST陽性患者時,征得部分ASST陰性患者知情同意后,收集其行ASST試驗后剩余的血清用于血清誘導的嗜堿性粒細胞CD63活化試驗。
3.排除標準:物理性蕁麻疹、遺傳血管性水腫及由其他明確原因(如藥物、感染等)引起的蕁麻疹;同時伴有血液系統腫瘤、自身免疫性疾病、上呼吸道感染或正在接受抗凝血藥物或系統糖皮質激素治療者;孕婦及哺乳期婦女。
4.分組:采用隨機數字表法將患者分成AWBI組(40例)與對照組(40例)。AWBI組女30例,男10例,年齡18~69(39.98±12.38)歲,病程中位數6個月(范圍3~72個月)。對照組女29例,男11例,年齡13~67(37.50±12.95)歲,病程中位數6個月(范圍3~66個月)。兩組的性別(χ2=0.065,P>0.05)、年齡(t=0.168,P>0.05)以及病程(U=735,P>0.05)差異均無統計學意義。選取同期我院體檢中心25例健康志愿者作為健康對照組。本研究獲得陸軍軍醫大學第一附屬醫院倫理委員會批準(審批號KY201009),受試者均簽署知情同意書。
二、治療方案與療效及不良反應評估指標
1.治療方案:對照組與AWBI組均給予氯雷他定聯合依巴斯汀治療,氯雷他定10 mg每日晨服,依巴斯汀10 mg每晚口服。AWBI組患者同時接受AWBI治療,治療方案參照文獻[3],即將采集的肘正中靜脈血直接臀部深部肌內注射,每周1次,第1次2.5 ml,第2~4次5 ml,第5~8次7.5 ml,第9~12次10 ml,連續12周。
2.療效及不良反應評估:分別在入組時與第12周治療結束時采用UAS7量表與皮膚病生活質量指數(dermatology life quality index,DLQI)量表評估療效[9]。UAS(包含風團與瘙癢兩個指標)范圍0~6分;UAS7為連續7 d的UAS分值的累計值,范圍0~42分,分值與疾病活動程度呈正相關。DLQI量表包含10個問題,每個問題均采用4級計分法,分值越高說明慢性蕁麻疹對患者的日常生活的負面影響越大,生活質量越差。在整個治療期間,監測患者病情并記錄與AWBI治療相關的不良事件。
三、實驗室檢查
1.ASST:按照國外文獻[10]及我科建立的方法[3]進行。常規采集受試者靜脈血2~3 ml置于無菌非抗凝管中,室溫靜置30 min后(400~500)×g離心10 min,取上層血清0.05 ml在前臂屈側皮內注射,同時用10 g/L鹽酸組胺和生理氯化鈉溶液進行皮膚點刺作為陽性和陰性對照。30 min后由專人判讀結果,根據血清與組胺所致風團面積比來判定反應等級。無反應者判為陰性,風團直徑為陽性對照的1/3判為+,2/3判為++,相同判為+++,大于陽性對照判為++++。
2.主要實驗儀器及試劑:FACSCantoII流式細胞儀產自美國BD公司。熒光標記單克隆抗體包括別藻藍蛋白(APC)標記的CD123抗體、異硫氰酸熒光素(FITC)標記的CD63抗體、多甲藻黃素葉綠素蛋白-花青素5.5(Percp-cy5.5)標記的人白細胞抗原DR(HLA-DR)抗體以及分別由熒光素FITC、Percp-cy5.5以及APC標記的同型對照抗體亦均為美國BD公司產品;藻紅蛋白(PE)標記的FcεRⅠα抗體、PE標記的同型對照抗體以及免疫球蛋白Fc受體封閉劑均為美國BioLegend公司產品。甲酰甲硫氨酰-亮氨酰-苯丙氨酸(N-formyl-methionylleucyl-phenylalanine,fMLP)為美國Sigma公司產品。
3.嗜堿性粒細胞表面FcεRⅠα檢測:參考文獻[11]方法,在AWBI治療基線(w0)、4周(w4)、8周(w8)與12周(w12)抽取AWBI組患者(30例)外周靜脈血300 μl至無菌抗凝流式管,平均分為兩組,均加入5 μl Fc受體封閉劑4℃封閉15 min。實驗組加入CD123-APC、HLA-DR-Percp-cy5.5、FcεRⅠα-PE單克隆抗體各5μl,對照組加入CD123-APC、HLA-DR-Percp-cy5.5、PE-同型對照單克隆抗體各5 μl,4℃避光孵育15 min。各組加1×紅細胞裂解液2 ml避光孵育15 min。離心去上清液,PBS洗滌1次,150 μl PBS重懸后上機檢測。采用流式細胞儀對嗜堿性粒細胞及其FcεRⅠα受體劃門(圖1)。各組均收集側向角散射光(side scatter,SSC)低密度CD123陽性HLA-DR陰性的嗜堿性粒細胞500個。嗜堿性粒細胞表面FcεRⅠα受體的表達以平均熒光強度(median fluorescence intensity,MFI)表示。
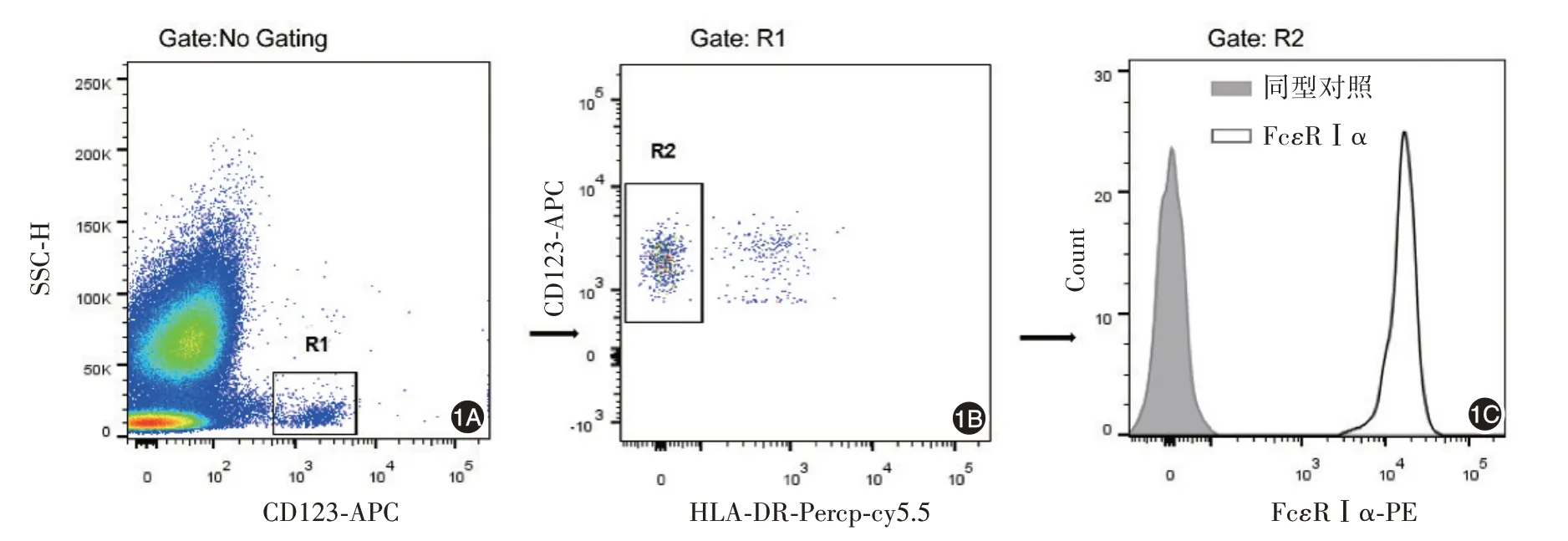
圖1 流式細胞儀對嗜堿性粒細胞及其FcεRⅠ受體的劃門策略1A:選取SSClowCD123+細胞群(R1門);1B:在R1門中選取HLA-DR陰性細胞群(R2門)即為SSClowCD123+HLA-DR-嗜堿性粒細胞;1C:同型對照抗體(左側)或FcεRⅠα抗體(右側)標記的嗜堿性粒細胞直方圖
4.血清誘導的嗜堿性粒細胞CD63活化試驗:參照文獻[12-13],從AWBI組患者中按入組時間順序選擇后30例ASST陽性的CSU患者,在AWBI治療不同時點進行嗜堿性粒細胞活化試驗。實驗前預先收集30例ASST陽性與ASST陰性CSU患者血清(1 ml/例),各自混合后,于56℃滅活30 min制備ASST陽性血清與ASST陰性血清,分裝后凍存于-80℃。實驗分組及干預:在AWBI不同時點(第0、4、8、12周)取AWBI組30例患者外周靜脈血500 μl平均分成5組,A組加入上述滅活的ASST陽性混合血清100 μl,B組加入滅活的ASST陰性混合血清100 μl,C組加入甲酰甲硫氨酰-亮氨酰-苯丙氨酸(10-6mol/ml)作為陽性對照,D組加入PBS 100 μl作為陰性對照,E組不加刺激物。A~D組置于37℃培養箱中溫育15 min后,立即置于碎冰中5 min以終止嗜堿性粒細胞脫顆粒反應,然后均加入CD123-APC、HLA-DRPercp-cy5.5、CD63-FITC熒光抗體各5 μl;E組加入CD123-APC、HLA-DR Percp-cy5.5、FITC-同型對照各5 μl為熒光同型陰性對照組,4℃避光染色15 min。各組加入1×紅細胞裂解液2 ml避光孵育15 min,離心去上清液,PBS洗滌重懸細胞后上機檢測。各組均收集SSClowCD123+HLA-DR-嗜堿性粒細胞500個并記錄CD63表達百分比。
四、統計學方法
采用GraphPad Prism7.00軟件處理實驗數據。根據D′Agostino & Pearson正態性檢驗的結果,計量資料用±s或中位數(四分位數間距或范圍)表示,兩組UAS7和DLQI比較采用t檢驗。兩組FcεRⅠα表達水平比較采用Mann-WhitneyU檢驗,不同時點的兩兩比較采用Wilcoxon′s配對秩和檢驗。采用Spearman相關系數評估指標的相關性。以P<0.05為差異有統計學意義。
結果
一、CSU患者治療前后UAS7、DLQI比較
整個臨床試驗過程中,所有患者均按要求完成治療,無退出及失訪病例。見表1。兩組患者治療前(入組時)UAS7評分、DLQI指數差異均無統計學意義(P>0.05);第12周治療結束時兩組上述指標均顯著低于治療前(均P<0.01),且AWBI組治療后UAS7及DLQI評分顯著低于對照組(均P<0.01)。
表1 自體血清皮膚試驗陽性的難治性慢性自發性蕁麻疹患者治療前后UAS7與DLQI評分比較(±s)
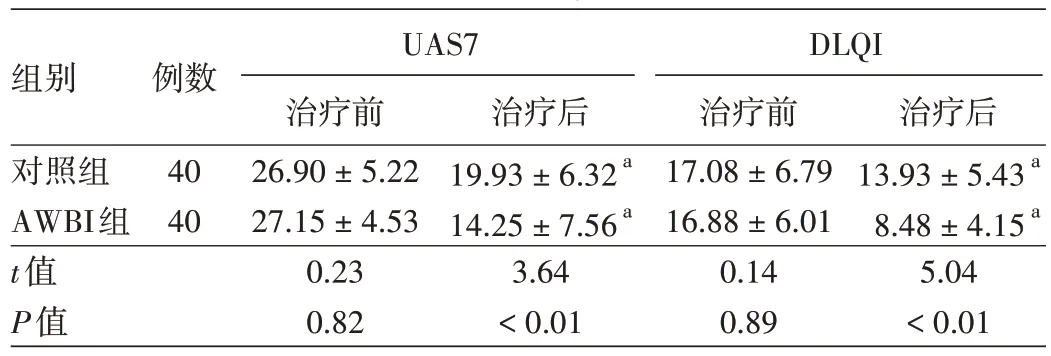
表1 自體血清皮膚試驗陽性的難治性慢性自發性蕁麻疹患者治療前后UAS7與DLQI評分比較(±s)
注:與治療前相比,aP<0.01。UAS7:周蕁麻疹病情活動程度;DLQI:皮膚病生活質量指數;AWBI:自體全血注射
組別對照組AWBI組t值P值例數40 40 UAS7治療前26.90±5.22 27.15±4.53 0.23 0.82治療后19.93±6.32a 14.25±7.56a 3.64<0.01 DLQI治療前17.08±6.79 16.88±6.01 0.14 0.89治療后13.93±5.43a 8.48±4.15a 5.04<0.01
二、AWBI安全性評價
在治療的前6周,注射自體全血后24~48 h內有13例(32.5%)的患者出現輕度的一過性“風團激發”現象,后6周僅有4例出現此現象,患者均可耐受,服用第二代抗組胺藥24 h內消退。整個治療過程中,無患者出現明顯血腫、硬結或過敏性休克。
三、AWBI治療前后嗜堿性粒細胞FcεRⅠ表達水平的變化
ASST陽性CSU患者FcεRⅠα基線值顯著高于健康對照組(U=83,P<0.001),AWBI組治療4周時顯著低于基線水平(W=-447,P<0.001),治療8周時亦顯著低于4周時(W=-325,P<0.001)。見圖2。
四、ABWI治療前后CSU患者嗜堿性粒細胞CD63表達變化
見圖3。ASST陽性血清誘導的CD63表達水平在第4周時較基線顯著降低(W=-263,P<0.01),第8周時亦顯著低于第4周時(W=-319,P<0.001);ASST陰性血清誘導的CD63表達在第4周時亦較基線顯著降低(W=-329,P<0.001),且第8周較第4周亦顯著降低(W=-249,P<0.01)。
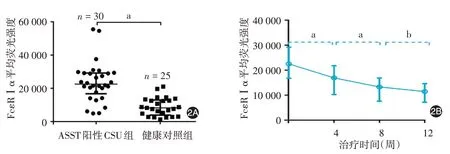
圖2 自體血清皮膚試驗(ASST)陽性慢性自發性蕁麻疹(CSU)患者接受自體全血注射治療前后嗜堿性粒細胞IgE高親和力受體α鏈(FcεRⅠα)的表達2A:健康人和ASST陽性CSU患者治療前嗜堿性粒細胞FcεRⅠα表達的比較;2B:ASST陽性CSU患者FcεRⅠα表達動態變化。a:P<0.001;b:P>0.05
五、AWBI治療前后FcεRⅠα與CD63變化的相關性分析
AWBI治療前至第4周、第4~8周以及第8~12周時FcεRⅠα的變化值(前一時點數值減去后一時點數值的差值)與ASST陽性血清誘導的CD63變化值均呈不同程度正相關,r值分別為0.364、0.422、0.455,P值均<0.05。見圖4。
討論
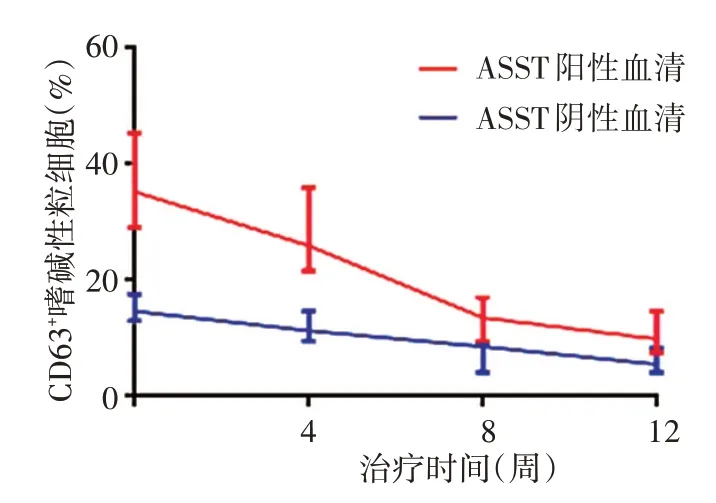
圖3 自體全血注射對自體血清皮膚試驗(ASST)陽性的慢性蕁麻疹(CSU)患者嗜堿性粒細胞CD63表達影響ASST陰性和ASST陽性CSU患者混合血清分別誘導的CD63表達水平均隨治療時間的延長而下降
1986年Grattan首次報道部分慢性蕁麻疹患者進行ASST后可誘導局部出現風團紅斑反應。后續研究發現ASST陽性的CSU患者外周血往往攜帶有可誘導肥大細胞或嗜堿性粒細胞活化的組胺釋放因子,主要包括抗FcεRⅠ或抗IgE功能性IgG型自身抗體[9,14]。一項多中心流行病學調查[1]顯示我國慢性蕁麻疹患者ASST陽性率為66.9%。然而也有研究顯示健康人群同樣可出現ASST陽性反應(甚至高達40%~45%)[15],因此ASST僅可作為篩選慢性蕁麻疹患者是否存在血清組胺釋放因子的非特異性檢測方法。對外周循環中組胺釋放因子釋放活性的定量檢測可采用基于流式細胞術的嗜堿性粒細胞活化試驗,該試驗主要用于檢測CSU患者血清刺激后嗜堿性粒細胞活化標志物(CD63或CD203c)的變化情況,以評估CSU患者的疾病活動程度。雖然有研究報道外周血嗜堿性粒細胞數目與蕁麻疹病情嚴重程度有相關,然而所采用的實驗方法主要為用于基礎研究的流式細胞術而非臨床上常用的血常規,文獻[16]報道采用手工血細胞涂片與血細胞自動分析儀(血常規)兩種方法檢測出的嗜堿性粒細胞數目差異很大而不具有一致性。將來仍需更多的實驗研究來評估血常規嗜堿性粒細胞計數的應用價值,2018版國際蕁麻疹指南不建議將外周血嗜堿性粒細胞計數作為評估蕁麻疹病情的指標[9]。
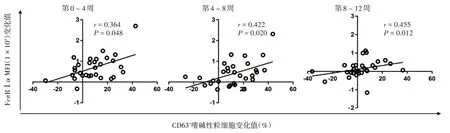
圖4 30例自體血清皮膚試驗(ASST)陽性的難治性慢性自發性蕁麻疹患者自體全血注射治療不同時段IgE高親和力受體α鏈(FcεRⅠα)變化值與ASST陽性血清誘導的CD63嗜堿性粒細胞變化值的相關性分析MFI:平均熒光強度
近十多年來隨著蕁麻疹血清中各種類型的組胺釋放活性因子陸續被鑒定,古老的自血療法重新受到重視,逐漸被各國應用于難治性慢性蕁麻疹的臨床治療中。本研究顯示,40例ASST陽性CSU患者經AWBI治療后UAS7以及DLQI評分顯著降低,與自身治療前以及對照組相比均有統計學差異,該結果與國內外既往研究[3-6,17]一致。也有研究者報道AWBI治療蕁麻疹的臨床療效并不顯著優于安慰劑注射[18]。由于目前缺乏高質量的循證醫學證據,目前學術界對AWBI治療蕁麻疹的有效性仍存在爭議,2018版國際蕁麻疹指南[9]僅把AWBI作為治療CSU“可能有效”的一種替代手段。然而基于其不良反應少、成本低以及技術簡易等優勢,中國、印度等發展中國家的蕁麻疹指南[19-21]指出可考慮選用AWBI治療ASST陽性的難治性慢性蕁麻疹。AWBI治療ASST陽性慢性蕁麻疹的作用機制目前仍未清楚,可能與促進機體對組胺釋放因子發生免疫耐受有關[22]。
10年前有研究顯示,抗IgE抗體可明顯減少人嗜堿性粒細胞FcεRⅠ及其相關通路蛋白表達[23]。本研究證實,ASST陽性CSU患者嗜堿性粒細胞FcεRⅠ表達較健康人群明顯升高,經過AWBI治療4周及8周后FcεRⅠ表達顯著減少。我們課題組之前的研究和國外研究[12,24]證實,CSU患者嗜堿性粒細胞CD63表達較健康人明顯升高,而CD63的高表達與機體處于變應原致敏狀態(變應原皮膚點刺試驗陽性與血清特異性IgE水平升高)、自體血清皮膚反應性(ASST陽性)以及蕁麻疹患者自身嗜堿性粒細胞的高反應性相關。本研究發現,在AWBI治療的不同時點,用同一批ASST陽性或陰性混合血清刺激患者嗜堿性粒細胞后,其CD63表達水平呈明顯下降趨勢,說明經過AWBI治療后嗜堿性粒細胞對富含組胺釋放因子的血清刺激的內在敏感性降低。
我們還發現,CD63表達變化與FcεRⅠ表達的變化基本吻合,AWBI治療不同時段兩者變化值均有明顯相關性。因此推測,AWBI治療對IgE-FcεRⅠ-CD63信號通路以及嗜堿性粒細胞反應性的抑制是AWBI發揮類似減敏作用的機制之一。值得一提的是,我們觀察到在接受AWBI治療后48 h內部分蕁麻疹患者出現一過性“風團激發”現象,推測可能是富含抗FcεRⅠ或IgE自身抗體等組胺釋放因子的自體全血進入患者肌肉組織后,導致局部內環境發生變化,一過性誘導激活肥大細胞或嗜堿性粒細胞大量脫顆粒(CD63過表達)所致,該過程可能同時啟動FcεRⅠ受體內化進程致其大量降解[23,25],從而導致外周循環中嗜堿性粒細胞FcεRⅠ表達明顯減少。
本研究因患者意愿、資金、人力等因素的制約未對對照組嗜堿性粒細胞進行檢測,因此不能完全排除抗組胺藥對FcεRⅠ及CD63表達的影響。然而國外的一項針對奧馬珠單抗的隨機雙盲安慰劑對照臨床試驗[26]證實,單純抗組胺藥(即使在4倍常規劑量下)并不明顯影響難治性CSU嗜堿性粒細胞FcεRⅠ及CD63表達。盡管有理由相信對嗜堿性粒細胞FcεRⅠ及CD63表達的抑制主要是由AWBI所致而非抗組胺藥,還需要進一步研究來驗證。
綜上所述,本研究證實AWBI治療ASST陽性難治性CSU患者安全有效,并發現AWBI治療或許可導致嗜堿性粒細胞FcεRⅠ及CD63表達顯著下降,提示其治療機制可能涉及嗜堿性粒細胞FcεRⅠ介導的相關通路,為深入探討AWBI治療機制奠定了基礎。
利益沖突所有作者均聲明不存在利益沖突

