芹菜素對慢性腎功能衰竭大鼠貧血和電解質代謝紊亂的影響*
楊 杰
(河北北方學院附屬第一醫院藥學部,張家口 075000)
慢性腎功能衰竭(CRF)是各種慢性腎臟疾病持續進展的共同結局,電解質代謝紊亂、內分泌失調、酸堿失衡以及貧血是其早期主要的臨床表現[1-3]。芹菜素(APG)是一種具有廣泛生物學活性的天然存在的黃酮類化合物,在多種水果蔬菜中均含量豐富,王珂等[4]和王強等[5]研究發現黃酮類化合物對CRF大鼠具有一定的保護作用,本實驗將通過復制CRF模型大鼠并腹腔注射給予APG進行治療,通過相關指標檢測并對比正常對照組、模型組實驗數據,探討APG對CRF大鼠貧血和電解質代謝紊亂的影響。
1 材料與方法
1.1 實驗動物 健康無特定病原體(SPF級)雄性SD大鼠(8周齡,220~260 g)購自河北省實驗動物中心[SCXK(冀)2013-1-003]。飼養環境:23~25℃、相對濕度 55%~60%,光照周期 12 h:12 h。
1.2 藥物與試劑 芹菜素(陜西慧科植物開發有限公司,批號:170329);血清鐵(SI)、總鐵結合力(TIBC)測定試劑盒(北京博奧森生物技術有限公司,批號:071128、070916);鐵蛋白(FER)酶聯免疫吸附法(ELISA)測定試劑盒(美國R&D公司,E01627);血尿素氮(BUN)、血肌酐(SCr)、尿素(UA)測定試劑盒(深圳邁瑞生物醫療電子股份有限公司,批號:201711012、201710025、201705023);腺嘌呤(國藥集團化學試劑有限公司)。
1.3 實驗方法
1.3.1 分組、造模與給藥 取100只實驗用大鼠按照隨機數字表法隨機分為正常對照組、模型組、APG低劑量組[10 mg/(kg·d)]、APG中劑量組[20 mg/(kg·d)]、APG高劑量組[40 mg/(kg·d)]組,每組20只。復制CRF大鼠模型[6]:制備25%腺嘌呤溶液,連續灌胃21 d[250 mg/(kg·d)]以制備CRF大鼠模型,造模結局判斷[7]:SCr水平高于正常高值,腎臟組織呈現炎性細胞浸潤、腎間質纖維化等病理性改變,即造模成功。造模完成后,APG各劑量組腹腔注射給藥治療(1次/日),正常對照組和模型組同步腹腔注射給予生理鹽水,療程28 d。
1.3.2 腎功能指標檢測 麻醉后經腹主動脈取血(不做抗凝處理),1 500 r/min離心10 min取血清,通過生化分析儀測定血清中BUN、SCr、UA含量。
1.3.3 腎臟指數的計算 稱量各組大鼠體質量,麻醉后開腹摘取兩側腎臟組織,生理鹽水沖洗干凈后稱量左側腎臟質量,然后進行計算,腎臟指數=左側腎臟質量/體質量。
1.3.4 貧血監測指標 參照1.3.2方法取血,血常規分析儀測定全血紅細胞(RBC)、血紅蛋白(HGB)、紅細胞壓積(HCT);1 500 r/min離心10 min取血清,通過生化分析儀測定各組大鼠血清中SI、TIBC、FER含量。
1.3.5 電解質測定 經腹主動脈取血并分離血清后通過化分析儀測定血清 K+、Na+、Ca2+、P3+含量。
1.3.6 腎臟組織病理學檢查 取右側腎臟組織,置4%多聚甲醛溶液進行固定,72 h后進行石蠟包埋和切片,脫蠟水化處理后行常規HE染色[依次進行乙醇梯度脫蠟、磷酸鹽緩沖液(PBS)洗滌、蘇木素染色5 min、0.5%乙醇鹽酸分色、伊紅染色 20s等步驟],通過光學顯微鏡觀察腎臟組織形態。
1.4 統計學處理 運用軟件SPSS18.0進行數據統計分析,實驗數據采用均數±標準差(±s)方式表示,多組間均數比較采用單因素方法分析,組間兩兩比較采用LSD法,P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠腎功能檢測結果比較 模型組大鼠血清BUN、SCr、UA含量較正常對照組均顯著升高(P<0.01);與模型組比較,APG 中、高劑量組 CRF 大鼠血清經治療28 d后BUN、SCr、UA含量均顯著降低,差異有統計學意義(P<0.05 或 P<0.01)。見表 1。
2.2 各組大鼠體質量和腎臟指數結果比較 模型組大鼠體質量、腎臟指數較正常對照組顯著升高(P<0.01);與模型組比較,APG 高劑量組 CRF大鼠經治療 28 d后體質量升高(P<0.05),APG 中、高劑量組腎臟指數顯著降低(P<0.01)。見表 2。
2.3 各組大鼠貧血監測指標測定結果比較 模型組大鼠 RBC、HGB、HCT、SI、TIBC、FER 較正常對照組均顯著降低(P<0.01);與模型組比較,APG 中、高劑量組 CRF大鼠經治療 28 d后 HGB、HCT、SI、TIBC、FER顯著升高,且高劑量組RBC顯著升高,差異具有統計學意義(P<0.05 或 P<0.01)。見表 3。
2.4 各組大鼠電解質測定結果比較 模型組大鼠血清Ca2+含量較正常對照組顯著降低且K+、Na+、P3+含量顯著升高(P<0.01);與模型組比較,APG 中、高劑量組CRF大鼠經治療28 d后血清Ca2+含量顯著升高(P<0.05),P3+含量顯著降低且高劑量組 K+、Na+含量顯著降低(P<0.05 或 P<0.01)。見表 4。
表1 各組大鼠BUN、SCr、UA測定結果比較(±s)Tab.1 The measurement resultsof BUN,SCr,UA(±s)
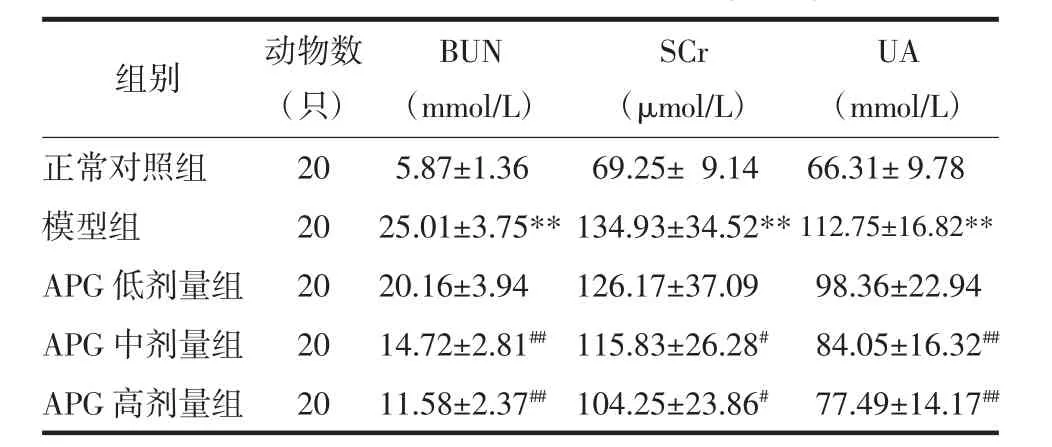
表1 各組大鼠BUN、SCr、UA測定結果比較(±s)Tab.1 The measurement resultsof BUN,SCr,UA(±s)
注:與正常對照組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01。
UA(mmol/L)正常對照組 20 5.87±1.36組別 動物數(只)BUN(mmol/L)69.25± 9.14 66.31± 9.78模型組 20 25.01±3.75**134.93±34.52**112.75±1 126.17±37.09 98.36±2 115.83±26.28# 84.05±1 6.82**APG 低劑量組 20 20.16±3.94 2.94 APG 中劑量組 20 14.72±2.81##6.32##APG 高劑量組 20 11.58±2.37##104.25±23.86# 77.49±14.17##SCr(μmol/L)
表2 各組大鼠體質量、腎臟指數測定結果比較(±s)Tab.2 The measurement resultsof body weight and kidney index(±s)

表2 各組大鼠體質量、腎臟指數測定結果比較(±s)Tab.2 The measurement resultsof body weight and kidney index(±s)
注:與正常對照組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01。
表3 各組大鼠貧血監測指標測定結果比較(±s)Tab.3 The measurement resultsof anemia monitoring index(±s)
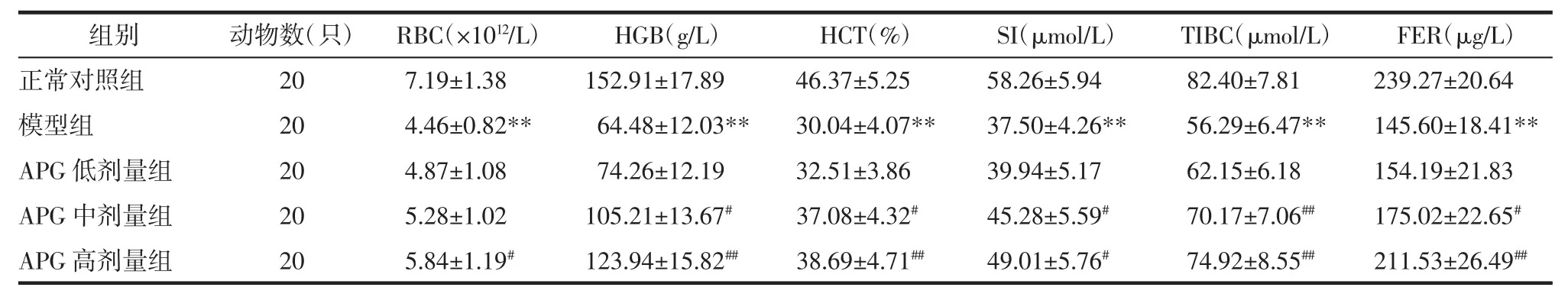
表3 各組大鼠貧血監測指標測定結果比較(±s)Tab.3 The measurement resultsof anemia monitoring index(±s)
注:與正常對照組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01。
?
2.5 各組大鼠腎臟組織病理學檢查結果 正常對照組大鼠腎臟組織結構和細胞形態均未見異常;與正常對照組比較,模型組大鼠腎臟組織呈現明顯的病理性改變,主要表現為腎小球數量減少、球囊粘連、囊腔擴大、腎小管壞死、大量炎癥細胞和出現、中性粒細胞浸潤等;較模型組,經APG中、高劑量組治療28 d后CRF大鼠腎臟組織病變明顯改善,改善效果以高劑量組最為顯著。見圖1。
表4 各組大鼠電解質指標測定結果比較(±s)Tab.4 The measurement resultsof electrolyte index(±s)

表4 各組大鼠電解質指標測定結果比較(±s)Tab.4 The measurement resultsof electrolyte index(±s)
注:與正常對照組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01。
(mmol/L)正常對照組 20 4.79±0.46 140.62±1.46 2.38±0.31 1.57±0.11模型組 20 6.05±0.72**143.24±1.79**1.56±0.19**2.24±0.18**APG 低劑量組 20 5.86±0.97 142.93±2.08 1.72±0.15 2.09±0.35 APG 中劑量組 20 5.37±0.85# 142.05±1.63# 1.99±0.42# 1.91±0.27#APG 高劑量組 20 5.18±0.69##139.98±1.52# 2.02±0.29# 1.68±0.19##組別 動物數(只)K+P3+(mmol/L)Na+(mmol/L)Ca2+(mmol/L)
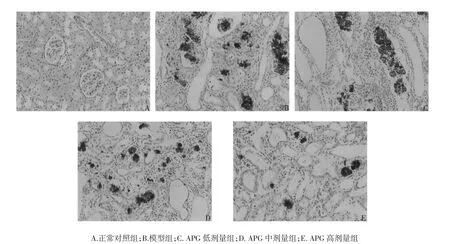
圖1 腎臟組織病理學檢查結果(HE,×400)Fig.1 The histopathological examination resultsof renal tissue(HE,×400)
3 討論
流行病學調查發現CRF發病率達568/100萬,具有不可逆及持續進展的特點,是主要致死原因之一[8],是臨床上亟待解決的醫學難題之一。高濃度腺嘌呤持續攝入是常用的CRF大鼠模型造模方法[7],該方法制作的CRF大鼠模型異常新陳代謝與人類CRF臨床表現及病理改變相似[9];該制作方法的機制主要與腺嘌呤代謝形成極難溶于水的2,8-二羥基腺嘌呤,沉積于腎小管并堵塞腎小管腔,影響氮質化合物的排泄,導致氮質血癥、毒素蓄積、電解質代謝紊亂而最終引起腎功能衰竭[10],此外還可能與2,8-二羥基腺嘌呤阻塞腎小管而引發腎臟組織炎癥反應和氧化應激有關[11]。腎功能指標(BUN、SCr、UA)異常、電解質(P3+、K+、Na+、Ca2+)代謝紊亂、貧血以及腎臟組織病變是CRF的主要臨床表現[12]。本實驗結果顯示,模型組大鼠血清BUN、SCr、UA顯著升高,Ca2+含量顯著降低且 K+、Na+、P3+含量顯著升高,貧血監測指標明顯異常,腎臟組織病理性改變,提示造模成功。
本實驗采用腺嘌呤連續灌胃21 d的方法復制CRF模型大鼠,腹腔注射給予APG進行干預治療,實驗結果顯示,經APG 20~40 mg/(kg·d)治療28 d能夠有效改善CRF大鼠腎功能(降低血清BUN、SCr、UA含量),降低腎臟指數,抑制腎臟組織形態和細胞結構病變,提示APG對CRF大鼠腎臟組織損傷具有抑制作用。
腎性貧血主要表現為RBC數量降低,HGB、HCT 降低,SI、TIBC、FER 含量降低[13-14]。SI是 HGB合成的必需元素[15],貧血的發生與HGB合成受阻密切相關,因此HGB水平是評價人體是否貧血的重要指標[16]。本實驗結果顯示,經APG 20~40 mg/(kg·d)治療28 d能夠有效提高CRF大鼠全血RBC、HGB、HCT水平和血清中SI、TIBC、FER含量,提示APG具有抑制CRF大鼠貧血癥狀的作用。
電解質代謝紊亂也是CRF患者常見并發癥之一,其中鈣磷代謝紊亂最常見并形成低鈣高磷血癥[17],此外電解質代謝紊亂還可誘發繼發性甲狀旁腺功能亢進、血管鈣化等[18]。本實驗結果顯示,經APG 20~40 mg/(kg·d)治療28 d能夠升高CRF大鼠血清Ca2+水平并降低 P3+、K+、Na+水平,說明 APG 具有抑制CRF大鼠電解質代謝紊亂的作用。
綜上所述,APG具有改善CRF大鼠貧血、電解質紊亂的藥理學作用,可能是APG對CRF能夠起到一定保護作用的機制之一。

