微小核糖核酸-34a調節高遷移率族蛋白B1對卵巢癌細胞增殖的影響
王艷紅,段瑞麗
(1.鄭州市婦幼保健院婦產科,河南 鄭州 450012;2.中國人民解放軍信息工程大學門診部,河南 鄭州 450002)
卵巢癌是女性婦科惡性腫瘤中最常見的死亡原因,也是女性死亡率最高的原因。由于缺乏對卵巢癌早期癥狀特異和敏感的監測指標,大多數患者發現時已被診斷為晚期卵巢癌,其5 a生存率通常為30%[1-2]。卵巢癌治療的標準方案為手術和放、化療聯合方案。盡管近年來隨著治療手段的進步,卵巢癌患者的生存時間有所延長,但大多數卵巢癌患者卻依舊容易復發[3]。因此,找到合適的能夠早期檢測出卵巢癌的指標可能是改善卵巢癌患者治療效果的關鍵。
微小核糖核酸(micro ribonucleic acids,miRNAs)是一類內源性非編碼單鏈小分子RNA,長度一般約為22個核苷酸,可通過調控mRNA在生物活動中發揮重要作用[4]。miR-34a是新近發現的一種重要的腫瘤相關miRNA,在多種腫瘤組織中低表達,與腫瘤細胞的增殖、凋亡、侵襲、遷移等均有關[5-6]。通過靶向預測和文獻查閱發現miR-34a可靶向結合高遷移率族蛋白B1(high mobility group box 1,HMGB1)的3’-非翻譯區(untranslated region,UTR)。HMGB1是一種高度保守的脫氧核糖核酸(deoxyribonucleic acid,DNA)連接蛋白,在卵巢癌及其他多種惡性腫瘤組織中高表達,其高表達與惡性腫瘤的凋亡、炎癥、侵襲、轉移密切相關[7-10]。有研究[11]發現,在視網膜母細胞瘤中miR-34a可以通過靶向抑制HMGB1的表達影響細胞的功能,但miR-34a是否可以通過調控HMGB1的表達影響卵巢癌SKOV-3細胞的增殖功能還尚待研究。本研究以SKOV-3細胞作為研究對象,探討miR-34a是否可以通過抑制HMGB1的表達促進SKOV-3細胞增殖功能,從而為深入研究卵巢癌的發病機制提供實驗數據。
1 材料與方法
1.1 細胞株和主要試劑卵巢癌細胞株SKOV-3購自中國科學院上海生命研究所;RPMI-1640培養基購自北京索萊寶公司;胎牛血清購自杭州四季青公司;轉染試劑Lipofectamine 2000購自美國Invitrogen公司;qRT-PCR試劑盒和SYBR Green熒光染料試劑盒購自日本Toyobo公司,兔抗人HMGB1單克隆抗體和兔抗人β-actin單克隆抗體購自美國Abcam公司;細胞增殖毒性檢測試劑盒(CCK-8)購自日本同仁研究所;空白對照、miR-34a模擬物對照、miR-34a模擬物、miR-34a抑制劑對照、miR-34a抑制劑均由廣州銳博生物公司合成。
1.2 細胞培養SKOV-3細胞培養于RPMI-1640完全培養基(含有體積分數10%胎牛血清)中,并置于37 ℃、體積分數5% CO2培養箱中培養,待細胞融合度達到約80%時進行傳代,或用于后續實驗。
1.3 細胞轉染實驗將對數期生長的SKOV-3細胞接種到6孔板中,每孔2.5×105個細胞。當細胞融合度達到約80%時進行轉染實驗。轉染實驗嚴格按照Lipofectamine 2000試劑說明書進行,根據轉染的目的基因進行分組:空白對照組、miR-34a模擬物對照組、miR-34a模擬物組、miR-34a抑制劑對照組、miR-34a抑制劑組。
1.4 CCK8法將對數生長期的SKOV-3細胞按6×103個/孔接種到96孔板中,分別于轉染24 h、48 h和72 h后在每孔中加入10 μL的CCK8溶液,置于培養箱中孵育1~4 h,使用酶標儀測定490 nm處的光密度(OD)值,并計算細胞增殖率。細胞增殖率(%)=(實驗組OD值/對照組OD值)×100%。每組設6個平行復孔。
1.5 qRT-PCR法按照Trizol法提取轉染24 h后各組細胞的總RNA,并嚴格按照逆轉錄試劑盒進行逆轉錄,按照SYBR Green熒光染料試劑盒進行擴增。引物序列為(5’-3’):miR-34a-F: ATTGCGGTGGCAGTGTCTTAGCT,miR-34a-R: ATCCAGTGCAGGGTCCGAGG,HMGB1-F:ACAAGGCCCGTTATGAAAGA,HMGB1-R: GAAGAGGAAGAAGGCCGAAG。miR-34a和HMGB1的內參分別采用U6和β-actin,實驗結果以2-△△Ct法計算目的基因的相對表達量。
1.6 Western blot法按照RIPA蛋白裂解緩沖液使用說明提取各組總蛋白,并用二喹啉甲酸(BCA)定量法測定蛋白的濃度。每孔取20 μg總蛋白進行電泳;用濕轉法將蛋白轉移到硝酸纖維素(nitrocellulose filter membrane,NC)膜上;體積分數5%脫脂牛奶封閉2 h,然后分別加入稀釋好的HMGB1和β-actin單克隆抗體,4 ℃孵育過夜;最后加入二抗孵育2 h。用高敏感性化學發光顯色并分析條帶,條帶以灰度值表示,采用Image J軟件進行分析。HMGB1的相對表達量以HMGB1與β-actin的灰度值比值表示。
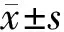
2 結果
2.1 SKOV-3細胞miR-34a的轉染效率qRT-PCR結果顯示,miR-34a模擬物組(3.57±0.31)的miR-34a相對表達量明顯高于miR-34a模擬物對照組(1.17±0.24,P<0.05),miR-34a抑制劑組(0.32±0.03)的miR-34a相對表達量明顯低于miR-34a抑制劑對照組(1.08±0.13,P<0.05),提示可進行下一步實驗。
2.2 MiR-34a對SKOV-3細胞增殖的影響CCK8結果顯示,作用24 h、48 h、72 h后,miR-34a模擬物組與空白對照組和miR-34a模擬物對照組比較,SKOV-3細胞的增殖率顯著降低(P均<0.05),miR-34a模擬物對照組與空白對照組細胞增殖率比較差異無統計學意義(P>0.05)。作用24 h、48 h、72 h后,miR-34a抑制劑組與空白對照組和miR-34a抑制劑對照組比較,SKOV-3細胞的增殖率顯著升高(P均<0.05),miR-34a抑制劑組與空白對照組細胞增殖率比較差異無統計學意義(P>0.05)。見圖1。

圖1 MiR-34a對SKOV-3細胞增殖的影響
2.3 MiR-34a對SKOV-3細胞HMGB1 mRNA和蛋白的影響與空白對照組(1.00,0.89±0.07)和miR-34a模擬物對照組(0.91±0.05,0.81±0.06)比較,miR-34a模擬物組(0.40±0.11,0.36±0.03)HMGB1 mRNA和蛋白的表達水平均明顯降低(P均<0.05)。與空白對照組(1.00,0.81±0.09)和miR-34a抑制劑對照組(1.07±0.08,0.61±0.08)比較,miR-34a抑制劑組(1.63±0.10,1.76±0.07)中HMGB1 mRNA和蛋白的表達水平均顯著升高(P均<0.05)。見圖2、3。
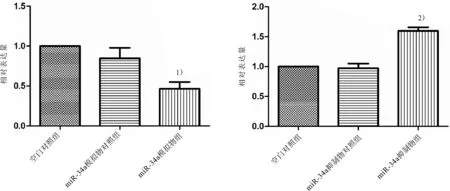
圖2 MiR-34a對SKOV-3細胞中HMGB1 mRNA的影響
圖3 MiR-34a對SKOV-3細胞中HMGB1蛋白的影響
3 討論
卵巢癌是女性最常見的惡性腫瘤之一,隨著國家工農業的發展所導致的環境污染加重和人類壽命的延長,卵巢癌的發病率呈逐年上升的趨勢。在臨床上,卵巢癌首選手術切除治療,并輔助放療和化療等綜合治療。由于卵巢癌發現時已處于晚期,術后的復發率仍然很高,且惡性程度也會提高。因此,現在臨床急需能早期發現卵巢癌的檢測方法和有較好治療效果的治療方法。
MiRNAs的異常表達與人類的多種疾病密切相關,包括惡性腫瘤、炎癥和心血管疾病等[12-14]。miR-34a是腫瘤抑制基因,其在神經母細胞瘤、膀胱癌和子宮內膜癌等疾病中發揮作用[11,15]。 雖然林蘭等[5]研究發現,miRNA-34a可以通過抑制其靶基因AXL影響卵巢癌SKOV-3細胞的多種生物學過程,但miR-34a對卵巢癌發病機制的具體影響仍需要進一步研究。本研究發現,過表達miR-34a可抑制SKOV-3細胞增殖,抑制miR-34a可促進SKOV-3細胞增殖。MiRNAs往往通過調控其下游基因發揮作用,本研究通過靶基因預測網站發現HMGB1是miR-34a的靶基因之一,并且已在神經母細胞瘤中得到了驗證[11]。HMGB1是一種重要的核蛋白,其主要功能是穩定染色質結構和功能,并調控基因轉錄[16]。目前,HMGB1在腫瘤治療中的作用越來越重要,其能夠調控腫瘤免疫功能并影響放、化療效果,進而最終影響腫瘤的發生、發展[17-19]。但是,miRNA-34a是否通過調節HMGB1的表達來抑制SKOV-3細胞增殖功能,尚未見文獻報道。本研究還發現,miR-34a可抑制HMGB1 mRNA及其蛋白在SKOV-3細胞中的表達。因此,miR-34a可能通過靶向抑制HMGB1的表達來影響SKOV-3細胞的增殖能力。
綜上所述,本研究從細胞水平闡明miR-34a和HMGB1可能參與了卵巢癌的發病,分子機制是miR-34a可能通過靶向抑制HMGB1的表達抑制卵巢癌細胞的增殖,影響卵巢癌細胞的生物學特性,進而促進卵巢癌的發生、發展,這也為臨床卵巢癌的治療提供了一個可行的研究思路。

