LncRNA HOTAIR在腫瘤中轉錄調控及作用機制的研究進展
馬旭蘭,代蔭梅
(首都醫科大學附屬北京婦產醫院婦科,北京 100026)
在人類基因組中,穩定轉錄的蛋白質編碼基因比例僅占2%,高達90%的真核基因組中DNA轉錄產物均為非編碼RNA[1]。非編碼RNA包括短鏈非編碼RNA(長度為20~50個核苷酸,如微RNA、小干擾RNA等),中等鏈非編碼RNA(長度為50~200個核苷酸,如核小RNA、核仁小RNA等)和長鏈非編碼RNA(long non-coding RNAs,lncRNAs)[長度為200~100 000個核苷酸,如同源異型盒基因轉錄反義基因間RNA(HOX transeript antisense intergenitic RNA,HOTAIR)、肺腺癌轉移相關轉錄本1等][2]。其中,lncRNAs可在不同層面廣泛參與基因組的調控過程,如表觀遺傳學、轉錄水平及轉錄后水平等[3]。HOTAIR是第一個被發現的反義轉錄lncRNAs,長為2.2 kb,定位于第12號染色體的HOXD基因座,由Rinn等[4]在人成纖維細胞中發現,是目前探究的熱點lncRNAs之一。有研究證實,HOTAIR在乳腺癌、子宮內膜癌、結直腸癌、宮頸癌等多種腫瘤中高表達,并均可促進腫瘤的增殖、侵襲、轉移、復發和耐藥等惡性生物學行為的進展[5-8]。現對HOTAIR在腫瘤中轉錄調控及作用機制的研究進展予以綜述。
1 HOTAIR的轉錄調控機制
HOTAIR的轉錄調控機制異常復雜,受許多因素調控,但目前各因素在不同腫瘤中的研究較少,有待進一步研究。Bhan等[5]研究發現,HOTAIR轉錄受雌激素正向調控,應用17β-雌二醇刺激雌激素受體陽性的人乳腺癌MCF7細胞后發現,HOTAIR被誘導轉錄,且在暴露于雌激素受體抑制劑他莫昔芬后轉錄水平受到抑制。研究表明,HOTAIR轉錄由核受體共抑制因子維持在基礎狀態,暴露于雌激素時,雌激素通過雌激素-雌激素受體-雌激素受體反應元件途徑與多種雌激素受體共調節因子共同結合在HOTAIR啟動子上,解除核受體共抑制因子對HOTAIR的轉錄抑制,誘導HOTAIR轉錄[5,9]。此外,在子宮內膜癌[10]、前列腺癌[11]等腫瘤中,雌激素誘導HOTAIR轉錄水平上調也得到了證實。Bhan等[12]進一步實驗發現,雌激素內分泌干擾物雙酚A和己烯雌酚也可發揮類雌激素作用,誘導HOTAIR轉錄水平上調。
原癌基因c-Myc也是影響HOTAIR轉錄的因素。Ma等[13]對膽囊癌組織和細胞的研究發現,HOTAIR是c-Myc的直接作用靶點,c-Myc正向調控HOTAIR的表達。具體作用機制為c-Myc通過識別并作用于HOTAIR上游區域的假定E-box元素(c-Myc靶標反應元件),導致HOTAIR表達上調,敲減c-Myc可降低HOTAIR的表達及其啟動子活性,上調c-Myc則可增加HOTAIR表達及其啟動子活性。此外,Li等[14]對乳腺癌的研究證實,HOTAIR是c-Myc激活其靶基因轉錄的關鍵效應因子。轉化生長因子-β1也可刺激HOTAIR轉錄上調。Ren等[15]研究發現,癌相關成纖維細胞通過分泌轉化生長因子-β1激活HOTAIR轉錄,促進乳腺癌細胞的轉移,表明轉化生長因子-β1表達增加可顯著增強HOTAIR表達,而轉化生長因子-β1抑制劑減弱HOTAI活化,由此可見,轉化生長因子-β1/HOTAIR軸有望成為乳腺癌治療的靶標。
Yang等[16]對多種癌細胞系進行實驗研究發現,重組人骨橋蛋白可以時間和劑量依賴方式誘導HOTAIR轉錄,而骨橋蛋白可以下調重組人干擾素調節因子1的表達,并通過染色質免疫沉淀和熒光素酶活性測定實驗發現,干擾素調節因子1可以與HOTAIR啟動子區域結合并降低其轉錄活性,且細胞過度表達的干擾素調節因子1可下調HOTAIR的表達。可見,骨橋蛋白作為細胞外基質蛋白可以通過減弱干擾素調節因子1的抑制作用來刺激HOTAIR轉錄,從而促進癌細胞的侵襲和轉移。此外,信號轉導及轉錄激活因子3信號通路也可調控HOTAIR的轉錄。Sun等[17]對頭頸部鱗狀細胞癌細胞的體內外實驗研究發現,HOTAIR和組蛋白甲基轉移酶zeste基因增強子同源物2(enhancer of zeste homolog 2,EZH2)是頭頸部鱗狀細胞癌中信號轉導及轉錄激活因子3信號轉導的下游效應分子,信號轉導及轉錄激活因子3可通過與HOTAIR編碼基因的啟動子結合上調HOTAIR轉錄,從而增強EZH2介導的表觀遺傳沉默,表明信號轉導及轉錄激活因子3/HOTAIR信號軸以依賴EZH2的方式調控頭頸部鱗狀細胞癌生長,為靶向信號轉導及轉錄激活因子3/HOTAIR/EZH2信號轉導治療頭頸部鱗狀細胞癌提供了理論基礎。
2 HOTAIR的作用機制
2.1HOTAIR通過與多梳蛋白抑制復合體2(polycomb repressive complex 2,PRC2)和賴氨酸特異性組蛋白去甲基化酶1結合發揮作用 LncRNA HOTAIR最經典的作用機制是發揮lncRNAs支架分子的功能,招募并結合PRC2和賴氨酸特異性組蛋白去甲基化酶1復合體,形成組蛋白修飾復合物,定位至特定的HOX基因位點,使該位點發生表觀遺傳學沉默,促進腫瘤惡性生物學行為的進展。其中,HOTAIR的3′端結構域招募賴氨酸特異性組蛋白去甲基化酶1復合體,發揮去除染色體組蛋白H3第4位賴氨酸二甲基化狀態(即去甲基化)的作用,通過調控靶基因表達發揮促癌作用。而PRC2復合體與其5′端結構域結合,具有組蛋白甲基化轉移酶活性,其核心成分主要由EZH2、EED、SUZ12亞基構成,通過介導染色體組蛋白H3第27位賴氨酸三甲基化導致一系列細胞生長所必需基因的沉默[18-19]。Betancur和Tomari[20]對細胞中純化出的PRC2的各個組分的研究發現,EED負責調節EZH2、SUZ12的RNA結合活性,是PRC2的伴侶蛋白,而EZH2和SUZ12可以直接與RNA結合,其中EZH2是發揮主要作用的亞基。EZH2的失調與多種腫瘤的表觀遺傳畸變都存在聯系。多項研究表明,HOTAIR通過與EZH2結合在多種腫瘤中發揮促癌作用[21-24]。Gonzalez等[25]的研究證明,在轉錄激活因子中,EZH2還具有PRC2非依賴性功能,也可單獨發揮作用。
2.2HOTAIR作為競爭性內源RNA發揮作用 競爭性內源RNA是在轉錄后水平相互調控的一類RNA的總稱,具有相同的微RNA(microRNA,miRNA)應答元件,可通過該應答元件競爭同一種miRNA,從而實現自身間的相互作用及參與靶基因的表達調控[26]。多項研究表明,lncRNA HOTAIR可作為競爭性內源RNA,通過“海綿效應”招募并結合miRNA抑制其表達,從而促進腫瘤的發生與發展(表1)[10,23,27-35]。以上發現有助于對腫瘤發生與發展機制的理解,并為治療該腫瘤提供新的研究方向和治療靶點。
2.3HOTAIR通過激活信號通路發揮作用 HOTAIR可通過調節Wnt/β聯蛋白信號通路的活性來調控腫瘤的進展。Guo等[36]納入北京協和醫院病理科標本庫中48例接受順鉑作為新輔助化療的非小細胞肺癌患者的組織進行研究發現,HOTAIR通過調節Wnt信號通路對非小細胞肺癌順鉑耐藥發揮重要作用,可能是影響非小細胞肺癌患者臨床預后的重要因素。Cheng等[37]經過一系列實驗發現,敲減HOTAIR可上調miR-34a抑制磷脂酰肌醇-3-激酶/蛋白激酶B和Wnt/β聯蛋白信號通路,從而抑制胃癌細胞對順鉑的耐藥性。Xiao等[30]的研究發現,HOTAIR可通過調節miR-203a-3p的表達水平及Wnt/β聯蛋白信號通路的活性調節結直腸癌的進展和化學耐藥性。
此外,HOTAIR還通過其他信號通路發揮作用。Yu等[38]研究表明,HOTAIR可通過調節p53/蛋白激酶B/c-Jun氨基端激酶信號通路調節乳腺癌細胞的增殖、凋亡、遷移和侵襲。Liu等[39]研究顯示,慢病毒介導的HOTAIR沉默通過激活凋亡相關基因Bax/胱天蛋白酶3抑制肺腺癌中的轉化生長因子-α/表皮生長因子受體信號轉導通路,從而恢復腫瘤細胞對吉非替尼的敏感性。
2.4HOTAIR通過上皮-間質轉化途徑發揮作用 HOTAIR可通過參與上皮-間質轉化途徑調控腫瘤的發生。Dasgupta等[40]研究發現,miR-203可抑制HOTAIR表達,并通過上皮-間質轉化途徑調節腎細胞癌的發生。Lu等[41]研究顯示,在口腔鱗狀細胞癌中,HOTAIR過度表達增強了癌細胞的轉移潛能和上皮-間質轉化特征,還發現HOTAIR的表達與間充質標記呈正相關,與臨床樣本中的上皮標記呈負相關。此外,Kaplan-Meier生存分析表明,高水平的HOTAIR是口腔鱗狀細胞癌患者生存率低的強預測因子。綜上所述,HOTAIR介導的癌癥干性(具有能夠自我更新和分化的干細胞特性)和轉移與上皮-間質轉化的調節相關。
轉錄因子Snail是細胞特性和上皮-間質轉化的主要調節因子,直接抑制廣泛的上皮基因庫。Battistelli等[24]研究顯示,HOTAIR介導Snail和EZH2的增強子之間的相互作用,將EZH2募集到特定的基因組位點。Snail活性抑制取決于Snail/HOTAIR/EZH2HOTAIR:同源異型盒基因轉錄反義基因間RNA;miRNA:微RNA;NPM1:核仁磷酸蛋白1;notch3:notch3信號通路;Ki67:細胞核增殖抗原;PCNA:增殖細胞核抗原;Wnt/β-catenin:Wnt/β聯蛋白;BCL2:B淋巴細胞瘤2基因;NRP2:神經纖毛蛋白質2;GPC5:磷脂酰肌醇蛋白聚糖家族成員5;PTPN14:蛋白酪氨酸磷酸酶14;GLS:谷氨酰胺酶三聯復合物的形成。以上結果證明,HOTAIR在Snail介導的上皮-間質轉化中起關鍵作用。
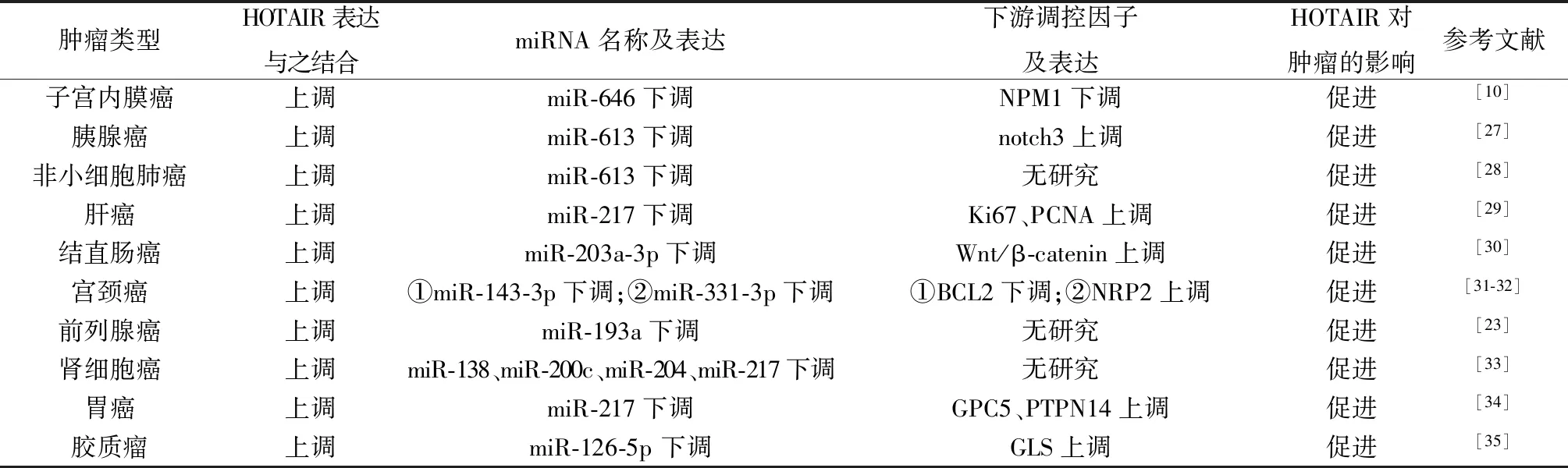
表1 HOTAIR在腫瘤中作為競爭性內源RNA發揮作用的機制
2.5HOTAIR促進蛋白質泛素化 HOTAIR還可通過促進蛋白質泛素化來調控腫瘤的發展。Yoon等[42]對人HeLa細胞、人成纖維細胞IDH4和WI-38以及小鼠胚胎成纖維細胞的實驗研究顯示,HOTAIR可作為蛋白質泛素化的平臺,幫助組裝E3泛素連接酶與其各自底物相結合,促進該復合物泛素化,并加速其降解。Mex3b和Dzip3為E3泛素連接酶,具有與HOTAIR結合的特定RNA結合域。其中,Mex3b存在于細胞核和細胞質中,相應的泛素化底物為Snurportin-1蛋白。而Dzip3只存在于細胞質的囊泡中,可促進Ataxin-1蛋白的泛素化。Xue等[43]應用RNA-蛋白質相互作用預測軟件篩選可能與Runt相關轉錄因子3(Runt-related transcription factor 3,Runx3)(一種在胃癌中發揮抑癌作用的重要轉錄因子)結合的lncRNAs發現,HOTAIR與Runx3蛋白結合并鑒定HOTAIR的相關片段后,通過RNA免疫沉淀和RNA敲減實驗驗證了HOTAIR與Runx3之間的相互作用,通過免疫共沉淀評估E3泛素連接酶Mex3b和Dzip3在HOTAIR誘導的Runx3泛素化中的作用,利用Pearson相關性分析HOTAIR信使RNA表達與Runx3蛋白表達之間的相關性,結果發現,Mex3b可作為E3泛素連接酶參與HOTAIR誘導的Runx3普遍降解過程,沉默HOTAIR或Mex3b的表達減弱Runx3的降解。由此可見,HOTAIR與Mex3b相互作用可誘導Runx3蛋白的泛素化,增強胃癌細胞的侵襲能力,并為胃癌的轉移提供潛在的治療靶點。目前,關于HOTAIR促進蛋白質泛素化的相關研究較少,HOTAIR在不同腫瘤中參與不同蛋白質的泛素化過程仍存在很大的研究潛力和意義,有待進一步研究。
2.6HOTAIR調控自噬的發生 自噬也稱為細胞的“自我消化”,是一種高度保守的生物學行為,有助于維持細胞新陳代謝的穩定,不僅在正常細胞中發揮作用,還在腫瘤細胞適應缺氧、耐受外界刺激和誘導腫瘤化療耐藥性中發揮重要作用,已成為近年來研究的焦點[44]。Wang等[44]利用小干擾RNA干擾口腔鱗狀細胞癌細胞中HOTAIR的表達,并通過透射電鏡、Western blotting法及流式細胞術檢測細胞的自噬及凋亡,評估HOTAIR對中位致死劑量順鉑敏感性影響的研究表明,HOTAIR在口腔鱗狀細胞癌細胞中作為致癌基因可加速細胞自噬作用,減少細胞凋亡,并增加口腔鱗狀細胞癌對順鉑的耐藥性。Yu等[45]研究發現,卵巢癌細胞中沉默HOTAIR可抑制自噬相關基因7和微管相關蛋白1輕鏈3Ⅱ/Ⅰ的表達,從而抑制自噬過程,而自噬相關基因7和微管相關蛋白1輕鏈3Ⅱ/Ⅰ的表達水平可隨順鉑濃度的增加而增加,下調自噬相關基因7可抑制順鉑誘導的自噬,隨后下調HOTAIR表達聯合順鉑刺激后發現,卵巢癌細胞增殖和自噬水平受到抑制,抗凋亡蛋白Bcl-2的表達下降,而促凋亡蛋白Bax表達升高,細胞凋亡增加,可見下調HOTAIR的表達可通過抑制順鉑誘導的自噬提高順鉑對卵巢癌的敏感性,從而提高順鉑治療卵巢癌的效果。此外,HOTAIR可促進自噬的發生,導致非小細胞肺癌[46]、子宮內膜癌[47]、乳腺癌[48]、軟骨肉瘤[49]、肝細胞癌[50]等腫瘤細胞對化療藥物耐藥性增加。
3 小 結
近年來,有關lncRNA HOTAIR的研究不僅局限于HOTAIR對多種腫瘤組織和細胞的表達水平以及對腫瘤細胞增殖、凋亡、侵襲和遷移的影響,還深入研究了HOTAIR在不同腫瘤中的具體轉錄調控及作用機制等,取得了顯著的成果。但還有待對整個HOTAIR復雜的調控機制進行深入研究,尤其是一些相對冷門的腫瘤中HOTAIR作用機制的研究。因此,進一步闡明HOTAIR在不同腫瘤中的具體作用機制是實現腫瘤精準治療的理論基礎。
目前,尚未將HOTAIR具體作用機制的研究成果應用于臨床。開發通過血液、尿液或其他體液等檢測HOTAIR表達水平的試劑盒等,可實現多種腫瘤的早發現、早診斷、早治療以及準確評估預后等,還可將能夠敲低HOTAIR或影響其發揮作用的上下游分子制成靶向藥物應用于臨床,下調HOTAIR水平,從而治療腫瘤和解決化療耐藥性等。隨著HOTAIR的相關研究思路、方法、技術等的不斷更新與完善,積極開發HOTAIR的臨床應用潛力,將使其成為判定惡性腫瘤發生和預后的生物標志物以及治療惡性腫瘤的新靶點。

