食管鱗狀細胞癌中單羧酸轉運蛋白4的表達及對EC109細胞增殖、遷移和侵襲能力的影響
劉耀河,秦 寧,楊 瑜,宋 銳,侯 歌,王 成,郭振江,梁 冰,張 艷,劉宗文
1)鄭州大學第二附屬醫(yī)院放射治療科 鄭州 450014 2)鄭州大學第二附屬醫(yī)學腫瘤內科 鄭州 450014 3)鄭州大學基礎醫(yī)學院藥理學教研室 鄭州 450001
食管癌是我國常見的消化道腫瘤,其中超過90%的病理類型都是鱗狀細胞癌(以下簡稱鱗癌)[1-2]。癌細胞的代謝模式是在氧氣充足的條件下以糖酵解為主并獲取能量,稱為 Warburg效應,且這一代謝模式的改變會產(chǎn)生大量的乳酸。單羧酸轉運蛋白4(monocarboxylate transporter 4, MCT4)是單羧酸轉運蛋白家族中的一員,它的主要功能是將胞內的乳酸轉運到胞外,這不僅可以維持胞外低酸的微環(huán)境,還可以讓胞內糖酵解順利進行[3-4]。作為乳酸轉運的主要參與者,MCT4在食管腺癌和胃癌等多種腫瘤中高表達,且影響預后[5-6]。有研究[7-8]發(fā)現(xiàn),下調MCT4的表達以減少乳酸的外排,可以顯著減弱結直腸癌和宮頸癌細胞的惡性生物學行為。本實驗分析了食管鱗癌細胞和組織中MCT4的表達,觀察下調MCT4表達對食管鱗癌EC109細胞增殖、遷移和侵襲能力的影響。
1 材料與方法
1.1細胞、組織及主要試劑
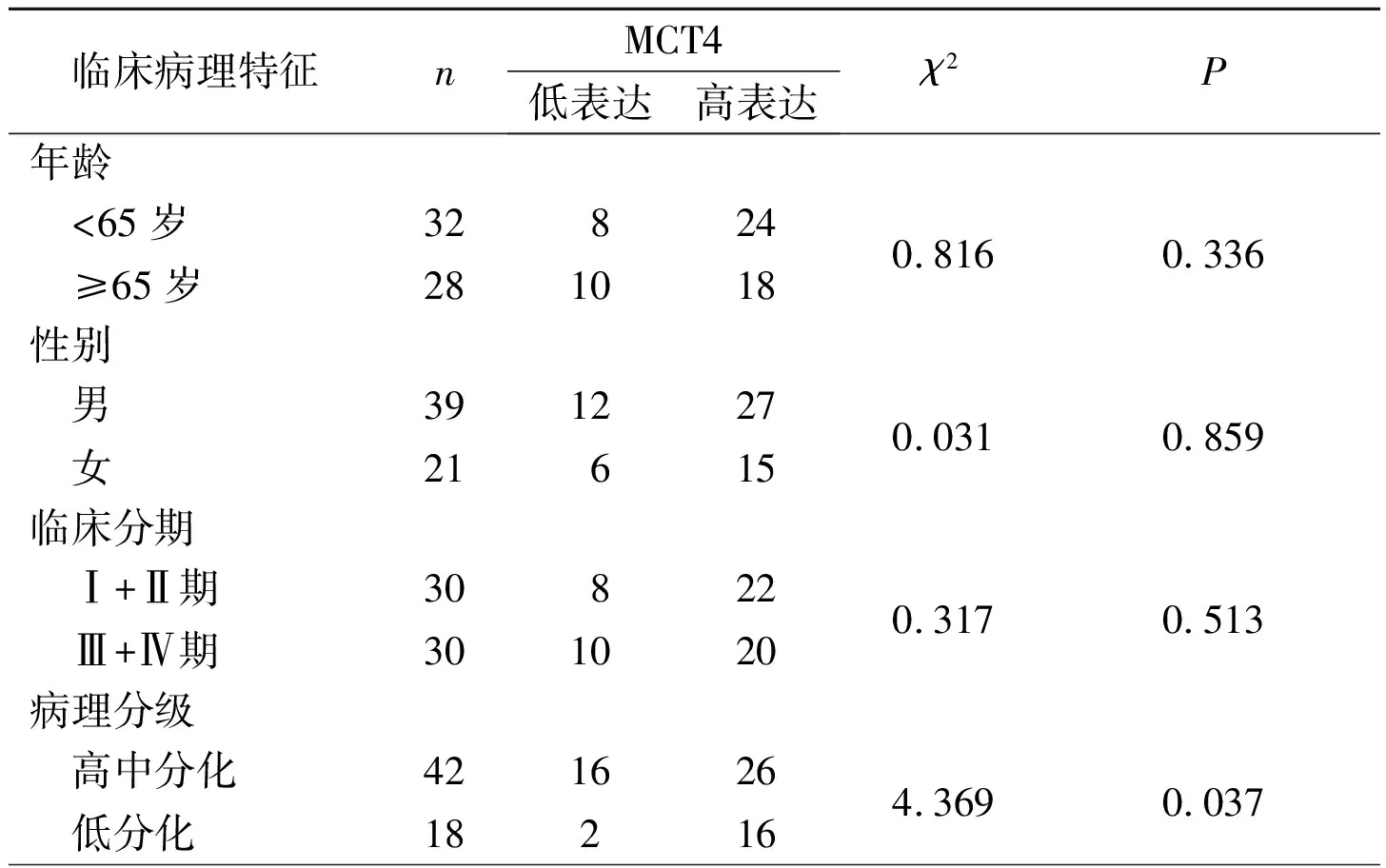
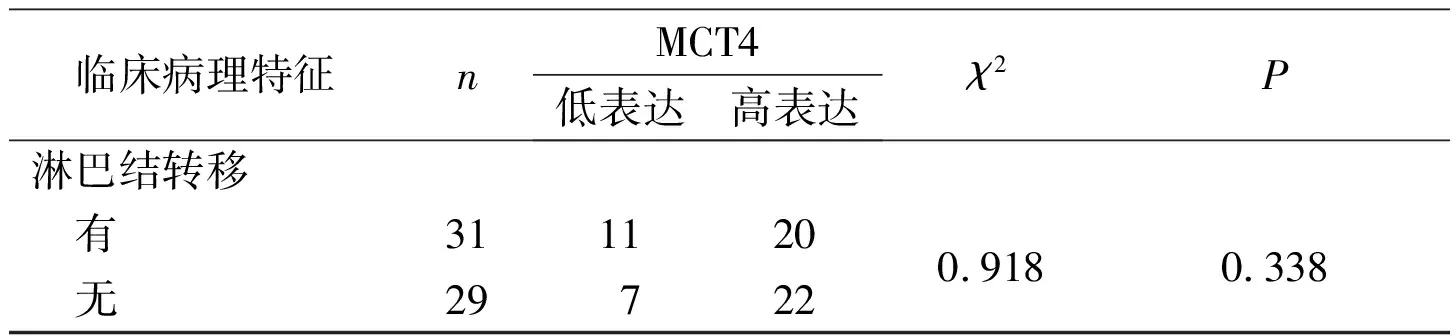
1.1.1 組織來源 選取鄭州大學第二附屬醫(yī)院病理科2014至2015年的食管鱗癌組織標本60例,另取癌旁正常食管黏膜組織(距癌灶3 cm以外)19例,均經(jīng)病理證實。患者手術前均未接受放化療等治療,手術方式為食管癌根治切除術。其中男39例,女21例;≥65歲28例,<65歲32例;臨床分期Ⅰ+Ⅱ期30例,Ⅲ+Ⅳ期30例;病理分級高中分化42例,低分化18例;有淋巴結轉移31例,無淋巴結轉移29例。
1.1.2 細胞株 正常食管上皮細胞Het1-A和食管鱗癌細胞EC109和EC9706均由鄭州大學第二附屬醫(yī)院消化研究所捐贈。
1.1.3 主要試劑 鼠抗人單抗MCT4、鼠抗人單抗GAPDH和鼠抗人單抗β-tublin分別購自于美國Santa Cruz公司、武漢三鷹生物技術有限公司和Absin公司。Lipofectamine 3000購于美國Invitrogen公司。靶向MCT4的siRNA(MCT4-siR)和陰性對照siRNA(NC-siR)購于生工生物工程(上海)股份有限公司,序列見表1。通用SP免疫組化試劑盒購于北京中杉金橋有限公司。凝膠制備試劑盒和CCK8 試劑盒購于上海碧云天生物技術有限公司,Matrigel基質膠購于美國 BD公司,Transwell小室購于美國Corning公司。乳酸測定試劑盒購于南京建成生物科技有限公司。
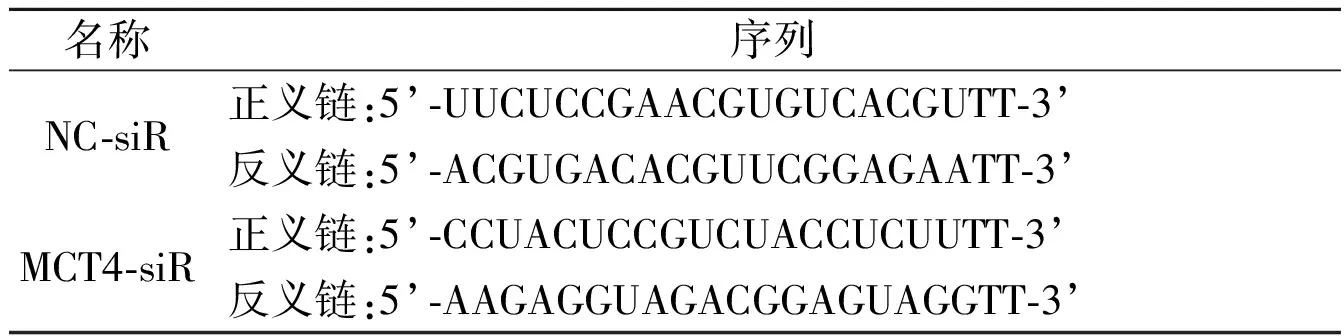
表1 siRNA序列
1.2食管鱗癌組織和細胞中MCT4蛋白的檢測
1.2.1 免疫組化法檢測組織中MCT4蛋白 將新鮮的組織標本于多聚甲醛中脫水固定,過夜后石蠟包埋,3~5 μm厚切片,然后經(jīng)脫蠟、水化、抗原修復、阻斷內源性過氧化物酶、封閉等步驟,滴加MCT4單抗(稀釋度1∶200)4 ℃過夜,滴加生物素標記山羊抗小鼠IgG和辣根過氧化物酶標記的鏈霉卵白素工作液,DAB顯色,蘇木精復染,脫水、透明、封片。以PBS作為陰性對照。于200倍鏡下觀察,細胞膜和細胞質出現(xiàn)棕黃色顆粒為陽性細胞。于200倍鏡下觀察,選取5個視野,計數(shù)500個細胞。按照染色強度評分:不顯色計0分,淺黃色計1分,棕黃色計2分,棕褐色計3分。按照陽性細胞百分比評分:<5%計0分,5%~計1分,10%~計2分,50%~計3分,≥75%計4分。兩項評分相加,<6分為低表達,≥6分為高表達。由兩名病理科專家使用雙盲法閱片評分,當兩人結果不一致時,請第3位病理科醫(yī)生定奪。
1.2.2 Western blot法檢測細胞中MCT4蛋白的表達 取對數(shù)生長期的Het1-A、EC109和EC9706細胞,以每孔2×105個/mL接種于6孔板中,當細胞融合度達到80%~90%時,用胰蛋白酶洗脫細胞,PBS洗滌2次,用離心管收集后加入裂解液,冰上裂解30 min,BCA法測量蛋白濃度。根據(jù)凝膠制備試劑盒說明書配制凝膠,上樣量為25 μg。恒壓90 V30 min后轉恒壓120 V,轉移至PVDF膜,恒流300 mA轉膜75 min。用含有吐溫20和脫脂乳的TBST(pH 7.8)室溫下封閉2 h;加一抗(MCT4抗體稀釋度1∶200,GAPDH抗體稀釋度1∶2 000)4 ℃孵育過夜;加二抗室溫孵育2 h;化學發(fā)光顯色,暗室曝光。實驗重復3次。用Image J進行定量分析,計算目的蛋白與內參GAPDH條帶灰度值的比值,以此表示目的蛋白表達水平。
1.3下調MCT4表達后EC109細胞生物學行為的變化
1.3.1 實驗分組 取對數(shù)生長期的EC109細胞,以每孔2×105個/mL接種于6孔板。實驗分為3組,分別為空白對照組、NC-siR組和MCT4-siR組,每組3個復孔。避光條件下,當細胞融合度達到50%~60%時,NC-siR組和MCT4-siR組利用lipofectmine3000分別轉染NC-siR和MCT4-siR,饑餓轉染6 h后更換為完全培養(yǎng)基。
1.3.2 細胞中MCT4蛋白的表達 用胰蛋白酶將各組細胞洗脫下來,PBS洗2次,冰上裂解30 min,BCA法檢測蛋白濃度,Western blot法檢測MCT4蛋白,內參為β-tublin,方法同前。
1.3.3 細胞外乳酸含量的測定 轉染72 h后,更換新鮮培養(yǎng)基培養(yǎng)24 h,將細胞培養(yǎng)基轉移至EP管中,依照乳酸測定試劑盒說明書操作,用酶標儀測定530 nm處吸光度,按照公式計算細胞外乳酸含量。
1.3.4 細胞增殖能力的檢測 按照1.3.1方法處理細胞后,將 3組細胞接種于96孔板中,每孔2×103個,加入100 μL培養(yǎng)基培養(yǎng)96 h,加入10 μL CCK8溶液于37 ℃烘箱中孵育2 h,測量530 nm處的吸光度(A)。細胞增殖率=實驗組A/空白對照組A×100%。實驗重復3次。
1.3.5 細胞侵襲能力的檢測 用無血清的DMEM培養(yǎng)基按照8∶1的比例稀釋Matrigel基質膠,然后加入到Transwell上層小室(100 μL),于細胞培養(yǎng)箱中過夜。移除基質膠,將細胞鋪于上層小室中,用含體積分數(shù)5%胎牛血清的DMEM培養(yǎng)基600 μL填充小室下層。24 h后,用棉簽擦去上層的細胞和基質,將小室放入無水甲醇中固定20 min,結晶紫染色,于400倍鏡下觀察。選取5個視野拍攝并計數(shù)細胞,計算平均數(shù)。侵襲率=實驗組侵襲細胞數(shù)/空白對照組侵襲細胞數(shù)。實驗重復3次。
1.3.6 細胞遷移能力的檢測 將細胞按照1.3.1方法分組培養(yǎng),板中形成完整的單層細胞后,用200 μL槍頭的尖端在底部畫一條直線,用PBS清洗,加入2 mL含有體積分數(shù)2%胎牛血清的DMEM培養(yǎng)基繼續(xù)培養(yǎng)。分別于培養(yǎng)0和24 h后鏡下拍照,用Image Pro Plus 6.0分析。劃痕愈合率=(0 h劃痕寬度-48 h劃痕寬度)/0 h劃痕寬度。遷移率=實驗組劃痕愈合率/空白對照組劃痕愈合率。實驗重復3次。
1.4統(tǒng)計學處理應用SPSS 16.0進行統(tǒng)計分析。食管正常及癌組織中MCT4高表達率的比較,不同臨床病理特征癌組織中MCT4高表達率的比較采用χ2檢驗;3種細胞中MCT4表達水平的比較,3組細胞中MCT4表達水平、細胞外乳酸含量的比較采用單因素方差分析;NC-siR組和MCT4-siR組細胞增殖率、遷移率及侵襲率的比較采用兩獨立樣本t檢驗。檢驗水準α=0.05。
2 結果
2.1食管鱗癌組織中MCT4的表達食管鱗癌和正常食管黏膜組織中MCT4的表達見圖1。食管鱗癌組織中MCT4高表達率為70.0%(42/60),而正常食管黏膜組織中為26.3%(5/19),二者比較差異有統(tǒng)計學意義(χ2=11.427,P<0.001)。不同臨床病理特征食管鱗癌組織中MCT4表達的比較見表2。由表2可知,高中分化癌組織中MCT4高表達率低于低分化癌組織。
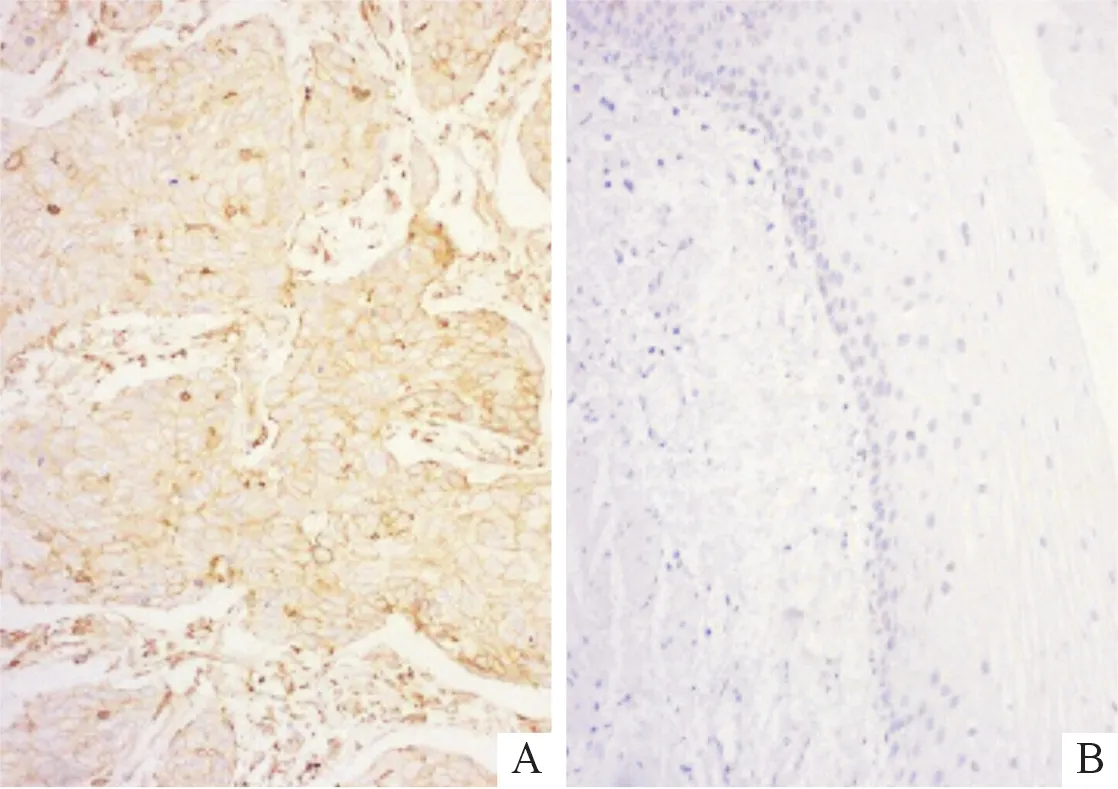
圖1 食管鱗癌(A)和正常食管黏膜(B)組織中MCT4的表達(SP,×200)
例
續(xù)表1
2.23種細胞中MCT4蛋白表達水平的比較見圖2。Het1-A、EC9706和EC109細胞中MCT4蛋白表達水平分別為(0.52±0.05)、(0.84±0.04)和(0.92±0.03),3組間差異有統(tǒng)計學意義(F=86.857,P<0.001);EC9706和EC109細胞中MCT4蛋白表達水平高于Het1-A,且EC109細胞中MCT4蛋白表達水平高于EC9706(P<0.05),故選取EC109用于后續(xù)實驗。
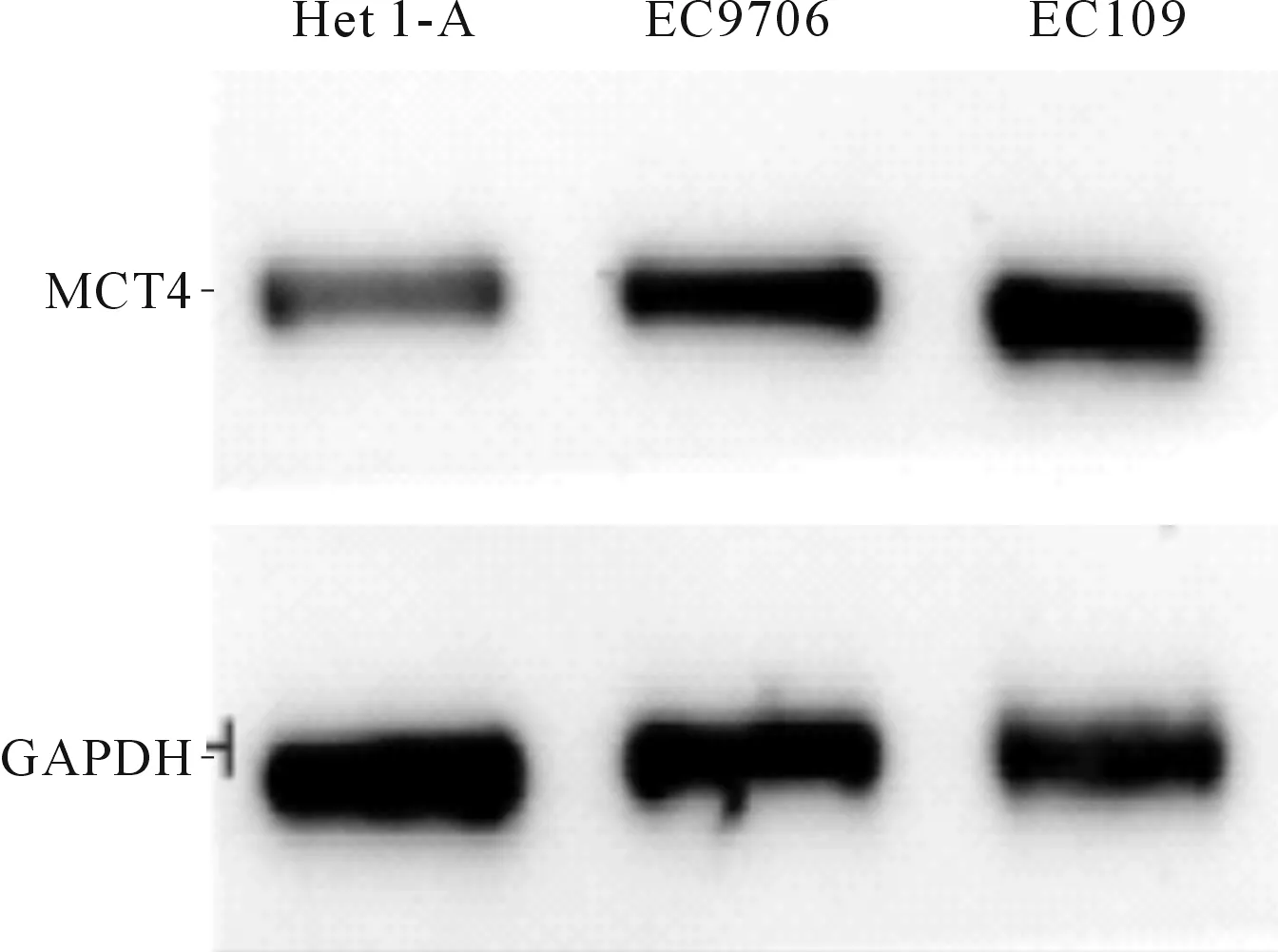
圖2 3種細胞中MCT4蛋白的表達
2.3下調MCT4后EC109細胞生物學行為的變化
2.3.1 3組細胞中MCT4的表達 見圖3、表3。與空白對照組和NC-siR組比較,MCT4-siR組細胞中MCT4蛋白表達水平降低(P<0.05)。

1:空白對照組;2:NC-siR組;3:MCT4-siR組
2.3.2 3組胞外乳酸含量及細胞增殖率、侵襲率、遷移率的比較 圖4和表3。可以看出,MCT4-siR組胞外乳酸含量較空白對照組和NC-siR組降低(P<0.05),細胞增殖率、遷移率和侵襲率均較NC-siR組降低(P<0.001)。
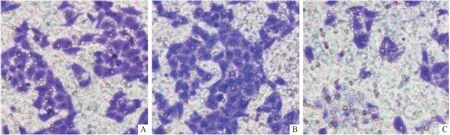
A:空白對照組;B:NC-siR組;C:MCT4-siR組
*:與空白對照組和NC-siR組相比,P<0.05
3 討論
腫瘤細胞分泌的乳酸在腫瘤微環(huán)境中持續(xù)大量積累會反饋性抑制腫瘤細胞的能量獲取,使細胞外基質和基底膜發(fā)生降解,從而導致腫瘤細胞侵襲和遷移能力增強[9]。乳酸還可誘導轉化生長因子β2(transforming growth factor β2,TGF-β2)的表達,促使腫瘤細胞遷移能力增強[10]。因此,控制乳酸轉運的MCT4與腫瘤細胞的生長關系密切[3-4]。張寶月等[11]發(fā)現(xiàn)從正常宮頸上皮發(fā)展到宮頸癌的過程中,組織中MCT4蛋白表達水平不斷增加。也有文獻[5]報道在正常食管到巴雷特食管再到食管腺癌發(fā)展過程中,組織中MCT4蛋白表達水平呈線性增長。本研究結果顯示,食管鱗癌組織中MCT4蛋白的表達水平高于正常食管黏膜組織,且癌組織分化程度越低,MCT4蛋白表達水平越高;食管鱗癌細胞EC9706和EC109中MCT4蛋白表達水平高于正常食管黏膜細胞Het1-A。研究結果提示,腫瘤細胞惡性程度增加,MCT4表達水平也增加,以維持腫瘤細胞正常的能量代謝。
Voss等[12]利用吖啶黃抑制劑破壞MCT4-CD147的連接后,腫瘤細胞增殖能力下降,并在體內觀察到腫瘤血管生成受抑。氯汞苯磺酸鹽、醋酸鉛和二氯化鎘均可抑制MCT4與CD147的相互作用,造成乳酸外排減少,但是這些化合物有很大的副作用,暫時還未用于腫瘤治療[13-14]。
利用siRNA下調口腔鱗癌細胞和肝癌細胞中 MCT4 的表達后,腫瘤細胞的侵襲和轉移能力降低[15-16]。運用siRNA沉默尿路上皮癌細胞中的MCT4可造成胞內乳酸的聚集,導致細胞增殖能力下降[17],這種增殖抑制作用在高度惡性細胞中效果更明顯[18]。前列腺癌細胞的糖酵解能力較強,會產(chǎn)生過多的乳酸,特異性抑制前列腺癌細胞中MCT4基因表達后,腫瘤細胞的增殖能力、糖酵解能力和乳酸分泌能力均顯著降低[19]。下調宮頸癌Hela和Siha細胞中MCT4的表達,可成功抑制腫瘤細胞的生物學行為[8]。
本實驗中我們參考郭振江等[8]設計,合成靶向MCT4的siRNA,轉染至EC109細胞后,轉染細胞細胞外乳酸含量降低,同時細胞增殖率、遷移率和侵襲率下降;提示沉默MCT4基因可以使EC109細胞的侵襲和遷移能力變弱,其作用機制可能與減少細胞外乳酸含量有關,但是具體機制還需要進一步探索。
綜上所述,MCT4在正常食管上皮進展到食管鱗癌過程中發(fā)揮了重要作用,下調其表達可以降低食管鱗癌細胞的惡性生物學行為。MCT4很可能會成為一個食管鱗癌臨床診斷和分子治療的靶點。

