質粒修飾BMSC聯合納米支架促進軟骨缺損修復的相關研究
鄭潤泉,康繼,張貴春*
(1.濟南軍區總醫院骨創傷外科,山東 濟南 250000;2.中國人民解放軍71939部隊,山東 濟南 250300)
骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)具有多向分化潛能,在特定誘導條件下,具有多分化潛能[1-3]。比如骨髓間充質干細胞可以分化成骨細胞、軟骨細胞以及神經細胞等[4-7]。新近研究表明,BMSCs在特定誘導條件下可以轉化成軟骨細胞,進而能促進骨與軟骨損傷的修復。而且BMSCs來源于患者自體,移植后可以避免排斥反應,這為臨床上軟骨缺損的修復提供了一個新的思路[8-10]。
既往研究表明,聚蛋白多糖(Aggrecan)與骨質密度有關,Aggrecan表達量增多時,骨質密度也相應增加,對臨床老年性骨質疏松具有明顯的治療效果[11-13]。也有研究表明組織工程材料纖維多孔支架可以促進軟骨缺損的修復[14-16]。然而尚未有相關研究利用骨髓間充質干細胞(bone mesenchymal stem cells,BMSC)為種子細胞,將Aggrecan基因過表達質粒轉染BMSC,并結合Gelatin/PLGA納米纖維多孔支架構建組織工程支架。利用基因工程和組織工程原理,充分利用兩者技術優勢,探究對軟骨缺損的修復作用,是本研究的特色。本研究制備Gelatin/PLGA納米纖維多孔支架,體外培養兔來源的骨髓間充質干細胞,構建細胞核支架的聯合培養體系,體外檢測骨髓間充質干細胞的成軟骨轉化研究,構建兔膝關節軟骨缺損模型,分析其對軟骨缺損的修復研究,以期為臨床上軟骨缺損的治療提供思路與方法。
1 資料與方法
1.1 實驗材料 胎牛血清購自Gibco公司;DMEM及0.25%胰酶Trypsin購自美國Invitrogen公司;TRIZOL購自美國Invitrogen公司;氯仿、酒精(濃度為75%)及逆轉錄試劑盒購自美國ABI Applied Biosystems公司;Real-time PCR儀購自美國bio-rad公司。
1.2 實驗方法
1.2.1 兔來源骨髓間充質干細胞的分離和培養 兔麻醉后,消毒,鋪巾,利多卡因20 mL局部麻醉,利用骨穿穿刺針提取兔的新鮮骨髓,按照1︰3體積比加入含0.01 mol/L胎牛血清、100 U/mL青霉素DMEM細胞培養液,充分混勻后,移入25 cm2Hank培養瓶中,差速培養法培養,3 d后去掉培養瓶中的油脂等雜質,之后每3 d換一次細胞培養液。BMSCs細胞融合率達70%~80%后進行傳代培養。
1.2.2 骨髓間充質干細胞的鑒定 采用流式細胞儀檢測BMSCs表面蛋白、CD29、CD44、CD71、CD90和CD106等表面蛋白的表達可以為BMSCs的鑒定提供依據。另外,采用倒置光學顯微鏡觀察BMSCs的細胞形態。
1.2.3 慢病毒Aggrecan過表達載體的構建 慢病毒Aggrecan過表達載體是由上海吉凱公司合成,選擇pHBLV-U6-ZsGreen-PGK-Puro作為質粒的克隆載體。慢病毒Aggrecan過表達載體的克隆切入點是XhoI/BamHI,編號為ENST00000016732。經過基因測序證明序列的正確性。
1.2.4 慢病毒細胞轉染 取第2代BMSCs進行實驗,將細胞接種到6孔板,待融合率為50%時進行慢病毒轉染,根據轉染說明書,MOI=50,慢病毒滴度為3×107μg/mL。
1.2.5 Gelatin/PLGA三維支架的制備和檢測與細胞分組 將10 g明膠粉末溶解于8 mL六氟異丙醇中,玻璃棒攪拌至充分溶解。加入3 mL的聚乳酸溶液,制備PLGA質量分數為20%的Gelatin/PLGA支架材料。利用無紡布作為接收裝置,利用靜電紡技術制備Gelatin/PLGA納米纖維膜,將3 g納米纖維膜打碎,加入100 mL叔丁醇溶液中,冷凍干燥機完全冷凍后得到Gelatin/PLGA三維支架。利用掃描電鏡技術檢測絲蛋白支架的結構以及細胞共培養體系的檢測。
1.2.6 構建兔膝關節軟骨缺損模型 利用3 mL/kg的15%水合氯醛靜脈內麻醉兔子。常規消毒鋪無菌單,取膝關節正中側切口,長約2 cm,逐層切開皮膚、皮下軟組織、淺深筋膜,顯露膝關節,使用口腔鉆在兔子股骨側軟骨鉆孔(長度5 mm、寬度2 mm、深度3 mm的錐形軟骨缺損),制成軟骨缺損模型,生理鹽水沖洗,加入干預措施后逐層縫合。
取15只成年健康新西蘭大白兔,隨機分為3組,每組5只。實驗組造模后植入Gelatin/PLGA三維支架+轉染Aggrecan過表達載體骨髓間充質干細胞復合物;陰性對照組造模后植入Gelatin/PLGA三維支架+未轉染骨髓間充質干細胞復合物;模型組造模后加入生理鹽水處理。
1.2.7 免疫組織化學染色 采用SP法行免疫組化,將軟骨缺損部位切片、脫蠟;PBS洗3次,5 min/次;切片室溫放置30 min;PBS沖洗3次,5 min/次;用BSA室溫處理10 min;加Aggrecan和Ⅱ型膠原一抗(Novus Biologicals,Littleton,美國),4℃過夜;PBS沖洗3次,5 min/次;加辣根酶標記鏈酶卵白素液,孵育10 min;PBS沖洗3次,5 min/次;孵育AlexaFouor 488羊抗兔IgG二抗(Novus Biologicals,Littleton,美國),室溫放置20 min;PBS沖洗3次,各5 min;DAB顯色4 min;蘇木精復染2 min,倒置光學顯微鏡下鏡檢。Image J軟件分析染色強度。
1.2.8 軟骨缺損部位HE染色 術后1周切取軟骨缺損組織,4%多聚甲醛固定30 min;脫鈣處理4周;過二甲苯Ⅰ處理15min,二甲苯Ⅱ10 min,二甲苯Ⅲ10 min;100%,95%,90%,85%酒精梯度處理各5min;二甲苯Ⅰ15 min,二甲苯Ⅱ10 min,二甲苯Ⅲ10 min,100%,95%,90%,85%酒精各處理5 min,自來水沖洗5 min,蘇木素一伊紅染液染色5 min;封片;倒置光學顯微鏡觀察。
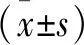
2 結果
2.1 骨髓間充質干細胞的培養和鑒定 如圖1所示,接種48 h后,原代BMSCs開始貼壁,細胞成梭形或者多角形;培養至第2代后,呈旋渦狀或者輻射狀生長,細胞增殖迅速(見圖1);流式細胞儀檢測第2代BMSCs的表面蛋白,CD29和CD34在第2代BMSCs的表達為92.6%和4.24%;CD45和CD90在第2代BMSCs的表達為3.09%和89.3%。

a 原代骨髓間充質干細胞b 第2代骨髓間充質干細胞c 第2代骨髓間充質干細胞表面蛋白CD29的表達

d 第2代骨髓間充質干細胞表面蛋白CD34的表達 e 第2代骨髓間充質干細胞表面蛋白CD45的表達 f 第2代骨髓間充質干細胞表面蛋白CD90的表達
2.2 掃描電鏡下Gelatin/PLGA三維支架與骨髓間充質干細胞共培養結果 兩組掃描電鏡下不同視窗結構見圖2,發現實驗組(Gelatin/PLGA三維支架+轉染Aggrecan過表達載體骨髓間充質干細胞復合物)中納米纖維膜和Gelatin/PLGA三維支架表面黏附的細胞與對照組(Gelatin/PLGA三維支架+未轉染骨髓間充質干細胞)相比,細胞數明顯增多。

a 單純納米纖維膜材料+空白質粒轉染BMSC生長情況b 單純納米纖維膜+過表達質粒轉染BMSC生長情況 c Gelatin/PLGA三維支架材料+空白質粒轉染BMSC生長情況 d Gelatin/PLGA三維支架材料+過表達質轉染BMSC生長情況
2.3 動物模型軟骨缺損組織大體結果 14 d后,將實驗動物處死,取3組兔子軟骨缺損大體標本,可見Gelatin/PLGA三維支架與骨髓間充質干細胞聯合培養體系可以對軟骨缺損有較好的修復作用,轉染Aggrecan骨髓間充質干細胞后修復作用明顯優于未轉染組(見圖3)。
2.4 兔軟骨缺損組織HE染色結果 14 d后,將實驗動物處死,取3組兔子軟骨缺損組織行HE染色,對照組細胞結構少,支架略有降解。多為纖維性修復。實驗組細胞深染,可見聚蛋白多糖轉染細胞后,促進BMSC向軟骨細胞轉化,實驗組多為軟骨性細胞修復(見圖4)。

a 軟骨缺損大體圖片 b 對照組軟骨缺損修復結果 b 實驗組軟骨缺損修復結果

a 模型組 b 對照組 c 實驗組
2.5 兔軟骨缺損組織免疫組織化學染色結果 14 d后,將實驗動物處死,取3組兔子軟骨缺損組織化學染色,如圖5所示,模型組軟骨缺損明顯,Aggrecan和Ⅱ型膠原表達量較少。對照組(Gelatin/PLGA三維支架+未轉染骨髓間充質干細胞)Aggrecan和Ⅱ型膠原表達量明顯增多,細胞棕色表達明顯增多。實驗組(Gelatin/PLGA三維支架+轉染Aggrecan過表達載體骨髓間充質干細胞復合物)Aggrecan和Ⅱ型膠原表達量明顯增多,細胞棕色表達明顯增多(見圖5)。

a 模型組聚蛋白多糖染色b 對照組聚蛋白多糖染色c 實驗組聚蛋白多糖染色

d 模型組Ⅱ型膠原染色 e 對照組Ⅱ型膠原染色 f 實驗組Ⅱ型膠原染色
3 討論
本實驗應用基因工程和組織工程原理,充分利用兩者技術優勢,體外培養兔來源的骨髓間充質干細胞,構建Gelatin/PLGA三維支架的聯合骨髓間充質干細胞培養體系,探究對軟骨缺損的修復作用。本研究利用靜電紡法制備天然活性多孔Gelatin/PLGA三維支架,體外檢測骨髓間充質干細胞的成軟骨轉化,修復軟骨缺損的實驗研究,構建兔子軟骨缺損模型,探究其對軟骨缺損的修復研究,以期為臨床上軟骨缺損的治療提供思路與方法。
既往研究表明,利用骨髓間充質干細胞復合異種骨基質明膠可以有效修復大鼠橈骨缺損,在組織支架的誘導作用下,可以促進骨髓間充質干細胞向骨細胞轉化,進而修復骨缺損[17-19]。但是這種方法需要符合特定條件的組織工程支架,也就是需要特殊的“土壤”,而骨髓間充質干細胞這個“種子”才能更好的在其內生長并且分化,臨床應用的安全性有待調查[20-22]。有的學者發現,利用慢病毒構建基因載體,轉染骨髓間充質干細胞后,不影響骨髓間充質干細胞的表型[23]。可見利用基因工程原理,構建基因過表達的骨髓間充質干細胞也是提高“種子”有效分化的一種手段。本研究正是立足于這一點,構建Aggrecan基因過表達質粒慢病毒載體的骨髓間充質干細胞,制作新型“基因種子”,為臨床軟骨缺損的研究做準備。
另外,有研究證明,抗生素/β-磷酸三鈣/多孔三維支架可以修復兔橈骨骨缺損[24]。認為多孔Gelatin/PLGA三維支架具有良好的生物相容性和抗菌性。本研究采用多孔Gelatin/PLGA三維支架聯合骨髓間充質干細胞共培養體系,利用掃描電鏡顯微鏡觀察Gelatin/PLGA三維支架的表面結構,發現支架表面凹凸不平,可以為骨髓間充質干細胞提供良好的黏附部位。這種發現與新近的研究相似[25],證明了研究設計方案的可行性。從本研究的結果來看,不僅骨髓間充質干細胞可以很好黏附在Gelatin/PLGA三維支架表面,而且可以分泌細胞外基質,填充與支架間孔,為臨床上軟骨缺損提供良好的自體來源的細胞基質,這也是本研究的特色之一。另外,本研究發現,轉染Aggrecan基因過表達載體后,干細胞分泌的細胞外基質要多,可以充填于支架間的空隙。另外,本研究體外實驗中采用HE染色和免疫組織化學染色發現,轉染Aggrecan基因過表達載體后,骨髓間充質干細胞向軟骨細胞分化的效率明顯提高。而且,本研究利用兔膝關節軟骨缺損模型,將Gelatin/PLGA三維支架加轉染Aggrecan過表達載體骨髓間充質干細胞復合物(實驗組),Gelatin/PLGA三維支架+未轉染骨髓間充質干細胞復合物(對照組)植入軟骨缺損部位,利用HE染色探究對軟骨缺損的修復作用,而且實驗組細胞向軟骨細胞轉化效率較高,可以實現真正的“細胞修復”,而不是平常支架所達到的“纖維修復”。可見,Gelatin/PLGA三維支架加轉染Aggrecan過表達載體骨髓間充質干細胞復合物可以更好地發揮修復作用。另外,本研究還檢測了缺損組織Aggrecan和Ⅱ型膠原的表達,發現Gelatin/PLGA三維支架加轉染Aggrecan過表達載體骨髓間充質干細胞復合物可以促進Aggrecan和Ⅱ型膠原的表達,從而更好地重建細胞外基質,從細胞和細胞外基質兩個層面對軟骨進行修復。
綜上所述,Gelatin/PLGA三維支架加轉染Aggrecan過表達載體骨髓間充質干細胞復合物可以促進BMSC向軟骨細胞的分化,并且分泌更多的含Aggrecan和Ⅱ型膠原成分的細胞外基質,從而發揮其促進軟骨缺損修復的作用。

