黑曲霉H9-30全細胞催化合成低聚異麥芽糖
黃楠,周波,葉童,陳桂光,梁智群,曾偉*
1(亞熱帶農業生物資源保護與利用國家重點實驗室(廣西大學),廣西 南寧,530004) 2(廣西大學 生命科學與技術學院,廣西 南寧,530004)
低聚異麥芽糖(isomaltooligosaccharides,IMO)是一類由α-1,6糖苷鍵連接葡萄糖基形成的功能性低聚糖[1-2]。IMO可促進短鏈脂肪酸產生,降低腸道內pH值以減少致病菌,還能促進結腸中雙歧桿菌和乳酸桿菌群的增殖,抑制腸道病原體的生長[3-4]。在食品中添加IMO能防止淀粉老化,延長食品的保質期[5]。作為益生元和膳食纖維的IMO具有熱值低、促益菌、防齲齒、穩定性高等優點,現被廣泛用于食品行業。
IMO起初作為一種淀粉酶解的副產物,發現于葡萄糖生產過程中。生產IMO的傳統方法有2種:(1)由α-淀粉酶(EC 3.2.1.1)、β-淀粉酶(EC 3.2.1.2)和α-葡萄糖苷酶(EC 3.2.1.20)協同轉化生成[6-7];(2)由α-葡糖苷酶與新普魯蘭酶(EC 3.2.1.135)協同轉化生成[8]。使用游離酶生產低聚異麥芽糖成本高且生產過程繁瑣。目前國內外相關領域的研究主要集中在高產α-葡萄糖苷酶新菌株的選育[9-10]、新型α-葡萄糖苷酶的分離純化及其酶學性質研究[11-13]、固定化細胞和固定化酶[14-15]等方面。然而,IMO的工業化生產仍面臨成本高,轉化時間長,轉化率低等問題[16]。因此,有必要尋找一種低耗、高效的方法生產IMO。
全細胞催化是一種利用完整生物體作為催化劑進行生物轉化的方法,其因制備簡單、生產成本低和催化效率高等優點,被廣泛應用于各類產物的合成,如蔗果低聚糖[17]、茶多酚[18]、阿糖腺苷[19]等。OJHA等[20]利用微桿菌(Microbacteriumsp.)全細胞轉化麥芽糖合成IMO,其IMO轉化率達到58%,取得較好成果,但其菌體無法回收利用;徐燕杉[21]以黑曲霉(Aspergillusniger)α- 葡萄糖苷酶在畢赤酵母(Pichiapastoris)的表面展示,催化合成IMO,其初始IMO轉化率為45%,但重復利用3次后轉化率降低至30%。黑曲霉作為一種絲狀真菌有產酶能力強,菌體便于回收等特點,是用于全細胞轉化生產IMO的理想菌種。開展這一方向的研究工作,有利于進一步降低商品IMO的生產成本和增加IMO的工業生產效率。
實驗室在前期工作中通過復合誘變選育得到1株產α-葡萄糖苷酶的黑曲霉菌株H9-30,其菌體轉苷活力達24 000 U/g。本文以黑曲霉H9-30全細胞作為生物催化劑,以麥芽糖作為反應底物,探究轉化合成IMO的最優條件,并重復利用黑曲霉細胞生產IMO,以期為其工業化應用奠定基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
黑曲霉H9-30,釀酒酵母(Saccharomycescerevisiae) GXJ-1:保藏于廣西大學生命科學與技術學院食品發酵工程實驗室。
1.1.2 試劑
葡萄糖、麥芽糖、異麥芽糖、麥芽三糖、潘糖、異麥芽三糖標準品:美國Sigma-Aldrich公司。
1.1.3 培養基
斜面培養基(g/L):麩皮汁30,麥芽糖 30,瓊脂20,pH 5.0。麩皮種子培養基:麩皮8 g,蒸餾水4 mL,自然pH。發酵培養基(g/L):玉米淀粉80,玉米漿干粉40,醋酸鈣0.8,甲基-葡糖胺0.1,pH 4.8。酵母培養基(g/L):麥芽糖10,胰蛋白胨5,酵母粉5。培養基于115 ℃滅菌30 min。
1.2 儀器與設備
LC-10AT型高效液相色譜儀,日本島津公司;SW-CJ-1F超凈工作臺,蘇州安泰空氣技術公司;METTLER TOLEDO PL303精密電子天平,德國METTLER公司;SKY-211B振蕩培養箱、SKY-110WX恒溫水浴搖床、SKJH-1109超凈工作臺,上海蘇坤公司。
1.3 實驗方法
1.3.1 黑曲霉細胞的培養與收集
取培養60 h長滿成熟孢子的種子,用無菌的生理鹽水將孢子洗下,以6層紗布將其過濾至含有玻璃珠的250 mL三角瓶中,得到孢子懸液。懸液在34 ℃, 220 r/min下振蕩30 min將孢子打散。以血球計數板法計算孢子數量,并將孢子懸液濃度調至1×107個/mL。將濃度為1×107個/mL的孢子懸液以體積分數1%接種至含50 mL發酵培養基的500 mL三角瓶中,在34 ℃,220 r/min的振蕩培養箱中培養42 h。將發酵液抽濾,以10倍體積的去離子水沖洗3次后收集細胞。
1.3.2 黑曲霉細胞的預處理
黑曲霉細胞菌體在2 g/L麥芽糖的NaH2PO4-Na2HPO4緩沖液(20 mmol/L,pH 6.0)中重懸,在52 ℃ 下保溫30 min致死細胞。以10倍體積的去離子水沖洗致死后的黑曲霉細胞,重復沖洗3次后于40 ℃恒溫干燥箱放至恒重。
1.3.3 IMO的轉化參數
1.3.3.1 溫度對全細胞轉化合成IMO的影響
將黑曲霉細胞α-葡萄糖苷酶與底物于37、42、45、48、50、52、55、60、70 ℃分別保溫30 min后混勻,整個體系于pH 6.0的Britton-Robison緩沖液(20 mmol/L) 中反應。以300 g/L的麥芽糖為底物檢測不同溫度下α-葡萄糖苷酶的轉苷活力,考察黑曲霉細胞α-葡萄糖苷酶的最適轉苷溫度。將黑曲霉細胞于45、48、50、52 ℃保溫24 h,考察黑曲霉細胞α-葡萄糖苷酶的熱穩定性。
1.3.3.2 反應初始pH值對全細胞轉化合成IMO的影響
將黑曲霉細胞α-葡萄糖苷酶與底物溶于pH值為3.0、4.0、4.2、4.5、5.0、5.5、6.0、7.0、8.0、9.0的Britton-Robison緩沖液,測定在不同pH值下α-葡萄糖苷酶轉苷活力,考察最適初始轉苷pH值。將α-葡萄糖苷酶與底物溶于pH值為4.0、4.2、4.5的Britton-Robison緩沖液,在最適反應溫度下保溫24 h,混合體系于37 ℃測定酶的保留活力。
1.3.3.3 底物濃度對全細胞轉化合成IMO的影響
將黑曲霉細胞添加至含麥芽糖100、200、300、400、500、600、800 g/L的Britton-Robison緩沖液中,在最適溫度和pH值下轉化生成IMO,考察底物濃度對全細胞轉化合成IMO的影響。
1.3.3.4 黑曲霉細胞添加量對IMO合成的影響
將黑曲霉細胞以5、10、15、20 g/L添加至含有100 mL最適轉化濃度麥芽糖漿的250 mL三角瓶中,以最適溫度和pH值下轉化底物。跟蹤轉苷反應,考察黑曲霉細胞添加量對IMO合成的影響。
1.3.4 IMO的全細胞轉化及純化
將黑曲霉細胞添加至麥芽糖漿中,在最適轉苷溫度與pH值下反應,得到IMO與可發酵性糖(葡萄糖、麥芽糖等)的混合液。以釀酒酵母消耗混合液中的可發酵性糖[22],得到純化的IMO。
1.3.5 α-葡萄糖苷酶轉苷活力的測定
1.3.5.1 α-葡萄糖苷酶轉苷活力的定義
在37 ℃、pH 4.2,300 g/L麥芽糖條件下,每小時轉化麥芽糖生成1 μg有效三糖(eIMO,包括異麥芽糖、潘糖和異麥芽三糖)所對應的酶量定義為1個酶活力單位(U)。
1.3.5.2 菌絲體α-葡萄糖苷酶轉苷活力的測定方法
取黑曲霉細胞0.03 g于10 mL EP管中,加入5 mL以pH 4.2,20 mmol/L的醋酸-醋酸鈉緩沖液配制的300 g/L麥芽糖溶液,混勻,37 ℃水浴1 h。沸水浴10 min 終止轉苷反應。使用配有Ecosil NH2柱(5 μm,4.6 mm×250 mm)和Waters Sugar-Pak 1柱(10 μm,6.5 mm×300 mm)的色譜系統,以HPLC分析eIMO,以確定轉苷活力。色譜條件參照GB/T 20881—2007,《低聚異麥芽糖》強制性國家標準中的檢測方法。
2 結果與分析
2.1 溫度對黑曲霉細胞轉苷反應的影響
反應溫度影響細胞中α-葡萄糖苷酶的活力和穩定性。由圖1-A可知,黑曲霉細胞中的α-葡萄糖苷酶在52 ℃轉苷活力達到最大,且在45~55 ℃的轉苷活力為最高活力的80%以上。由圖1-B可見,反應體系的溫度對α-葡萄糖苷酶的穩定性影響較大。在48 ℃的α-葡萄糖苷酶穩定性明顯高于50 ℃。這是由于α-葡萄糖苷酶隨著溫度的升高,酶逐漸失活造成[16]。雖然細胞中α-葡萄糖苷酶在52 ℃表現出最大轉苷活力,但其穩定性遠低于48 ℃。反應溫度越低,α-葡萄糖苷酶的穩定性越高,但過低的轉化溫度會導致轉化時間延長。在實際應用中,若反應溫度低于48 ℃,反應過程中的雜菌污染情況嚴重,因此本研究選擇反應溫度為48 ℃。
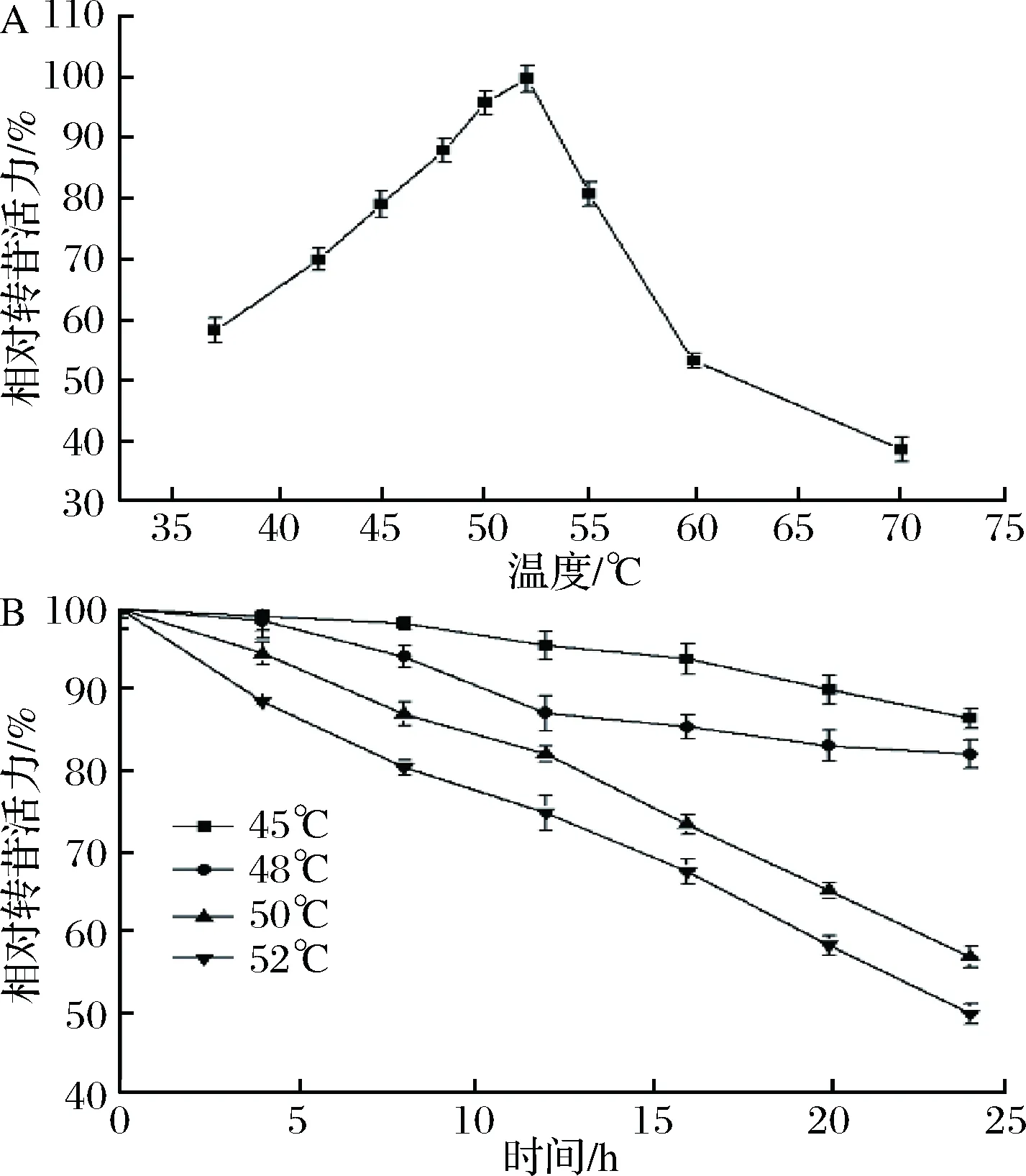
A-溫度對黑曲霉細胞α-葡萄糖苷酶轉苷活力的影響;B-溫度對黑曲霉細胞α-葡萄糖苷酶穩定性的影響圖1 溫度對黑曲霉細胞α-葡萄糖苷酶轉苷反應的影響Fig.1 Effect of temperature on α-glucosidase transglycosylation of A. niger cells
2.2 初始pH值對黑曲霉細胞轉苷反應的影響
由圖2-A可知,在弱酸性環境中α-葡萄糖苷酶的轉苷活力較強,這與固定化后的轉移葡萄糖苷酶性質相似[23]。黑曲霉細胞α-葡萄糖苷酶的最適轉苷初始pH值為4.2,細胞中α-葡萄糖苷酶的轉苷活力在pH值4.0~5.0保持較高值(大于80%)。然而,當反應體系pH值為4.0時,α-葡萄糖苷酶的相對轉苷活力隨著保溫時間的增加急劇下降(圖2-B)。這是由于酶在超過耐酸閾值后逐漸變性失活所致。為保證較高的轉化效率和反應中酶的穩定性,本研究選擇初始pH值為4.2。
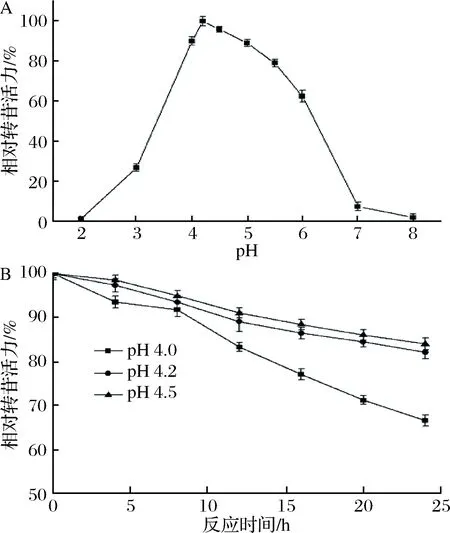
A-初始pH值對黑曲霉細胞α-葡萄糖苷酶轉苷活力的影響;B-初始pH值對黑曲霉細胞α-葡萄糖苷酶穩定性的影響圖2 初始pH值對黑曲霉細胞α-葡萄糖苷酶轉苷反應的影響Fig.2 Effect of initial pH value on α-glucosidase transglycosylation of A. niger cells
2.3 麥芽糖濃度對黑曲霉細胞轉苷反應的影響
底物濃度通過改變酶的區域選擇性影響轉苷反應[24]。α-葡萄糖苷酶在底物濃度遠高于酶濃度時,酶作用于底物非還原端的1,4-糖苷鍵,并將切下的活性糖基供體轉移至糖基受體形成新的1,6-糖苷鍵,從而表現出轉糖苷活性[25]。實驗在48 ℃和pH值為4.2的條件下,探究了麥芽糖質量濃度(200~1 000 g/L)對菌絲體轉苷反應的影響。由圖3-A可知,反應體系中麥芽糖質量濃度對菌絲體中α-葡萄糖苷酶的轉苷活力影響顯著。在實驗濃度范圍內,α-葡萄糖苷酶轉苷活力隨底物濃度增加呈指數增長(y=4.221exp(x/25.981)+8.211,R2=0.996),這意味著單位時間底物的轉化速率大大增加。OJHA等[20]曾報道α-葡萄糖苷酶在高底物濃度下表現出強烈的轉苷作用,VETERE等[24]曾通過調節底物濃度改變酶的區域選擇性影響轉苷反應,但α-葡萄糖苷酶轉苷活力隨底物濃度上升呈指數型升高尚屬首次報道。
然而,較高的轉苷活力并未使底物轉化率顯著提升。向麥芽糖濃度為300、600、800 g/L的反應體系中添加等量的黑曲霉細胞,反應終點的eIMO含量分別為154.3 g/L(圖3-B)、312.2 g/L(圖3-C)、316.8 g/L(圖3-D)。反應初期(0~10 h),eIMO的產生速率隨麥芽糖質量濃度升高而加快。但這種轉苷速率提升的現象隨反應時間的延長逐漸消失。麥芽糖質量濃度為800 g/L 時,eIMO在84 h達到最大值,遠高于300 g/L麥芽糖下達到最大eIMO所需時間(20 h)。

A-麥芽糖濃度對黑曲霉細胞α-葡萄糖苷酶轉苷活力的影響;B-麥芽糖濃度對eIMO合成的影響圖3 麥芽糖濃度對黑曲霉細胞α-葡萄糖苷酶轉苷反應的影響Fig.3 Effect of the concentration of maltose on transglycosylation of A. niger α-glucosidase
這是由于在反應過程中,反應體系的組分改變引起pH值降低,α-葡萄糖苷酶逐漸失活所致。在麥芽糖質量濃度大于600 g/L時形成的高滲透壓下,反應體系的微生物污染率低,有利于工業化生產。而過高的麥芽糖質量濃度使低濃度緩沖體系無法在反應過程中維持酸堿平衡,較高的緩沖液質量濃度對產品品質不利。由此,本研究選擇麥芽糖質量濃度為600 g/L進行反應。
2.4 黑曲霉細胞添加量對轉苷反應的影響
由圖4可知,eIMO合成速率隨黑曲霉細胞添加量的增加而上升。
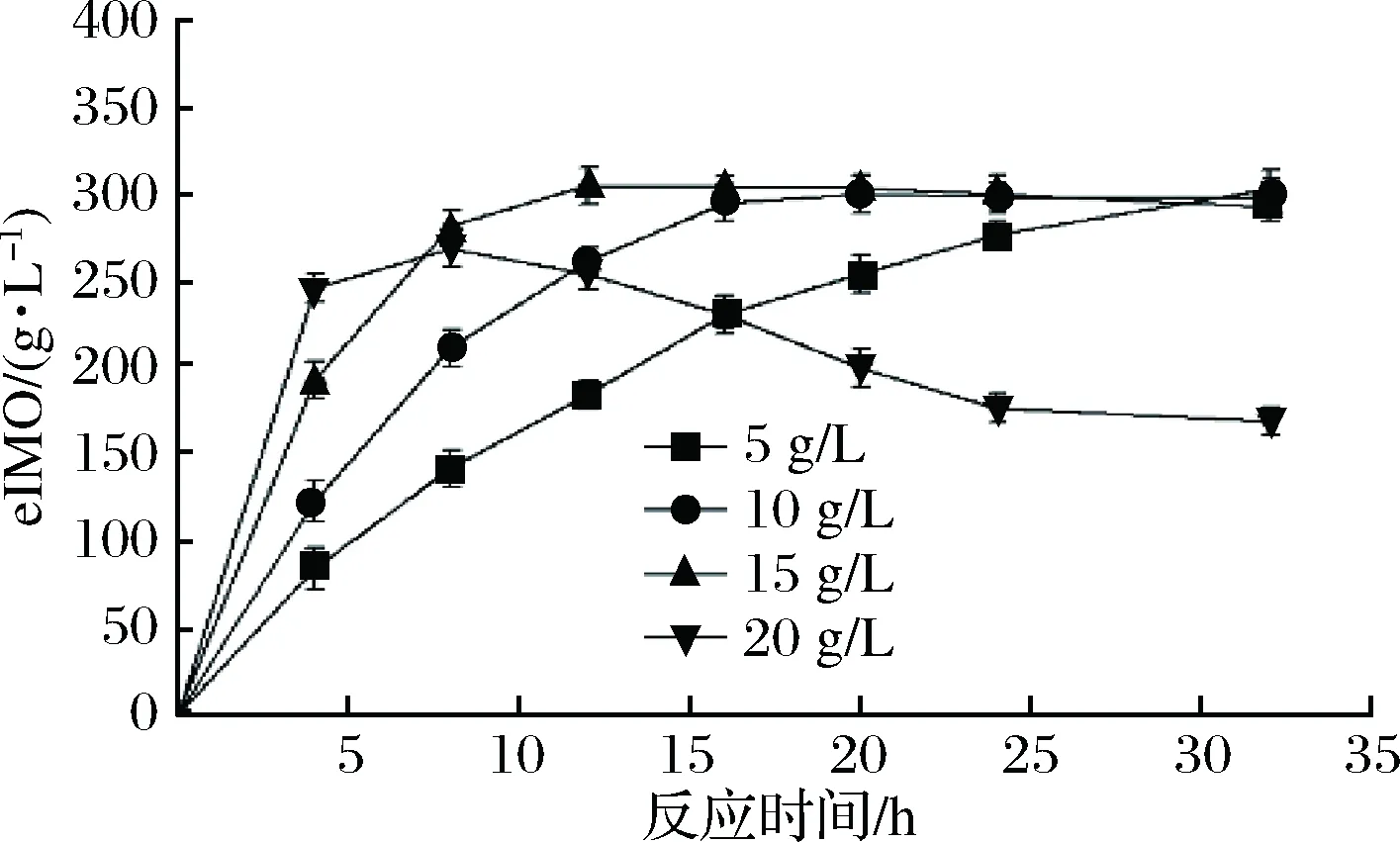
圖4 黑曲霉細胞添加量對轉苷反應的影響Fig.4 Effect of A. niger cell content on transglycosylation in the reaction system
eIMO產率在細胞添加量為5~15 g/L時保持穩定,占總糖質量分數的(50.5±0.8)%。在細胞添加量為20 g/L時,eIMO的合成峰值質量濃度為268.9 g/L,低于低質量濃度黑曲霉細胞添加量的合成水平。反應在8 h后,eIMO質量濃度明顯下降。這可能是由于體系中α-葡萄糖苷酶含量過多導致反應向水解方向傾斜[25]。為了保證IMO的合成速率與轉化率,維持反應體系中IMO穩定,本研究選擇黑曲霉細胞添加量15 g/L進行反應。
2.5 利用黑曲霉全細胞轉化麥芽糖生產IMO
當α-葡萄糖苷酶表現出轉糖苷活性且反應體系中存在短鏈寡糖(葡萄糖聚合度為2~6)時,活化的糖基供體有幾率與寡糖連接形成異麥芽糖結構,由此產生IMO[1, 26]。實驗在48 ℃下,pH值為4.2的含600 g/L麥芽糖的醋酸-醋酸鈉緩沖液(20 mmol/L)中,每批次12 h轉化麥芽糖生產IMO。由圖5可知,eIMO含量隨反應批次的增加而下降,這可能是由于α-葡萄糖苷酶在反應體系中逐漸變性失活所致[26]。

圖5 黑曲霉全細胞轉化麥芽糖生產IMOFig.5 Synthesis of IMO by whole-cell catalysis of A. niger
轉化反應在21批時,將所添加糖漿減少為初始的一半,eIMO質量分數仍無法大于35%(以IMO-50標準),由此確定此條件下,黑曲霉菌絲體生產IMO-50的半衰期為20批次(10 d)。菌絲體生產IMO的操作穩定性強,實驗中IMO的組分穩定,第1批與第20批相比,總IMO含量僅下降1.3%,葡萄糖含量低于38%,符合IMO-50的工業生產標準。從表1可見,以黑曲霉H9-30細胞α-葡萄糖苷酶轉化麥芽糖產物主要為潘糖和異麥芽糖。第20批的轉化產物的酵母耗糖結果顯示,純化后的IMO達到總糖含量的93.8%,eIMO的質量分數為總糖的67.8%,高于IMO-90生產標準,為全細胞催化合成IMO提供了新的參考。

表1 第20批黑曲霉細胞轉化及酵母純化的IMO組成成分Table 1 Composition of IMO from the 20th batch of whole-cell transformation and yeast purification
3 結論
本文對黑曲霉H9-30細胞α-葡萄糖苷酶轉化麥芽糖生產IMO進行研究。通過對反應溫度、初始pH值、底物質量濃度、細胞添加量對α-葡萄糖苷酶轉苷反應影響的探究,確定了反應最佳條件為:反應溫度48 ℃,初始pH值4.2,麥芽糖質量濃度為600 g/L,黑曲霉細胞添加量為15 g/L。此條件下,eIMO占總糖質量分數的50.5%,總IMO含量達到63.3%,葡萄糖含量小于38%,符合工業生產IMO標準。黑曲霉細胞α-葡萄糖苷酶轉化IMO具有較好的操作穩定性,生產IMO-50的半衰期為20批次(10 d),第20批所產IMO經酵母耗糖純化后仍高于IMO-90生產標準,有望應用于工業化生產IMO。

