不同施氮水平對興安落葉松化學計量特征的影響
陳璐 王慶貴 閆國永 邢亞娟
摘要:以興安落葉松為研究對象,在大興安嶺南甕河自然保護區建立統一立地條件的4個氮(N)處理水平樣地,分別為對照(CK,0g N /(m?2·a))、低N(LN,2.5g N /(m?2·a))、中N(MN,5g N /(m?2·a))、高N(HN,7.5g N /(m?2·a))處理。測定凋落葉、根和鮮葉在不同施N水平下C、N、P、K、Ca、Mg的含量。研究目的是為了闡明興安落葉松葉和根各元素含量及化學計量比的分配格局,揭示葉片凋落前各元素的重吸收率,探討各元素及其化學計量之間的關聯以及對不同水平施N處理的響應。結果表明:①鮮葉、根、凋落葉C、N、P變化范圍分別為393.174~518.362、4.405~23.963、0.743~1.671 mg/g,其中鮮葉C、P含量最高,根最低。②LN,MN,HN均顯著提高了根的N含量,MN,HN顯著提高了鮮葉N含量。植物養分含量在不同器官中存在顯著差異。③植物葉片對Ca表現為富集狀態,對N、P、K、Mg各元素則體現為重吸收狀態。結論顯示,鮮葉和根是影響興安落葉松C、N、P及化學計量比的主導因子。興安落葉松在N素充足的條件下,施N導致興安落葉松對N和P奢侈吸收,提高了凋落葉的分解速率并加快了生態系統的養分循環。
關鍵詞:施N;生態化學計量比;養分重吸收率;興安落葉松
中圖分類號:S718.5文獻標識碼:A文章編號:1006-8023(2019)02-0001-10
Effect of Long-term Nitrogen Deposition on the Stoichiometric?Characteristics of Larix gmelinii
CHEN Lu, WANG Qinggui, YAN Guoyong, XING Yajuan
(College of Agricultural Resource and Environment, Heilongjiang University, Harbin 150000)
Abstract:Taking ?Larix gmelinii??from Greater Khingan Mountains as the research object, four nitrogen (N) treatment level plots with unified site conditions were established in Nanwenghe Nature Reserve of Greater Khingan Mountains, included contrast CK (CK, 0g N / (m?2·a)), low nitrogen (LN, 2.5g N / (m?2·a)), middle nitrogen (MN, 5g N / (m?2·a)), high nitrogen (HN, 7.5g N / (m?2·a)). The contents of C、N、P、K、Ca、Mg in leaves, roots and fresh leaves were determined under different N addition gradient. The purpose was to elucidate the aboveground organ leaves and underground organ roots of ?Larix gmelini?. The distribution pattern of each element content and stoichiometry ratio revealed the heavy absorption rate of each element before leaf litter and discussed the relationship between each nutrient element and response to different levels of N application. The results showed that: (1) C、N、P of fresh leaves, roots and littered leaves ranged from 393.174-518.362 mg/g, 4.405-23.963 mg/g, and 0.743-1.671mg/g. The range of C and P content in leaves was the highest, and the lowest in roots. (2) LN, MN, HN significantly increased N content in roots, and MN, HN significantly increased N content in roots. There were significant differences in plant nutrient content in different organs. (3) The plant leaves were enriched to Ca and reabsorbed to the elements. It conclude that the leaf and root were the main factors that affected the chemical measurement ratio and the C, N, P of ?Larix gmelinii?. Under the condition of sufficient nitrogen, nitrogen deposition resulted in the extravagant absorption of N and P by ?Larix gmelinii?, which could increase the decomposition rate of litter leaves and nutrient cycling in its ecosystem.
Keywords:Application of N; ecological stoichiometric ratio; nutrient recovery rate; ?Larix gmelinii
0引言
從1980年至2010年間中國各地的氮(N)沉降動態對生態系統產生巨大影響。研究發現在20世紀80年代(13.2 kg/hm?2)和21世紀(21.1 kg/hm?2)之間,平均每年N的體積沉降量增加了約8 kg/hm?2?[1]。人類活動導致大氣N沉降不斷增強?[2],嚴重影響生態系統結構功能及其養分循環過程?[3],進而也對植物化學計量的平衡產生影響。
先前的研究表明,植物的化學計量特征可以表征植物維持體內化學計量內穩性的能力?[4],并反映植物對環境變化的適應性?[5]。長期自然選擇,使植物進化出一套適應環境變化的策略?[6]。例如,植物能通過調節根系養分的捕獲或者葉片養分的重吸收來維持其化學計量平衡?[7]。養分重吸收是指將衰老葉片中的元素吸收到其它功能活躍的植物組織的過程?[8]。養分重吸收是一種重要的內部營養保護機制,可以減少植物對外部養分的依賴?[7]。相反,養分捕獲被認為是一種外部養分獲取策略。植物對于養分捕獲和重吸收的分配方式取決于環境中養分的可利用性和它們所涉及的成本?[9-10]。在缺乏營養的環境中,能量消耗常與養分捕獲成比例增加?[11]。但隨著養分供應的增加,觀察到與養分捕獲有關的酶(例如幾丁質酶和磷酸酶)的下降?[12]。這也可以被解釋為根系獲取養分的減少,因為根系對養分的捕獲與酶的合成有關。
人為施N可以改變N和其他限制性養分的有效性?[13-14]。從而影響植物對養分的捕獲和重吸收?[15-16]。Yuan和Chen?[17]最近的一次Meta分析表明,N肥可以提高綠葉中的N濃度,但降低了對N的吸收效率。此外,增加N的利用率也會對其他營養物質的吸收產生影響?[18]。由于N沉積持續會超過植物和微生物對N的需求,土壤中過量的N可能會產生各種有害影響,如土壤酸化、增加硝酸鹽的淋溶,以及營養限制的強度和類型的變化?[19]。然而,盡管在元素之間存在化學計量耦合,但尚不清楚植物如何保持養分捕獲和養分重吸收的平衡來響應N沉降,所以仍需要進一步的研究和發展。
植物各營養器官養分含量的變異亦對植物生長速率以及應對環境變化起著調節作用?[19]。當前,不同地區植物化學計量格局及其驅動因素仍然是熱點話題,其結果對于理解化學計量比的趨同和分異有重要的意義,并且還能夠預測生態系統功能,響應全球氣候變化。此外,近年來對不同地域空間尺度的研究較多,且大多集中于葉片而忽略了針對植物體不同器官的研究。從豐富資源經濟譜理論的角度看,加強不同器官養分化學計量關系,及各器官之間的相關性十分必要?[21]。現如今對化學計量比的研究大多集中在熱帶、溫帶森林和草地,對于北方森林研究較少。
基于以上問題,筆者在我國北方森林建立長期施N樣地,研究興安落葉松各元素及化學計量關系在不同施N條件下會發生怎樣的變化,興安落葉松地上部分葉及地下部分根化學計量比的關聯性,不同水平施N將如何影響養分重吸收率。研究通過測定不同水平施N下植物鮮葉、根和凋落葉中的C、N、P含量,計算養分重吸收效率,以揭示營養器官葉和根養分元素的分配格局,化學計量比在不同環境下的動態平衡,為進一步研究興安落葉松對N沉降適應機制提供科學依據。
1材料和方法
1.1研究區概況
實驗地點位于大興安嶺南甕河國家級自然保護區( 125°07'55″~125°50'05″E,51°05'07″~51°39'24″N),最低海拔370 m,最高海拔1 044 m。該地處寒溫帶,屬于寒溫帶大陸性季風氣候,年平均氣溫-3 ℃,最低氣溫-48 ℃,最高溫36 ℃。年降水量500 mm左右,積溫1 500 ℃左右,無霜期90~100 d,植物生長期110 d左右,土壤為暗棕色砂礫土。樣地內優勢樹種為興安落葉松( Larix gmelinii Rupr.)和白樺( Betula platyphylla),其中興安落葉松占90%以上。
1.2實驗設計
在保護區內選擇立地條件相對一致的區域,共設置16塊20 m×20 m的實驗樣地,每兩個樣方間緩沖帶寬為10 m。共設4個梯度4個重復的施N處理,即對照(CK)、低N( LN)、中N( MN)和高N(HN),分別按0、2.5、5.0 、7.5 g /( m?2·a) 進行外源N( NH4NO3)添加處理(不包含大氣N沉降量) 。根據N處理水平,于2011年5月起,在植物生長季內(5-9月)每月月初將每個樣方所施的NH4NO3溶解于32 L純凈水中,以背式噴霧器人工均勻噴灑在林地上。為保持處理一致性,對照處理則噴灑等量的純凈水。
1.3樣品采集和處理
為了研究興安落葉松化學計量特征對N沉降的響應,于2017年7月植物生長季對樣品進行采集,此時植物生長處于旺盛期,鮮葉和凋落葉共存。在每個樣方內選取長勢良好的3株樹,上、中、下3個不同高度向陽和背陰兩個方向剪取新鮮葉片混合為一個樣品,取同期凋落葉約300 g,并用平板利鍬挖取完整的根段,放入寫好標簽的封口袋中,共取樣品36個。對采集完畢的樣品先用蒸餾水沖洗至少1次,然后用去離子水沖洗3次,去掉灰塵及泥沙等雜物。清洗后的樣品在烘箱里于105 ℃下殺青10 min,70 ℃下烘干至恒重。同一樣方內鮮葉、凋落葉、根粉碎后過100目篩,待測。使用碳氮分析儀(Multi N/C 3100,Analytikjene AG,Germany)測定樣品C、N含量,使用鉬銻抗比色法測定P含量,使用原子吸收分光光度計測定金屬元素K、Ca、Mg的含量。在本研究中,以當月凋落葉中大量營養元素的濃度來計算養分重吸收能力?[8,22]。較低的值對應于更高的吸收能力?[23]。營養吸收效率(?RE?)是以凋落葉和鮮葉中養分濃度的百分之數差來估算的?[8]。葉片養分再吸收效率(?RE?)的計算方法如下:
RE = (1-C1 /C2 )×100% 。
式中: ?C1和C2分別代表凋落葉和鮮葉中養分元素的含量。
1.4數據處理
采用Excel 2003和Origin8.5、Spss20.0進行數據處理與制圖,利用Spss20.0軟件中單因素方差分析方法對4種不同施N水平的樣地興安落葉松鮮葉、根及凋落葉養分元素含量的差異進行比較。分析均采用LSD多重比較不同組的差異;利用Pearson相關系數及線性回歸模型分析葉和根之間C、N、P含量及化學計量比之間的關系。文中顯著性水平設置為?P?= 0.05。C、N、P采用質量分數,C∶N、C∶P、N∶P均采用質量比。
2結果與分析
2.1不同施N水平下興安落葉松鮮葉、凋落葉、根養分含量及其化學計量比
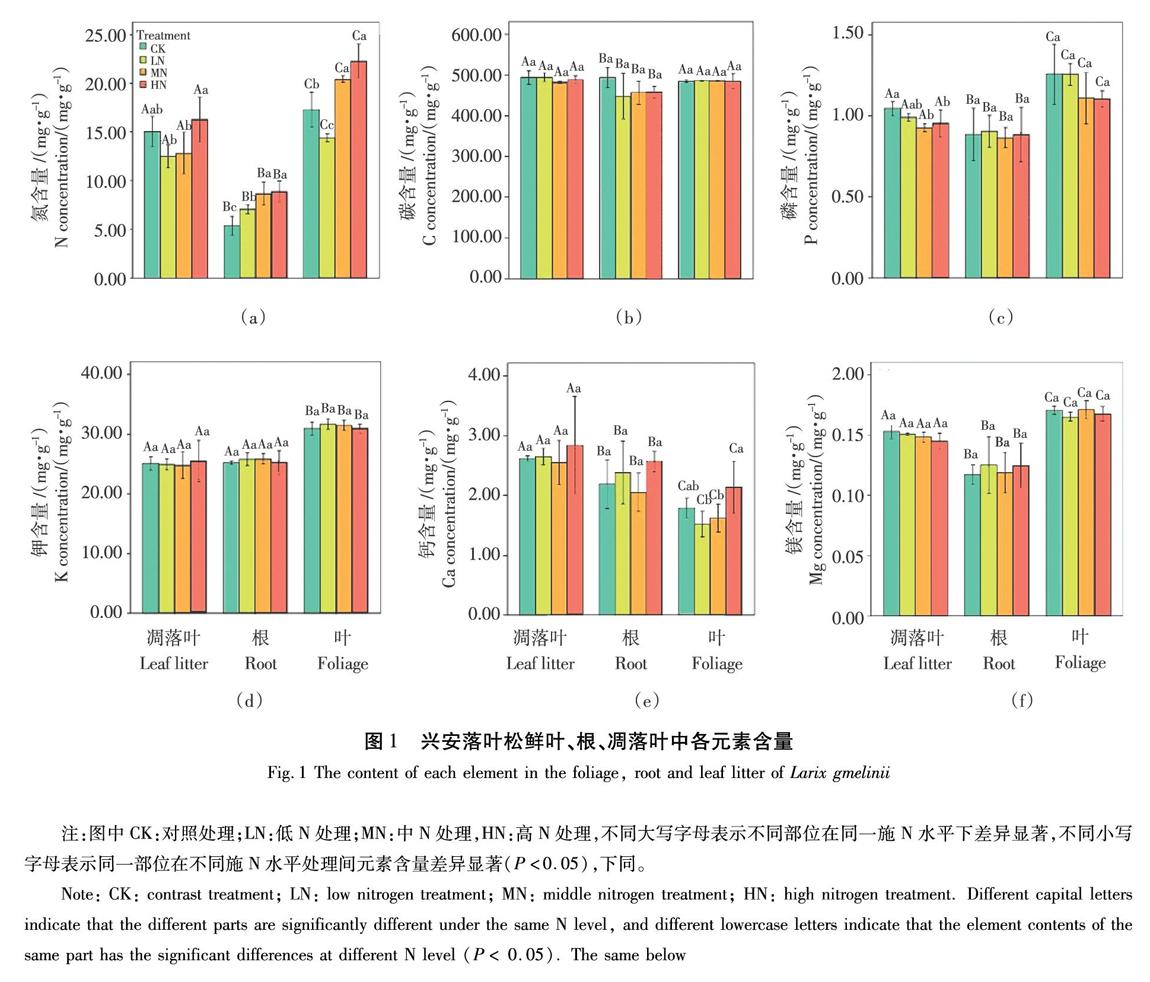
鮮葉、根及凋落葉中C、N、P含量的變化范圍分別為393.174~518.362、4.405~23.963、0.743~1.671 mg/g。其中以N的變異最大,變異系數達38.8%,C的變異系數最小,僅為4.5%。金屬元素K、Ca、Mg含量的變化范圍分別為0.23~0.33、1.32~3.61、0.1~0.18 mg/g。鮮葉和根對C、N、P、K、Ca、Mg含量均有顯著影響(?P?<0.05)(圖1)。
不同水平施N下對凋落葉、鮮葉、根C元素含量均無顯著影響,如圖1(b)所示。HN處理比LN處理下凋落葉的N含量顯著提高(?P?<0.05);LN、MN、HN處理下根N含量均顯著提高(?P?<0.05);MN和HN均提高了鮮葉N含量,如圖1(a)所示。MN和HN處理顯著降低了凋落葉P含量(?P?<0.05);各施N水平對根和鮮葉的P含量均無顯著影響,如圖1(c)所示。凋落葉、根、鮮葉的K、Mg含量在各施N水平下無顯著變化,如圖1(d)(f)所示。凋落葉和根的Ca含量在各施N水平下變化不顯著。鮮葉Ca含量在HN處理下顯著高于LN和MN處理(?P?<0.05),凋落葉和根的Ca含量在各施N水平下變化不顯著,如圖1(e)所示。
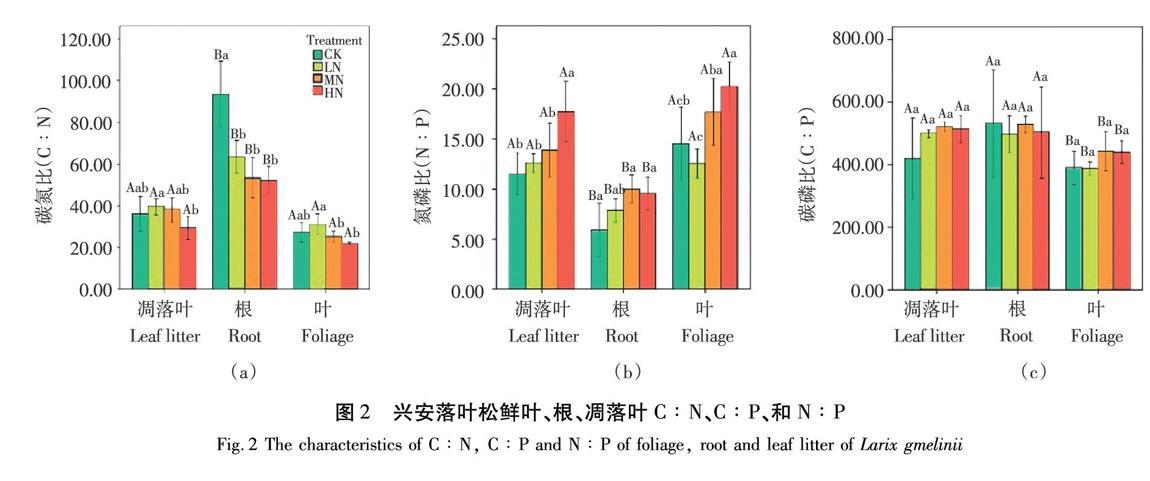
根的C∶N在LN、MN、HN處理下均顯著降低(?P?<0.05)。此外,各施N處理對鮮葉和凋落葉的C∶N呈現相同的趨勢,即鮮葉C∶N在LN處理下顯著高于HN處理組(?P?<0.05),凋落葉C∶N在LN處理下顯著高于其他處理組(?P?<0.05),如圖2(a)所示。各施N處理對鮮葉、根及凋落葉C∶P均無顯著影響,如圖2(c)所示。鮮葉N∶P在HN處理下顯著高于CK組(?P?<0.05)。根N∶P在MN和HN處理下與CK相比顯著提高(?P?<0.05)。凋落葉N∶P在HN處理下均顯著高于其它處理組(?P?<0.05),如圖2(b)所示。
2.2不同施N水平下興安落葉松鮮葉、凋落葉、根養分含量及化學計量比相關性
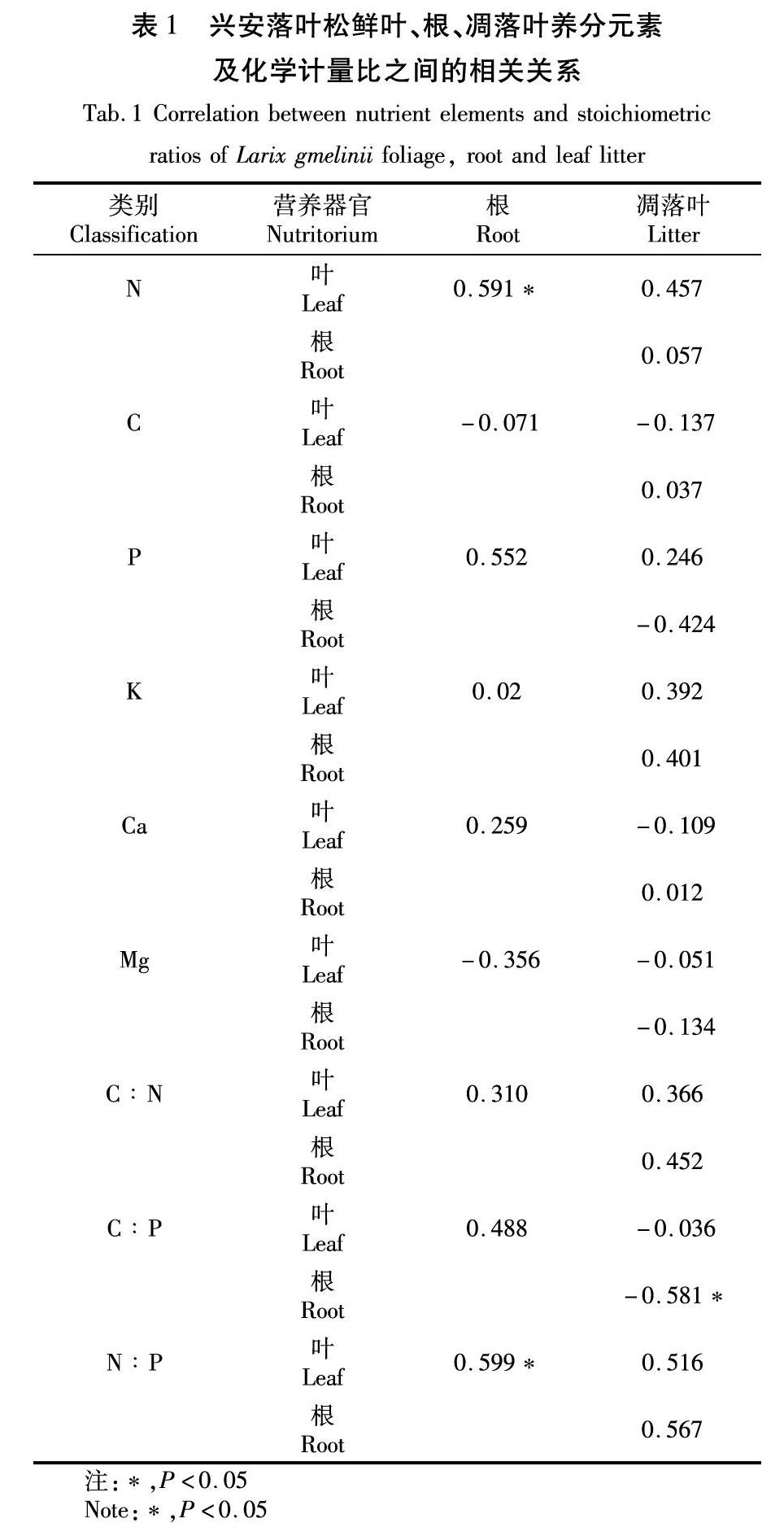
興安落葉松鮮葉、根、凋落葉C、N、P、K、Ca、Mg含量相關性多數未達到顯著性水平。鮮葉和根N具有顯著正相關性(?P?<0.05)。鮮葉、根、凋落葉C∶N化學計量比的相關性均未達到顯著水平。凋落葉和根C∶P表現為顯著負相關性(?P?<0.05)。鮮葉和根N∶P表現為顯著的正相關性(?P?<0.05),見表1。
2.3不同施N水平對興安落葉松養分重吸收率的影響
鮮葉和凋落葉中各元素含量為N>Ca>P>K>Mg。鮮葉N、P、K、Mg含量顯著高于凋落葉(?P?<0.05),鮮葉Ca含量顯著低于凋落葉(?P?<0.05),表現出施N條件下葉片對N、P、K、Mg的重吸收能力加強(圖1)。葉片N、P、K含量與凋落葉呈正相關關系,Ca、Mg含量為負相關關系。總體上,N、P、K、Mg重吸收效率分別為29%、30%、16%、8%,而Ca為-55%重吸收效率為負值。MN處理提高了興安落葉松葉片對N的重吸收效率。LN處理加劇了Ca的富集。研究發現施N并未對興安落葉松養分重吸收率產生顯著影響,如圖3所示。
N重吸收率和鮮葉N含量、N∶P之間的相關性不顯著,如圖4(a)(b)所示,P重吸收率與鮮葉P含量呈顯著正相關關系(?P?<0.05),與鮮葉N∶P呈顯著負相關關系(?P?<0.05),如圖4(c)(d)所示。興安落葉松鮮葉的N重吸收率與P重吸收率無顯著的相關關系,如圖5所示。
2.4興安落葉松養分含量與化學計量比的影響因子
通過施N和營養器官葉和根對興安落葉松C、N、P含量及其化學計量關系影響的一般(GLM)分析發現:施N對興安落葉松N含量影響極顯著(?P?<0.01),對P含量的影響未達到顯著水平。相應的C∶P受施N影響不顯著,但C∶N和N∶P受施N的影響極顯著(?P?<0.01)。營養器官葉和根對興安落葉松各元素含量,以及化學計量比均有極顯著影響(?P?<0.01)。施N與葉和根的交互作用對N含量及C∶N有極顯著的影響(?P?<0.01)(表2)。
3討論
3.1不同施N水平對興安落葉松鮮葉、凋落葉、根養分含量及相關性的影響
研究發現,在施N條件下植物C的變異系數最?小,N較大。原因可能是C是構成植物體干物質的主要成分,作為結構性物質,其受環境影響較小從而含量相對穩定變化較小。而N和P則參與植物多個生理活動,包括植物光合作用和細胞分裂等?[24]。施N條件下葉N增加能夠提升葉片內部光合作用酶的數量, 從而提高葉片光合速率。此外,N∶P可以反映植物生長受N或P的限制情況?[26-27],植物常通過對N、P的吸收變化來保持相對穩定的N∶P。所以N含量變化較大可能是在施N條件下植物通過N的含量的變化調節植物體化學計量平衡,這是一種應對環境變化的策略或是植物通過N的變化來指示植物受限制情況。
N、 P在營養器官葉和根中的分配存在顯著差異(圖1),表現為葉高于根。植物不同器官營養元素的分布,除受土壤養分供應影響外,還與相應器官的生理功能密切相關?[28]。根系是吸收營養物質的主要營養器官,將植物連接到土壤,對吸收水分和礦物質養分交換有重要作用,通常需要較高的N、P來支持新陳代謝,還要將過量N、P轉移到葉,此外由于采樣時處于植物生長季,需要保持高的光合速率,此時作為光合器官的葉就需要保持高的N含量以保證植物光合的正常進行。本研究中施N整體上使鮮葉和根N含量顯著提高,反應了施N促進興安落葉松對N的吸收,這與以往的研究結果一致?[29-31]。植物葉片的礦質元素含量取決于土壤養分的可利用性。因此在養分充足的情況下,植物更傾向于利用土壤養分。以往的研究也顯示,植物組織內的礦質元素含量與土壤中相應元素含量呈現顯著正相關關系?[32]。此外,功能群和物種也是影響葉片N、P化學計量特征及其對N添加響應的重要因素。而且在施N情況下,植物對N、P等礦質元素的利用策略因需求、競爭力和優勢度的不同也存在巨大差異?[33-34]。這些是筆者在試驗中沒有考慮到的問題。
近年來,越來越多的研究嘗試從植物功能性狀或資源經濟譜的角度來探討不同器官之間的性狀關聯, 相關研究不僅有助于理解植物各性狀之間相互作用的機制?[35]、植物生長過程中對資源的利用和分配?[28],而且對進一步預測植物對環境變化的響應具有重要意義。研究表明鮮葉和根的N含量、P含量均呈顯著正相關?[28,36]。本研究發現興安落葉松鮮葉和根N含量有顯著相關性,N∶P具有顯著的正相關關系,這與之前的研究發現一致。根和凋落葉C∶P呈顯著的負相關關系,未發現P元素在根和鮮葉之間的顯著相關性。原因可能是小尺度范圍內植物生長環境差異小,種內個體功能性狀因變異幅度較小而關聯不顯著?[37]。還有一種可能是,采集的根樣本組分復雜,其形態、壽命、生理差異巨大,是不同個體組成的高度異質的混合體?[38-39],從而影響了根與鮮葉之間相應元素的相關關系。另外,本研究在個體水平上的樣本量有限,結果可能存在一定的隨機性。植物鮮葉與細根性狀具體的關聯程度和機制還有待于進一步研究。
3.2不同施N水平對興安落葉松鮮葉C∶N、C∶P、N∶P的影響
植物體的C∶N和C∶P能顯示植物吸收營養所同化的C的能力,也可以反應植物對N和P的利用效率,一定程度也顯示了土壤養分的供應情況,因而有重要的生態學意義。正常情況下C不是限制性元素,因此影響C∶N和C∶P的主要因素是N和P含量的變化。本研究發現,鮮葉和根的C∶N在MN和HN處理下有所下降,表明施N并未提高其中N利用效率。原因可能是在生態系統N含量趨于飽和狀態時,N的持續添加超出了植物和微生物的可用限度時會減少生產力,所以隨著N輸入的增加植物生物量下降,尤其是在HN處理下。因此適度的施N在短期內有利于興安落葉松生長,N過量處理會超出植物承受的閾值,從而造成植物生理進程紊亂。與對照相比鮮葉在MN處理和HN處理下C∶P高。表明施N增加了興安落葉松對P的利用效率,指示P的短缺。
葉片是植物進行光合作用的主要器官,所以葉片N∶P的值常用來指示生態系統生產力受限制元素,也用來判斷環境對植物養分的供應情況。通過對不同植物的施肥實驗,Koerselman W?[26]認為當N∶P>16表示生態系統受P限制,N∶P<14表示生態系統受N限制,N∶P在14~16時,表示生態系統受N和P的共同限制或者同時不受二者限制。本試驗中,不同施N下興安落葉松葉片N∶P變化范圍為12~20,MN和HN處理下的N∶P明顯高于Han等?[40]研究我國753個植物種得出的N∶P平均值(14.40)和世界上植物的平均值(13.80)。而對照組得出的N∶P介于16和14之間,受N、P共同限制,隨N濃度增加,使該地受P限制加劇。原因可能是隨著N的添加葉片P含量顯著下降,或許是因為可利用性N增加,葉片N含量激增,需要吸收更多P才能達到養分平衡,但是當N負荷過重,即使是增加P的吸收機制,從長遠來看亦不能阻止N∶P的增加?[41]。
3.3不同施N水平對興安落葉松養分重吸收率的影響
植物通常會增加葉片養分濃度,但在營養豐富的環境中會減少對養分的吸收?[42]。這可能是為了回應實驗中添加的營養物質?[43]。土壤養分有效性對植物養分重吸收效率有無影響一直是生態學界爭論的焦點之一。Chapin F S、Arco J M D等?[44-45]對黑松( ?Pinus thunbergii?)的研究發現,黑松葉片養分重吸收隨土壤N有效性的降低而提高?[46]。另一些研究發現,葉片養分再吸收效率不受土壤養分有效性影響。Yowhan S?[47]的研究表明,施肥(N和P)使日本落葉松N再吸收效率提高,而剛松( ?Pinus rigida?)的N再吸收效率下降?[48]。基于這些發現,筆者預計N吸收策略將會被用于響應增加的N的可用性(從富N土壤中開發N的成本相對較低)而且重吸收策略也不會改變。研究結果表明N添加并未對興安落葉松N重吸收率產生顯著影響,但總體上呈下降趨勢(圖3),可以預料到,當環境養分供應超過植物對養分的需求時,植物將在最大程度上降低成本?[9]。因此,N吸收量的減少和凋落葉N的增加可能是N對植物生長的限制減弱和植物適應營養豐富環境的一種行為,并支持了養分重吸收率與土壤養分有效性有關這一觀點。
如預期的那樣,施N減少了凋落葉P含量,這表明采用了P重吸收策略,也表明N對P的重吸收有嚴格的控制作用?[43,49]。化學計量學穩態調節是植物適應環境變化的一種生態策略?[50]。根據化學計量理論,一種營養物質的有效性的變化必然會影響到其他營養物質的相對可用性,從而影響這些營養物質的獲取和保存。筆者觀察到,施N增加了葉片中的N∶P比值(>16),表明P限制加重。因此,為了保證其健康和化學計量的動態平衡,植物必須調整和優化P的獲取和保存以適應N利用率的變化。另外,P的重吸收率和葉片P含量呈顯著的正相關關系。Chapin F S?[51]認為就葉片養分元素及其轉移的速率來看,葉片本身N含量越高會導致葉片衰老過程中可轉移的N的占比越高,即N的轉移速率越高?[51]。但是這種規律對P卻不適用,這可能是缺P植物具有將P轉移到韌皮部來緩解P含量的匱乏的巨大潛能,這有利于植物對營養物質的轉移。而P的重吸收率與N∶P呈現負相關關系,這可能是N∶P越大,P限制越嚴重,植物需要通過降低P的重吸收率來對生活環境的狀況進行反饋,通過凋落葉歸還到土壤,來緩解N誘導的P限制。
本研究顯示除了N和P重吸收之外,葉片對K重吸收率為16%,Mg重吸收率為8%低于全球范圍K(70.1%)和Mg(28.6%)?[52]。Ca呈現富集狀態,重吸收率為-55%這與全球范圍Ca重吸收率(10.9%)不一致,但與喀斯特地區Ca重吸收率(-44%)一致?[53]。原因是Ca作為植物的一種結構元素,尤其是細胞壁中的Ca,在衰老過程中比其他元素吸收更少且Ca素不易流動便富集在凋落葉中?[54]。
總體上,實驗表明N添加增加了凋落葉N的養分含量,降低了葉片養分重吸收的能力,降低了凋落葉P的含量,提高了P的重吸收能力,但對N、P的重吸收效率影響不顯著。這一結果與以前的研究結果一致,即養分的添加對重吸收有很強的影響。但對重吸收效率沒有明顯影響?[46,55]。因此,筆者的發現支持這樣的論點,即選擇取決于衰老葉片中的殘余養分濃度,而不是比例吸收本身?[9,23]。另外Kobe R K?[56]認為研究結果迥異的原因大概是由于被用來實驗物種間的差異、生長環境的差異以及在實驗處理方法上的差異所導致的。比如,自然條件的光照、積溫、降水和病蟲害等的參與都能影響養分重吸收。還有就是,葉片在衰老過程中質量分數下降,葉面積縮水下降,所以用質量和葉面積來表征養分重吸收率存在誤差。由此可見,對于植物養分重吸收的方法和理論均有待完善。
3.4興安落葉松養分含量與化學計量比的影響因子
通過施N和各營養器官葉和根對興安落葉松C、N、P含量及其化學計量關系影響的一般線性模型(GLM)分析(表2),結果表明營養器官的葉和根是影響,興安落葉松C、N、P及化學計量比的主導因子。而N添加對興安落葉松各元素及化學計量比無顯著影響。
化學計量內穩性(Stoichiometric homoeostasis)是生態化學計量學存在的基礎理論。化學計量內穩性是一種調節機制,它的工作原理是調節生物對環境因子的響應,從而維持生態系統結構、功能的穩定性?[45]。經研究發現C、N、P化學計量比中N∶P隨著施N的增加除HN外均影響不顯著,保持了相對穩定性。這一結果表明N沉降條件下興安落葉松仍能形成穩定群落并處于優勢地位是該地區的優勢種。內穩性是其中重要的調節機制,但這一機制的作用機理有待于進一步研究。可以對植物養分與土壤養分,特別是速效養分之間關系進行動態監測以闡明其作用原理。植物養分含量及化學計量關系的影響因素眾多,其中包括植物的進化史、生活史、遺傳和不同器官的生理功能等,同時與土壤營養元素的有效供給及其在植物體內的運輸、儲存和利用等均有聯系?[57-58]。本研究僅對植物地上器官葉,地下根做了比較,對植物其他的的生理功能器官間的相關性未進行探索,這還有待于實驗進一步研究。
4結論
大興安嶺興安落葉松營養器官葉和根各養分含量存在顯著差異,表明葉和根是興安落葉松養分含量變化的主導因子。在養分含量充足的情況下植物更傾向于利用轉化成本低的養分,N添加N、P的重吸收能力有顯著影響,并且N添加對植物體N、P狀況的影響是不對稱的,對N∶P的影響大于對個體中N、P含量的影響,使得N∶P增大,加劇了P的限制。
總之,植物在尋求化學計量平衡時,可以調節外部養分獲取(根捕獲)和內部養分保存(葉片重吸收)。植物養分經濟中對根系捕獲和葉片吸收的分配依賴于養分限制的強度和類型。考慮到元素的化學計量耦合,研究表明,N負荷的增加不僅對N的獲取和保護有著重要的影響,而且對其它基本元素(如P)也有重要的影響。
【參考文獻】
[1]LIU X J, ZHANG Y, HAN W X, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7438):459-462.
[2]GALLOWAY J N, DENTENER F J, CAPONE D G, et al. Nitrogen cycles: past, present, and future[J]. Biogeochemistry, 2004, 70(2):153-226.
[3]GALLOWAY J N, TOWNSEND A R, ERISMAN J W, et al. Transformation of the nitrogen cycle: recent trends, questions, and potential solutions[J]. Science, 2008, 320(5878):889-892.
[4]STERNER R W, ELSER J J. Ecological stoichiometry: the biology of elements from molecules to the biosphere[M]. Princeton: Princeton University Press, 2002.
[5]ELSER J J, FAGAN W F, KERKHOFF A J, et al. Biological stoichiometry of plant production: metabolism, scaling and ecological response to global change[J]. New Phytologist, 2010, 186(3):593-608.
[6]REICH P B, WRIGHT I J, CAVENDERBARES J, et al. The evolution of plant functional variation: traits, spectra, and strategies[J]. International Journal of Plant Sciences, 2003, 164(3):S143-S164.
[7]AERTS R, CHAPIN F S. The mineral nutrition of wild plants revisited: a re-evaluation of processes and patterns[J]. Advances in Ecological Research, 1999, 30(8):1-67.
[8]AERTS R. Nutrient resorption from senescing leaves of perennials: are there general patterns?[J]. Journal of Ecology, 1996, 84(4):597-608.
[9]WRIGHT I J, WESTOBY M. Nutrient concentration, resorption and lifespan: leaf traits of Australian sclerophyll species[J]. Functional Ecology, 2003, 17(1):10-19.
[10]WANG M, MURPHY M T, MOORE T R. Nutrient resorption of two evergreen shrubs in response to long-term fertilization in a bog[J]. Oecologia, 2014, 174(2):365-377.
[11]HODGE A. The plastic plant: root responses to heterogeneous supplies of nutrients[J]. New Phytologist, 2004, 162(1):9-24.
[12]OLANDER L P, VITOUSEK P M. Regulation of soil phosphatase and chitinase activity by N and P availability[J]. Biogeochemistry, 2000, 49(2):175-190.
[13]BRAUN S, THOMAS V F, QUIRING R, et al. Does nitrogen deposition increase forest production? The role of phosphorus[J]. Environmental Pollution, 2010, 158(6):2043-2052.
[14]CAIRNEY J W G. Ectomycorrhizal fungi: the symbiotic route to the root for phosphorus in forest soils[J]. Plant & Soil, 2011, 344(1/2):51-71.
[15]ALDOUS A R. Nitrogen translocation in Sphagnum mosses: effects of atmospheric nitrogen deposition[J]. New Phytologist, 2002, 156(2):241-253.
[16]OSTONEN I, HELMISAARI H S, BORKEN W, et al. Fine root foraging strategies in Norway spruce forests across a European climate gradient[J]. Global Change Biology, 2011, 17(12):3620-3632.
[17]YUAN Z Y, CHEN H Y H. Negative effects of fertilization on plant nutrient resorption[J]. Ecology, 2016, 96(2):373-380.
[18]SEE C R, YANAI R D, FISK M C, et al. Soil nitrogen affects phosphorus recycling: foliar resorption and plant-soil feedbacks in a northern hardwood forest[J]. Ecology, 2015, 96(9):2488-2498.
[19]MARSCHNER H. Mineral nutrition of higher plants[M]. Salt Lake City: Academic Press, 2011.
[20]賀金生, 韓興國. 生態化學計量學:探索從個體到生態系統的統一化理論 [J]. 植物生態學報, 2010, 34(1):2-6.
HE J S, HAN X G. Ecological stoichiometry: searching for unifying principles from individuals to ecosystems[J]. Chinese Journal of Plant Ecology, 2010, 34(1):2-6.
[21]REICH P B. The world‐wide 'fast-slow' plant economics spectrum: a traits manifesto[J]. Journal of Ecology, 2014, 102(2):275-301.
[22]PRIMICIA I, IMBERT J B, TRAVER M C, et al. Inter-specific competition and management modify the morphology, nutrient content and resorption in Scots pine needles[J]. European Journal of Forest Research, 2014, 133(1):141-151.
[23]KILLINGBECK K T. Nutrients in senesced leaves: keys to the search for potential resorption and resorption proficiency[J]. Ecology, 1996, 77(6):1716-1727.
[24] NIKLAS K J, OWENS T, REICH P B, et al. Nitrogen/phosphorus leaf stoichiometry and the scaling of plant growth[J]. Ecology Letters, 2010, 8(6):636-642.
[25]HESSEN D O, ?GREN G I, ANDERSON T R, et al. Carbon sequestration in ecosystems: the role of stoichiometry[J]. Ecology, 2004, 85(5):1179-1192.
[26]KOERSELMAN W. The vegetation N: P ratio: a new tool to detect the nature of nutrient limitation[J]. Journal of Applied Ecology, 1996, 33(6):1441-1450.
[27]ELSER J J, FAGAN W F, DENNO R F, et al. Nutritional constraints in terrestrial and freshwater food webs[J]. Nature, 2000, 408(6812):578-580.
[28]KERKHOFF A J, FAGAN W F, ELSER J J, et al. Phylogenetic and growth form variation in the scaling of nitrogen and phosphorus in the seed plants[J]. The American Naturalist, 2006, 168(4):E103-22.
[29]MAGILL A H, ABER J D, BERNTSON G M, et al. Long-term nitrogen additions and nitrogen saturation in two temperate forests[J]. Ecosystems, 2000, 3(3):238-253.
[30] MCNULTY S G, BOGGS J, ABER J D, et al. Red spruce ecosystem level changes following 14 years of chronic N fertilization[J]. Forest Ecology & Management, 2005, 219(2):279-291.
[31]ROWE E C, SMART S M, KENNEDY V H, et al. Nitrogen deposition increases the acquisition of phosphorus and potassium by heather Calluna vulgaris[J]. Environmental Pollution, 2008, 155(2):201-207.
[32]REICH P B, OLEKSYN J. Global patterns of plant leaf N and P in relation to temperature and latitude[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30):11001-11006.
[33]TILMAN D. Constraints and tradeoffs: toward a predictive theory of competition and succession[J]. Oikos, 1990, 58(1):3-15.
[34]G?SEWELL S, KOERSELMAN W. Variation in nitrogen and phosphorus concentrations of wetland plants[J]. Perspectives in Plant Ecology Evolution & Systematics, 2002, 5(1):37-61.
[35]EVINER V T, III F S C. Functional matrix: a conceptual framework for predicting multiple plant effects on ecosystem processes[J]. Annual Review of Ecology Evolution & Systematics, 2003, 34(34):455-485.
[36]GENG Y, WANG L, JIN D, et al. Alpine climate alters the relationships between leaf and root morphological traits but not chemical traits[J]. Oecologia, 2014, 175(2):445-455.
[37]徐冰, 程雨曦, 甘慧潔,等.內蒙古錫林河流域典型草原植物葉片與細根性狀在種間及種內水平上的關聯 [J. 植物生態學報, 2010, 34(1):29-38.
XU B, CHENG Y X, GAN H J, et al. Correlations between leaf and fine root traits among and within species of typical temperate grassland in Xilin River Basin, Inner Mongolia[J]. Chinese Journal of Plant Ecology, 2010, 34(1):29-38.
[38]PREGITZER K S, DEFOREST J L, BURTON A J, et al. Fine root architecture of nine North American trees[J]. Ecological Monographs, 2002, 72(2):293-309.
[39]GUO D, LI H, MITCHELL R J, et al. Fine root heterogeneity by branch order: exploring the discrepancy in root turnover estimates between minirhizotron and carbon isotopic methods[J]. New Phytologist, 2008, 177(2):443-456.
[40]HAN W, FANG J, GUO D, et al. Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China[J]. New Phytologist, 2010, 168(2):377-385.
[41]HEERWAARDEN L M V, TOET S, AERTS R. Current measures of nutrient resorption efficiency lead to a substantial underestimation of real resorption efficiency: facts and solutions[J]. Oikos, 2010, 101(3):664-669.
[42]HAYES P, TURNER B L, LAMBERS H, et al. Foliar nutrient concentrations and resorption efficiency in plants of contrasting nutrient acquisition strategies along a 2 million year dune chronosequence[J]. Journal of Ecology, 2014, 102(2):396-410.
[43]MAO R, ZENG D H, ZHANG X H, et al. Responses of plant nutrient resorption to phosphorus addition in freshwater marsh of Northeast China[J]. Scientific Reports, 2015, 5(5):8097.
[44]ENOKI T, KAWAGUCHI H. Nitrogen resorption from needles of Pinus thunbergii, Parl. growing along a topographic gradient of soil nutrient availability[J]. Ecological Research, 2010, 14(1):1-8.
[45]CHAPIN F S, MOILANEN L. Nutritional controls over nitrogen and phosphorus resosrption from Alaskan birch leaves[J]. Ecology, 1991, 72(2):709-715.
[46]LI X, LIU J, FAN J, et al. Combined effects of nitrogen addition and litter manipulation on nutrient resorption of Leymus chinensis in a semi-arid grassland of northern China[J]. Plant Biology, 2015, 17(1):9-15.
[47]YOWHAN S, IMKYUN L, SOUNGRYOUL R. Nitrogen and phosphorus dynamics in foliage and twig of pitch pine and Japanese larch plantations in relation to fertilization[J]. Journal of Plant Nutrition, 2000, 23(5):697-710.
[48]趙瓊, 劉興宇, 胡亞林, 等. 氮添加對興安落葉松養分分配和再吸收效率的影響[J]. 林業科學, 2010,46(05):14-19.
ZHAO Q, LIU X Y, HU Y L, et al. Effects of nitrogen addition on nutrient allocation and reuptake efficiency of Larix gmelini[J]. Forestry Science, 2010, 46(5):14-19.
[49]L??X T, HAN X G. Nutrient resorption responses to water and nitrogen amendment in semi-arid grassland of Inner Mongolia, China[J]. Plant & Soil, 2010, 327(1/2):481-491.
[50]YU Q, ELSER J J, HE N, et al. Stoichiometric homeostasis of vascular plants in the Inner Mongolia grassland[J]. Oecologia, 2011, 166(1):1-10.
[51]CHAPIN F S, KEDROWSKI R A. Seasonal changes in nitrogen and phosphorus fractions and autumn retranslocation in evergreen and deciduous taiga trees[J]. Ecology, 1983, 64:376-391.
[52]VERGUTZ L, MANZONI S, PORPORATO A, et al. Global resorption efficiencies and concentrations of carbon and nutrients in leaves of terrestrial plants[J]. Ecological Monographs, 2012, 82(2):205-220.
[53]LIU C, LIU Y, GUO K, et al. Concentrations and resorption patterns of 13 nutrients in different plant functional types in the karst region of south-western China[J]. Annals of Botany, 2014, 113(5):873-885.
[54]KAZAKOU E, GARNIER E, NAVAS M, et al. Components of nutrient residence time and the leaf economics spectrum in species from Mediterranean old-fields differing in successional status[J]. Functional Ecology, 2010, 21(2):235-245.
[55]KOZOVITS A R, BUSTAMANTE M M C, GAROFALO C R, et al. Nutrient resorption and patterns of litter production and decomposition in a Neotropical Savanna[J]. Functional Ecology, 2007, 21(6):1034-1043.
[56]KOBE R K, LEPCZYK C A, IYER M. Resorption efficiency decreases with increasing green leaf nutrients in a global date set[J]. Ecology, 2005, 86(10):2780-2792.
[57]周紅艷, 吳琴, 陳明月,等. 鄱陽湖沙山單葉蔓荊不同器官碳、氮、磷化學計量特征 [J. 植物生態學報, 2017, 41(4):461-470.
ZHOU H Y, WU Q, CHEN M Y. Stoichiometric characteristics of carbon, nitrogen and phosphorus in different organs of Vitex mongolicum in Sandy Mountain, Poyang Lake[J]. Journal of Plant Ecology, 2017, 41(4): 461-470.
[58]劉芳,葛江麗,施漢鈺,等.西洋參地氮磷鉀含量變化規律研究[J].林業科技,2017,42(6):19-21.?LIU F,GE J L,SHI H Y, et al. Study on changing rule of nitrogen, phosphorus and potassium content in ?Panax quinquefolium??field[J]. Forestry Science & Technology,2017,42(6):19-21.

