生髓健骨膠囊對酒精性骨質疏松大鼠骨密度、骨礦含量影響的研究
任樹軍 梁彥林 姜磊 任明輝 王墉琦 耿慧春 于雪峰 譚福柱*
1.黑龍江中醫藥大學附屬第一醫院,黑龍江 哈爾濱 150040 2.黑龍江中醫藥大學研究生院,黑龍江 哈爾濱 150040 3.西安市中醫醫院,陜西 西安 710001 4.南昌大學第四附屬醫院,江西 南昌 330003
骨質疏松癥(osteoporosis,OP)一詞由Pommer[1]于1885年首先提出,1950年以來,許多學者都對其進行了比較精確的闡述。美國學者W.A.Peck認為骨量丟失,骨組織顯微結構及骨脆性改變引起骨折風險增加的疾病稱為OP;日本的井上哲郎認為OP的一個典型特征為骨組織內單位體積的骨量減少。對于OP明確的定義是1993年在香港舉辦的骨質疏松國際研討會上提出的,并得到醫學界大多數專家的認可[2]。在流行病學研究[3-4]中發現,過度飲酒能使骨密度降低,對年輕女性的危害較絕經后老年女性的危害更加顯著,屬于繼發性骨質疏松范疇。酒精濫用和酒精依賴導致的骨壞死、骨質疏松、骨折發生率正逐漸增加,通過研究骨密度(bone mineral density,BMD)、骨礦含量(bone mineral content,BMC)的變化,探討酒精對骨代謝的作用機制,無疑對治療酒精性骨質疏松(alcoholic osteoporosis,AOP)[5]具有更重要的意義。
本研究通過建立酒精性骨質疏松癥大鼠模型,觀察不同時期各組實驗大鼠BMD、BMC的變化,進一步探討生髓健骨膠囊在防治AOP大鼠方面的作用機制,為臨床應用提供實驗理論依據。
1 材料與方法
1.1 實驗動物及分組
選用成年雄性(清潔級)SD大鼠120只,體重(220±20)g,平均約6個月月齡,購自黑龍江中醫藥大學動物實驗中心[SCXK(黑)20170130]。根據隨機法將實驗大鼠分為正常對照組、模型組、碳酸鈣+阿法D3組(西藥對照組)及生髓健骨膠囊組(中藥干預組),每組各30只,在適宜的環境中分籠適應性喂養1周后,稱大鼠體重。
1.2 實驗方法
正常對照組每天用等量生理鹽水(500 mL/袋,出廠批號:B1708018,四川太平洋藥業有限公司)進行灌胃,上午、下午各1次;模型組每天上午用等量白酒(500 mL/瓶,紅星牌二鍋頭,55°,標準號:GB/T20822,北京紅星股份有限公司生產)灌胃,下午用與正常對照組相同量的生理鹽水灌胃,各1次;西藥對照組每天上午用等量白酒(同模型組)灌胃,下午給予碳酸鈣(500 mg/片,國藥準字:H10980201,吉林萬通藥業集團)+阿法D3[0.25 μg/粒,國藥準字:J20080612,以色列梯瓦制藥工業(TEVA)有限公司(昆明貝克諾頓公司分裝)]用生理鹽水(同正常對照組)配成混懸液灌胃給藥,各1次;中藥干預組每天上午用等量白酒(同模型組)灌胃,下午給予生髓健骨膠囊(0.35 g/粒,批準文號:黑衛藥制字Z20110036,黑龍江中醫藥大學附屬第一醫院)用生理鹽水(同正常對照組)配成混懸液灌胃給藥,各1次。
各組實驗大鼠均按10 mL/kg容積灌胃給藥,白酒按約含純乙醇4.4 g/(kg·d)計量,共持續給藥16周。實驗期間各組大鼠均給予規定(全價標準)營養飼料,自由進食水。各組實驗大鼠每周末通過稱量體重變化來調整給藥劑量。嚴格遵循動物實驗倫理道德,于造模8、12、16周末,將各組實驗大鼠分別采取頸椎脫臼法處死10只,在無菌操作環境下取出左側股骨,將殘余組織剔除后,用生理鹽水沖洗,再用無菌濕紗布包敷,最后用雙能X線骨密度儀(DEXA)檢測。將股骨上端放置于雙能X線骨密度儀(DEXA)探頭下,用小動物學軟件進行掃描處理,對各組大鼠左側股骨的BMD、BMC進行檢測,最后打印出測定結果。
1.3 主要儀器
采用美國通用(Lunar)公司生產的雙能X線骨密度測量儀(PLODIGY-型)附帶的小動物軟件測定實驗大鼠的骨密度;游標卡尺由桂林廣陸數測股份有限公司生產(精確度0.02 mm、長150 mm),標準號:GB/T21389-2008。
1.4 統計學方法
實驗數據應用統計軟件SPASS 22.0進行(組間單因素ANOVA)檢驗,行t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠8周末檢測股骨BMD、BMC的結果比較(表1)
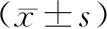


組別例數BMD/(g/cm2)BMC/(g/cm2)正常對照組100.272±0.0220.149±0.017模型組100.228±0.027★★0.116±0.008★★西藥對照組100.239±0.025▲0.123±0.018▲中藥干預組100.244±0.021▲▲●0.130±0.019▲▲●F值-12.73327.746P值-<0.001<0.001
注:與正常對照組相比,★P<0.05,★★P<0.01;與模型組相比,▲P<0.05,▲▲P<0.01;與西藥對照組相比,●P<0.05,●●P<0.01。
2.2 各組大鼠12周末檢測股骨BMD、BMC結果的比較(表2)
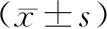


組別例數BMD/ (g/cm2)BMC/ (g/cm2)正常對照組100.271±0.0180.148±0.037模型組100.222±0.023★★0.109±0.015★★西藥對照組100.235±0.021▲0.119±0.025▲中藥干預組10 0.253±0.017▲▲●0.135±0.026▲▲●F值-29.94017.164P值- <0.001<0.001
注:與正常對照組相比,★P<0.05,★★P<0.01;與模型組相比,▲P<0.05,▲▲P<0.01;與西藥對照組相比,●P<0.05,●●P<0.01。
2.3 各組大鼠16周末檢測股骨BMD、BMC結果的比較(表3)
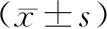


組別例數BMD/(g/cm2)BMC/(g/cm2)正常對照組100.270±0.0210.147±0.033模型組100.206±0.026★★0.098±0.012★★西藥對照組100.230±0.024▲0.120±0.021▲中藥干預組100.259±0.020▲▲●0.144±0.022▲▲●F值-15.9909.754P值-<0.001<0.001
注:與正常對照組相比,★P<0.05,★★P<0.01;與模型組相比,▲P<0.05,▲▲P<0.01;與西藥對照組相比,●P<0.05,●●P<0.01。
2.4 造模干預8、12、16周末骨密度指標檢測結果
模型組BMD、BMC與對照組相比均有不同程度的下降,且差異有統計學意義(P<0.01),結果表明乙醇能夠引起實驗大鼠骨量減少,BMD、BMC下降;中藥干預組、西藥對照組的BMD、BMC分別與模型組相比明顯升高(P<0.01、P<0.05),且中藥干預組優于西藥對照組,差異有統計學意義(P<0.05)。
BMD能直接反應骨礦物質的變化,與BMC息息相關。BMD降低,骨強度減低,骨脆性增加,骨折風險升高。因此,BMD是評估臨床療效的主要依據,也是骨質疏松危險性的重要標志。當骨量丟失超過5%,即可被骨密度儀(雙能X線)檢測出。
3 討論
3.1 酒精性骨質疏松(AOP)概述
AOP目前是一種發病機制尚不清楚的骨代謝疾病。現代研究表明長期過量的酒精攝入將通過多途徑影響骨代謝平衡,使成骨減少、破骨增加,導致骨量減少。過量飲酒會帶來以下影響[5]:①對鈣調節激素[1,25(OH)2D3、降鈣素及甲狀旁腺激素]的影響;②對腎上腺皮質類固醇激素的影響;③對性腺功能產生的影響;④對骨細胞的影響:抑制成骨細胞,促進破骨細胞;⑤對肝功能的影響:使其合成蛋白能力下降、合成IGF-1不足、增加其多種激素代謝酶的活性;⑥對營養的影響。出現不同部位、不同程度的骨骼肌肉或關節疼痛、大多數伴有乏力、軀體各方向活動受限或雙下肢抽筋等是AOP主要的臨床表現,但多無關節的紅腫、變形[6-7]。AOP在祖國醫學中并無此病名,應屬于中醫學中“骨痿” “骨枯” “骨極”等病的范疇[8-10]。此病多為患者素體腎氣虧虛,偏嗜飲酒發為本病。酒乃熟谷之液、水谷之精。偏嗜飲酒,酒邪乃濕熱之邪,易損傷中焦脾胃。中焦失于運化,濕熱內生,蘊久化火,火曰炎上,可導致上焦心肝火旺。久則傷腎,使腎氣陰虧虛,氣機不暢,血行失運,血受熱煎則為瘀[10]。血瘀而四肢百骸失于濡養,瘀久化熱熏灼骨髓,則骨枯髓減,發為骨痿[11-12]。酒精在體內影響氣血精液、臟腑經絡的生理功能,使肝脾腎俱損,筋肉骨骼失于濡養。故AOP病位在骨,與肝腎脾等臟生理功能失調密切相關。其病因包括內因和外因,內因為素體腎氣虧虛,外因為過量飲酒。其主要病機為腎虛血瘀、氣陰虧虛[13]。
3.2 生髓健骨膠囊對BMD、BMC的影響
生髓健骨膠囊為臨床治療AOP的經驗方[14,18],具有補腎壯骨、健脾益氣、活血通絡的作用,正適合AOP的病因病機。現代研究表明方中鹿角膠、龜板、龍骨、牡蠣富含多種微量元素、氨基酸等,是骨組織合成所必需的物質;用中藥葛根解酒已有千年歷史,而且葛根素能夠抑制骨髓基質干細胞向脂肪細胞分化,保持其成骨分化的能力[15];黃芪、丹參、當歸具有抑制血小板聚集并改善微循環的作用;白術、熟地能提高機體清除自由基的能力;郁金能減輕高血脂,對肝有保護作用;牛膝用于活血通經以鎮痛,可增大骨小梁密度,減小骨髓腔面積。前期研究證實[16]其能下調骨組織中PPARγ2mRNA基因的表達,抑制MSCs的成脂分化,促進成骨細胞分化,防治骨量丟失。上調AOP大鼠小腸粘膜VDRmRNA的表達[17],促進腸鈣、磷的吸收,維持鈣、磷的平衡;補腎健脾益氣法可以提高AOP大鼠BMD和BMC含量,能夠抑制骨礦物質丟失[18],明顯改善AOP大鼠的癥狀,但其確切作用機制仍需進一步深入研究。
實驗結果表明,模型組BMD、BMC顯著降低,通過中藥或西藥干預后BMD、BMC均有不同程度的升高,且中藥干預組的療效優于西藥對照組。本研究表明生髓健骨膠囊可以提高AOP大鼠BMD,增加BMC,抑制骨礦物質的丟失,增強骨的強度,從而預防骨折的發生,值得臨床借鑒應用。

