‘保羅蘭’睡蓮花粉離體萌發及花粉管生長的研究
毛立彥,唐毓瑋,謝振興,龍凌云,黃秋偉,陸祖正,於艷萍,蘇 群,丁麗瓊*
(1.廣西壯族自治區亞熱帶作物研究所,廣西 南寧 530001;2.廣西壯族自治區農業科學院 花卉研究所,廣西 南寧 530007)
【研究意義】睡蓮NymphaeaL.是睡蓮科睡蓮屬植物的總稱,屬于多年生草本植物[1],花態多樣,花色艷麗,具有觀賞價值,主要用于城市水景綠化。睡蓮屬植物主要以生態學為基礎進行分類,可分為Nymphaea、Anecphya、Brachyceras、Hydrocallis、Lotos等5個亞屬[2-5]。其中,Brachyceras亞屬睡蓮的種、變種和栽培品種甚多[6],是重要的種質資源,對其花粉的研究對雜交育種的成敗具有指導意義。【前人研究進展】Brachyceras亞屬睡蓮‘保羅蘭’Nymphaea‘Paul Stetson’適宜廣西的氣候環境,群體花期長達10個月以上,目前在廣西武宣縣小規模種植。花粉的活力是指花粉具有萌發和生長發育的能力[7-8],鑒定花粉生活力的方法主要有花粉離體培養法、染色法(如I2-KI染色、TTC染色),花粉離體培養法是最準確的鑒定花粉活力的方法[9-11]。關于睡蓮花粉離體培養的研究報道較少,趙其龍等[12]對Lotos亞屬的柔毛齒葉睡蓮花粉萌發的研究發現,最適宜的離體培養基是60 mg/L蔗糖+15 mg/L H3BO3。5 %蔗糖+15 mg/L H3BO3+20 mg/L CaCl2+1 %瓊脂為Nynphaea亞屬睡蓮花粉離體萌發的最佳培養基[13]。楊夢飛等[14]采用離體培養法測定了不同亞屬睡蓮的花粉活力,其中埃及藍睡蓮(Brachyceras亞屬)在各個組分的培養液中均無法萌發。睡蓮花粉活力的研究可為睡蓮雜交親和性,新品種培育,基因庫的保存等研究提供參考依據[15-16]。【本研究切入點】目前,有關測定‘保羅蘭’Nymphaea‘Paul Stetson’花粉在不同培養基中的萌發率和花粉管長度,觀測花粉管的生長過程的研究較少報道。【擬解決的關鍵問題】旨在篩選出適宜Nymphaea‘Paul Stetson’睡蓮花粉萌發的培養基,為睡蓮的花粉活力檢測和的雜交育種的親本選擇提供參考依據。
1 材料與方法
1.1 試驗材料
試驗材料為廣西壯族自治區亞熱帶作物研究所的睡蓮種質資源圃的‘保羅蘭’睡蓮Nymphaea‘Paul Stetson’。
1.2 試驗方法
共種植‘保羅蘭’睡蓮25株,株距2 m,在花蕾時期做套袋處理,避免昆蟲攜帶花粉干擾試驗。‘保羅蘭’睡蓮具有早上綻放,夜間閉合的特性,花開后第2天再開時,于早上8:00-9:00采摘花粉成熟的花朵帶回實驗室內,從每朵花中選擇3枚成熟的花藥,將其中的花粉均勻抖落在干燥培養皿中并混勻,等待檢測。
1.3 測定項目及方法
1.3.1 離體培養基最佳組分 采用雙因素試驗篩選最佳培養基[17]。培養基用水為雙蒸餾水,蔗糖設置3個濃度梯度:0、100和200 g/L;H3BO3設置3個濃度梯度0、20和40 mg/L,共9個處理。花粉離體培養4 h后進行鏡檢,根據9個處理的培養基培養效果,確定蔗糖和H3BO3的較佳配比,在此基礎上分別加入0、20、60和100 mg/L的CaCl2,進一步對比花粉萌發率,探討CaCl2對花粉活力的影響,并篩選出最佳的培養基。
1.3.2 花粉的收集與離體萌發 在含有700 μl液體培養基的1 mL離心管中加入適量新鮮花粉,置于30 ℃培養室中,光照條件下自然培養6 h,每隔1 h觀測1次。將離心管搖勻,用移液槍吸取50 μl花粉液滴在載玻片上,進行鏡檢。
1.3.3 花粉萌發率統計以及花粉管長度測定 每個玻片隨機選取7個不重復的視野,每個視野花粉數量不少于40粒,以花粉管長度大于花粉粒直徑視為萌發。使用Image-Pro Plus 6.0進行花粉粒的計數以及測量花粉管的長度。
萌發率(%)=(視野內萌發花粉數/視野內花粉總數)×100
1.3.4 花粉離體培養的最佳時間 鏡檢最佳培養基培養1、2、3、4、5和6 h的花粉,分析花粉萌發率和花粉管生長的趨勢,確立最佳的培養時間。
1.4 統計分析
試驗數據采用Excel 2013 進行統計與制圖,采用SPSS 18.0進行雙因素方差分析。
2 結果與分析
2.1 不同濃度的蔗糖和H3BO3對花粉離體萌發的影響
9組花粉離體培養基的試驗結果如表1所示,花粉離體萌發率非常低,均不足10 %,在僅有蔗糖或僅有H3BO3處理的單因素作用下,花粉管生長有限,平均長度不足60 μm。100 g/L蔗糖+20 mg/LH3BO3的培養基中,睡蓮花粉的萌發率較高,達到8.34 %;100 g/L蔗糖+40 mg/L H3BO3的培養基中,睡蓮花粉管的平均長度較長,達到179.9 μm。
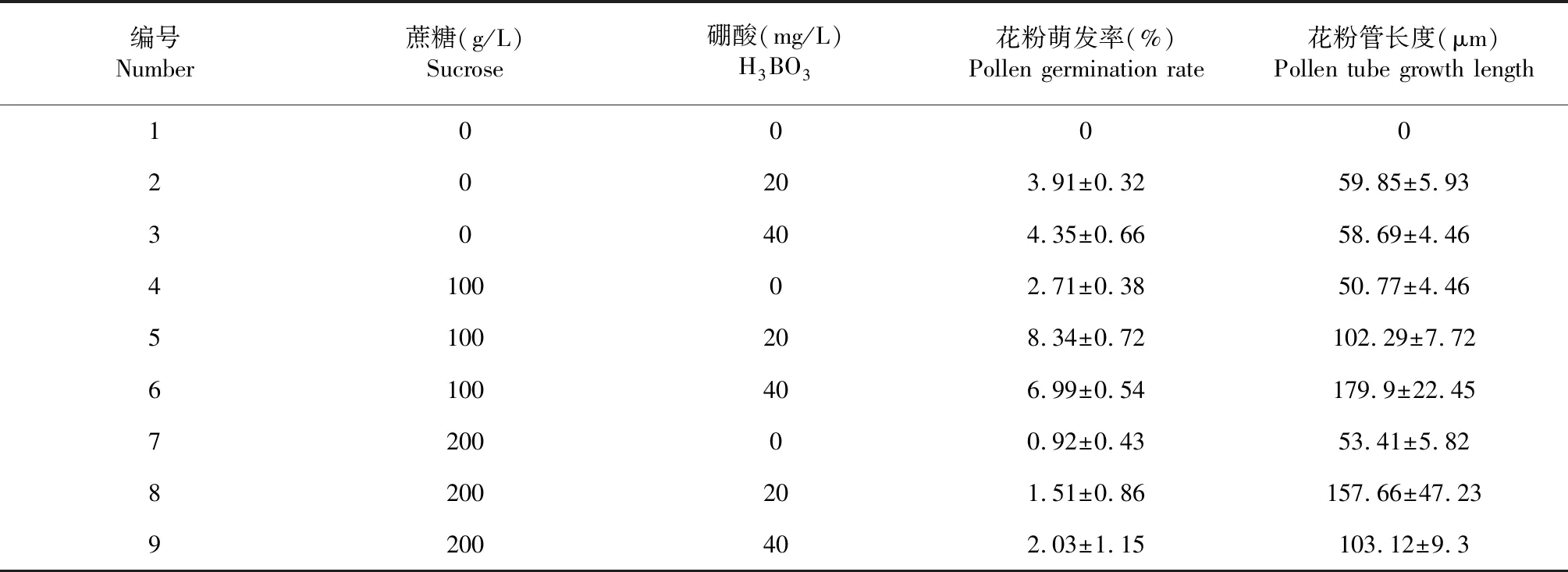
表1 蔗糖和H3BO3對花粉萌發率和花粉管生長的影響
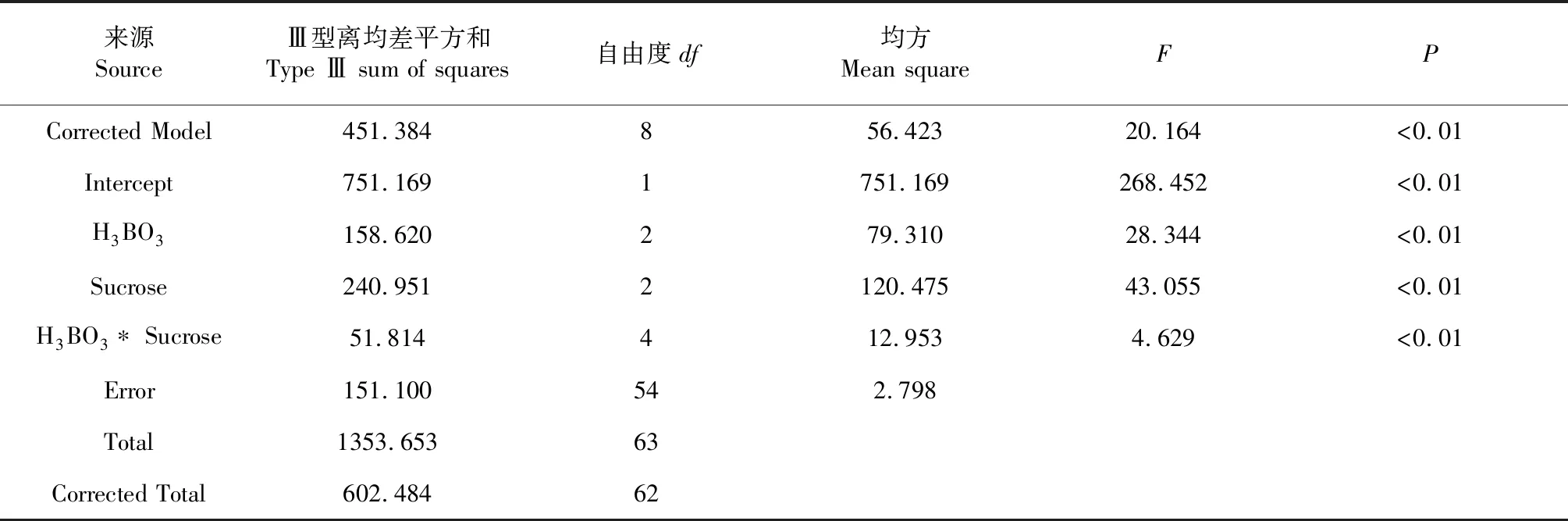
表2 H3BO3和蔗糖的主體間效應檢驗結果
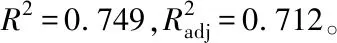
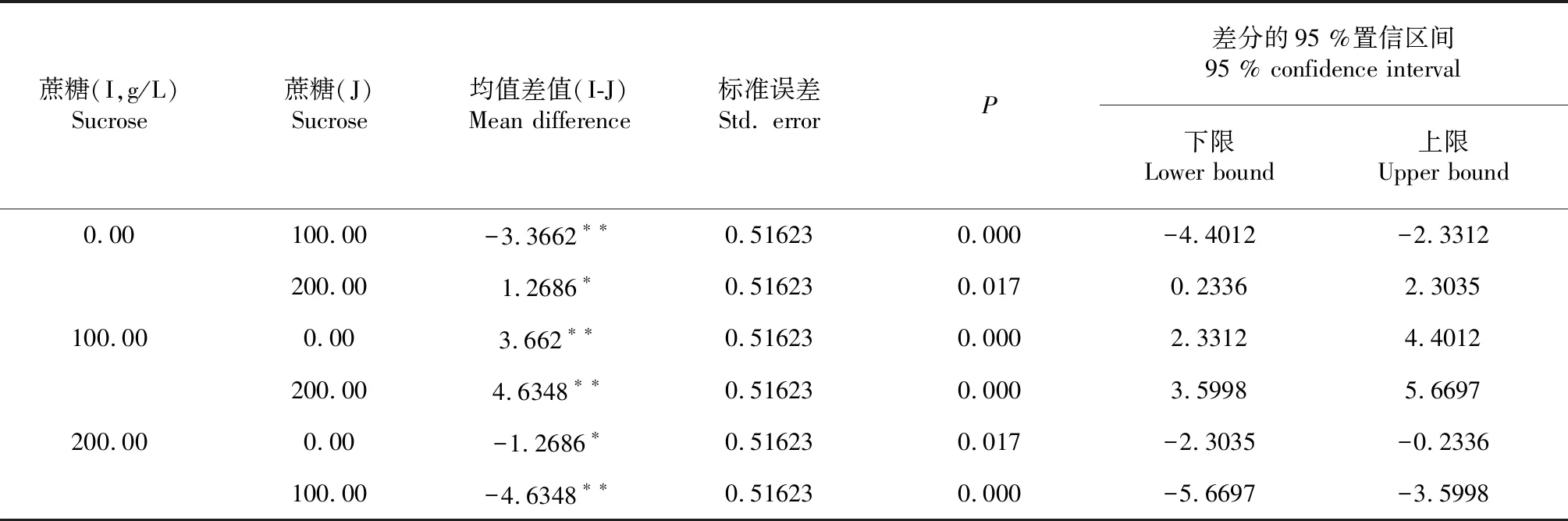
表3 LSD比較結果(主效應Sucrose)
注:*表示均值差值在0.05級別上顯著,**表示均值差值在0.01級別上顯著。
Note:,* mean difference is significant at 0.05 level, ** mean difference is significant at 0.01 level.
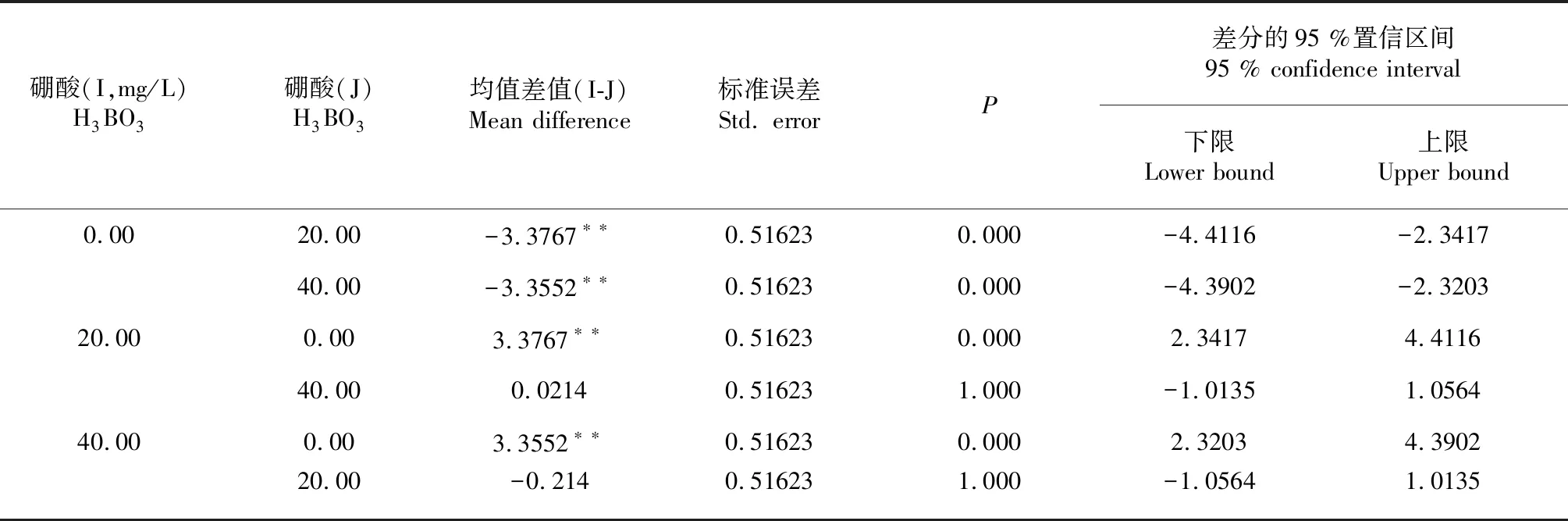
表4 LSD比較結果(主效應H3BO3)
注:*表示均值差值在0.05級別上顯著,**表示均呈差值在0.01級別上顯著。
Note: * mean difference is significant at 0.05 level, ** mean difference is significant at 0.01 level.
采用SPSS 18.0進行不同濃度的蔗糖和H3BO3處理對花粉萌發率影響的雙因素方差分析,如表2所示,不同濃度的蔗糖或H3BO3處理對花粉的離體萌發存在極顯著的影響(P<0.01,下同),并且2個因素的交互作用極顯著。
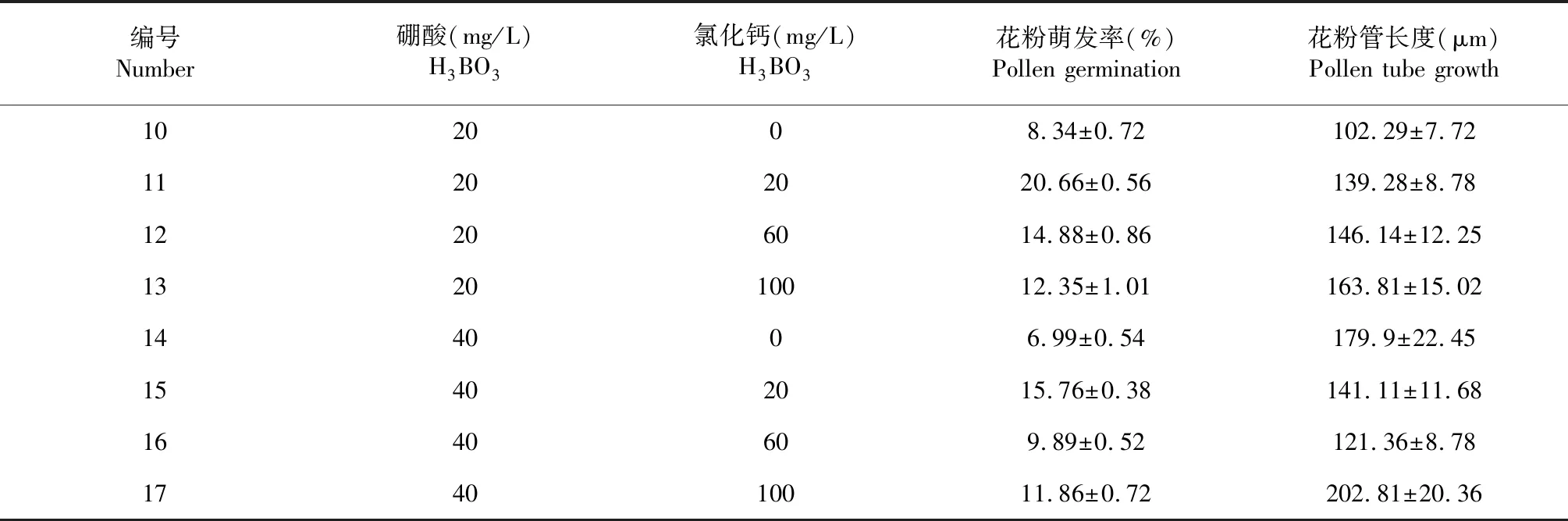
表5 H3BO3和CaCl2對花粉萌發率和花粉管生長的影響
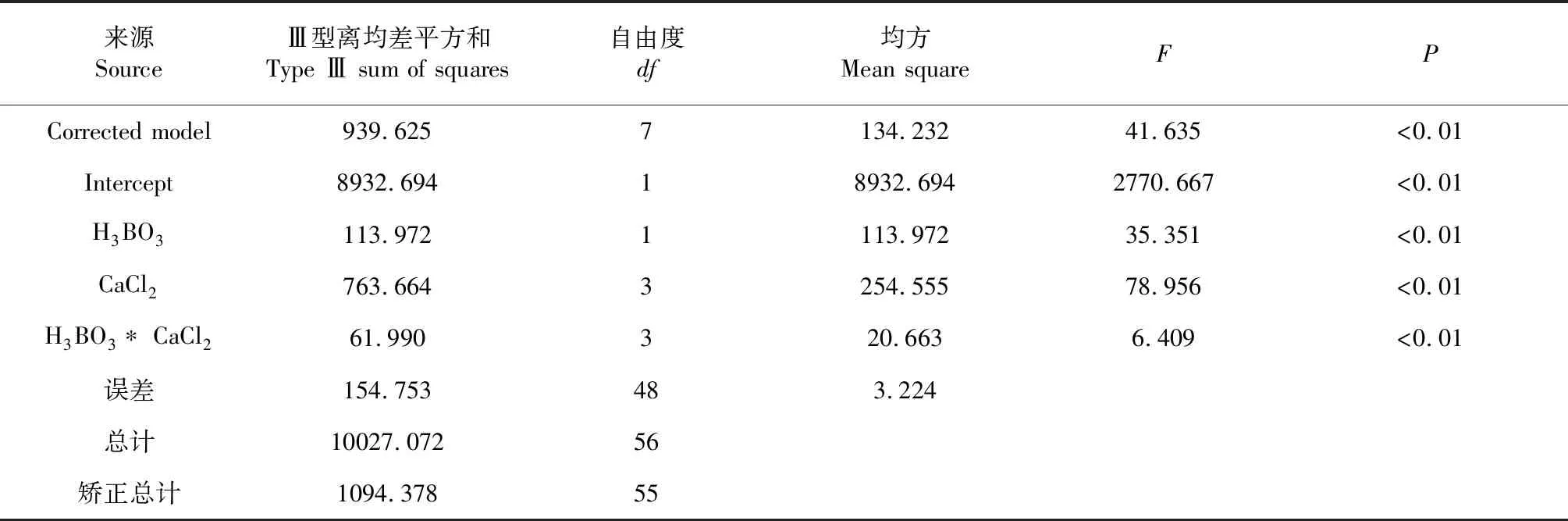
表6 H3BO3和CaCl2主體間效應檢驗結果
再進一步采用LSD檢驗法進行多重比較,主效應分析結果表明,在試驗范圍內,100 g/L的蔗糖處理適宜花粉萌發,與0及200 g/L的蔗糖處理之間均存在極顯著差異,200 g/L的蔗糖處理存在抑制作用(表3);0 mg/L H3BO3的處理與20、40 mg/L H3BO3的處理之間均存在極顯著差異,20與40 mg/L H3BO3的處理之間無顯著差異。H3BO3的加入能顯著促進花粉的萌發,20和40 mg/L的H3BO3的處理均適宜睡蓮花粉的萌發(表4)。
2.2 不同H3BO3和CaCl2的濃度對花粉萌發的影響
根據蔗糖、H3BO3的主效應分析結果(表3、表4),進一步進行H3BO3和CaCl2處理的雙因素試驗,硼酸濃度設置2個水平:20、40 mg/L,CaCl2濃度設置4個水平:0(CK)、20、60及100 mg/L。試驗結果如表5所示。采用SPSS 18.0進行不同濃度的H3BO3和CaCl2處理對花粉萌發率影響的雙因素方差分析(表6),不同濃度的H3BO3或CaCl2處理對花粉的離體萌發存在極顯著的影響,并且兩個因素存在極顯著的交互作用。
再進一步采用LSD檢驗法對不同濃度的CaCl2處理進行簡單的主效應分析(表7),在不同H3BO3濃度的水平上,對CaCl2進行簡單主效應分析,結果表明:CaCl2能促進花粉的萌發,在試驗范圍內,20 mg/L的CaCl2處理較適宜花粉的離體萌發,在不同濃度的H3BO3水平上,與0、60和100 mg/L的CaCl2的處理均存在極顯著的差異,在20 mg/L H3BO3的水平上,隨著CaCl2濃度的增高,促進花粉萌發的效果逐步減弱。
2.3 離體萌發過程中花粉萌發率及花粉管長度的變化情況
如圖1所示,花粉萌發率在1~4 h內快速上升,從11.30 %±1.24 %上升至20.66 %±0.56 %,4~6 h時,萌發率相對平穩,維持在20 %左右。花粉管的平均長度在培養1~2 h時迅速增長,從97.84 μm上升至145.22 μm,2~4 h時,花粉管平均長度不變,4 h以后花粉管平均長度略有下降。綜上所述,最佳的鏡檢時間可以設置為4 h。
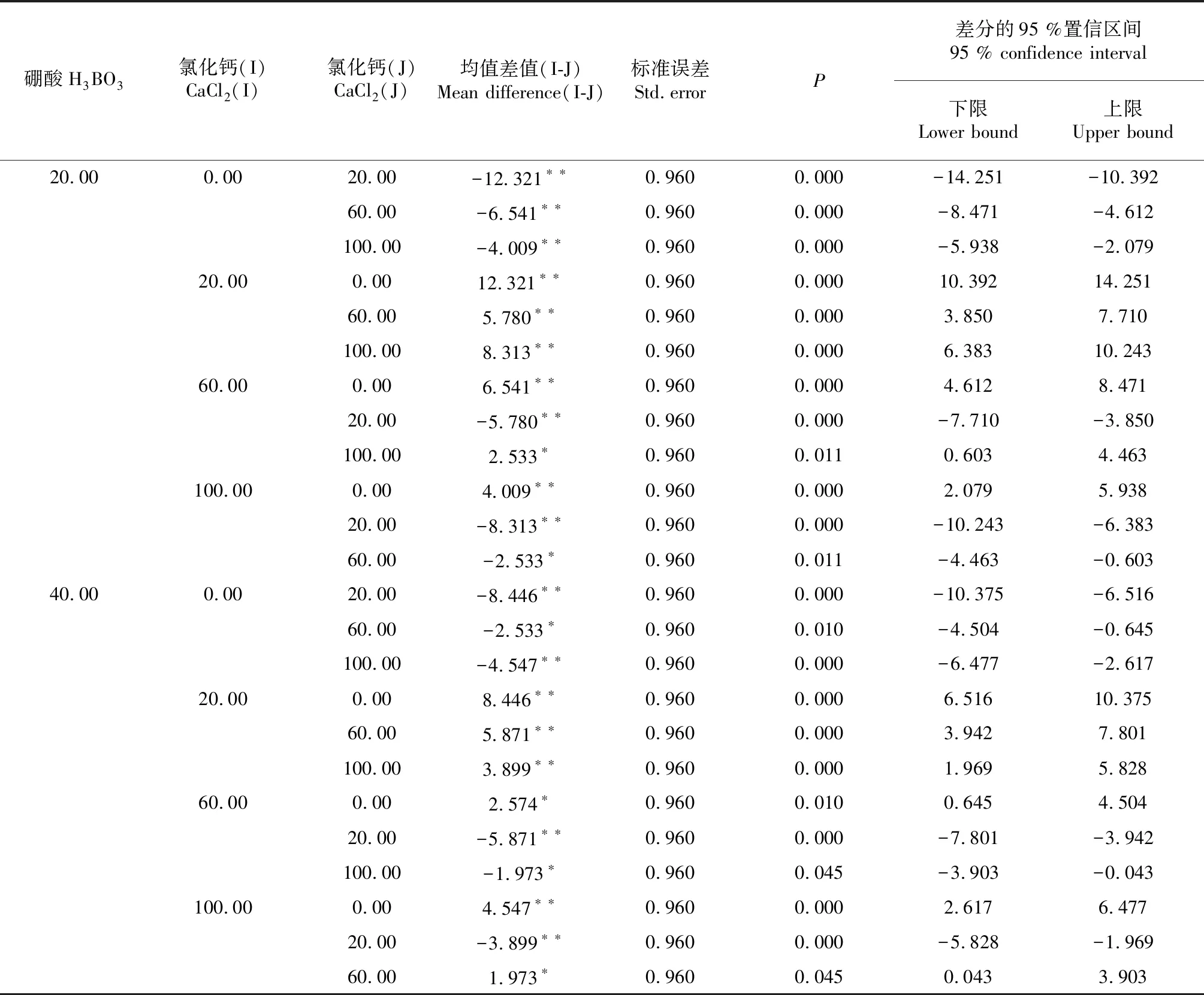
表7 LSD比較結果(主效應CaCl2)
注:CaCl2單位為mg/L,*表示均值差值在0.05級別上較顯著,**表示均呈差值在0.01級別上顯著。
Note: CaCl2unit mg/L, * means that difference is significant at 0.05 level, ** means that difference is significant at 0.01 level.
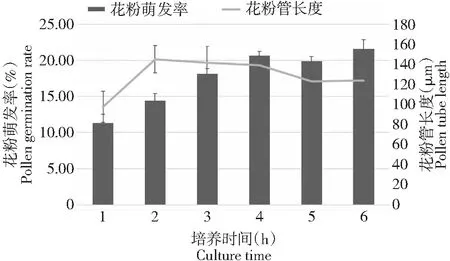
圖1 培養時間對花粉萌發和花粉管生長的影響Fig.1 Effect of culture times on pollen germination and pollen tube growth
在鏡檢中觀察到,睡蓮的花粉粒呈圓形(圖2-a),直徑大約25~50 μm,一粒睡蓮花粉通常只萌發出一束花粉管(圖2-b)。萌發的初始階段,花粉粒的一側會凸起,突起物透明(圖2-c)。隨后突起部位不斷伸長,形成花粉管。隨著花粉管的伸長,花粉粒中的內含物逐步進入花粉管,花粉管漸漸填充滿內含物(圖2-d)。在下一個階段的生長過程中,內含物均勻分布在花粉粒和花粉管之中,此外還會出現以下幾種情況;花粉粒變透明,花粉管中部和末端充滿內含物;內含物分別集中分布在花粉管各個部分,透明與不透明的部分界限鮮明(圖2-f)。此外,花粉萌發過程中,花粉管還會出現細小、扭曲的現象(圖2-e)。
3 討 論
3.1 培養基組分和花粉萌發及花粉管生長的關系
適宜濃度的蔗糖對睡蓮花粉萌發有明顯的促進作用,蔗糖是花粉萌發和花粉管生長主要的營養物質,同時也是花粉代謝和跨膜運輸的碳源[18]。10 %的蔗糖能有效促睡蓮花粉萌發,過高濃度會產生抑制。楊夢飛等[14]的研究也得到同樣的結果,10 %的蔗糖濃度適用于睡蓮花粉的離體培養。李佛蓮等[8]對山玉蘭花粉的研究表明,蔗糖濃度高于10 %會抑制山玉蘭花粉的萌發,5 %蔗糖是最適宜耐寒睡蓮花粉萌發的濃度。鄧衍明等[20]的研究表明,在BK培養基[19]中添加8 %蔗糖最適宜花粉管的萌發,而薄殼山核桃花粉萌發的最佳蔗糖濃度為20 %~30 %[18]。因此,不同植物的花粉離體萌發適宜的蔗糖濃度不同,這可能與不同植物花粉對蔗糖濃度形成的滲透壓的適應能力不同有關。在今后的睡蓮花粉研究中,可以將試驗對象擴展至其它亞屬的睡蓮花粉,以進一步探討不同亞屬的睡蓮花粉對蔗糖濃度的適應能力的差異性。
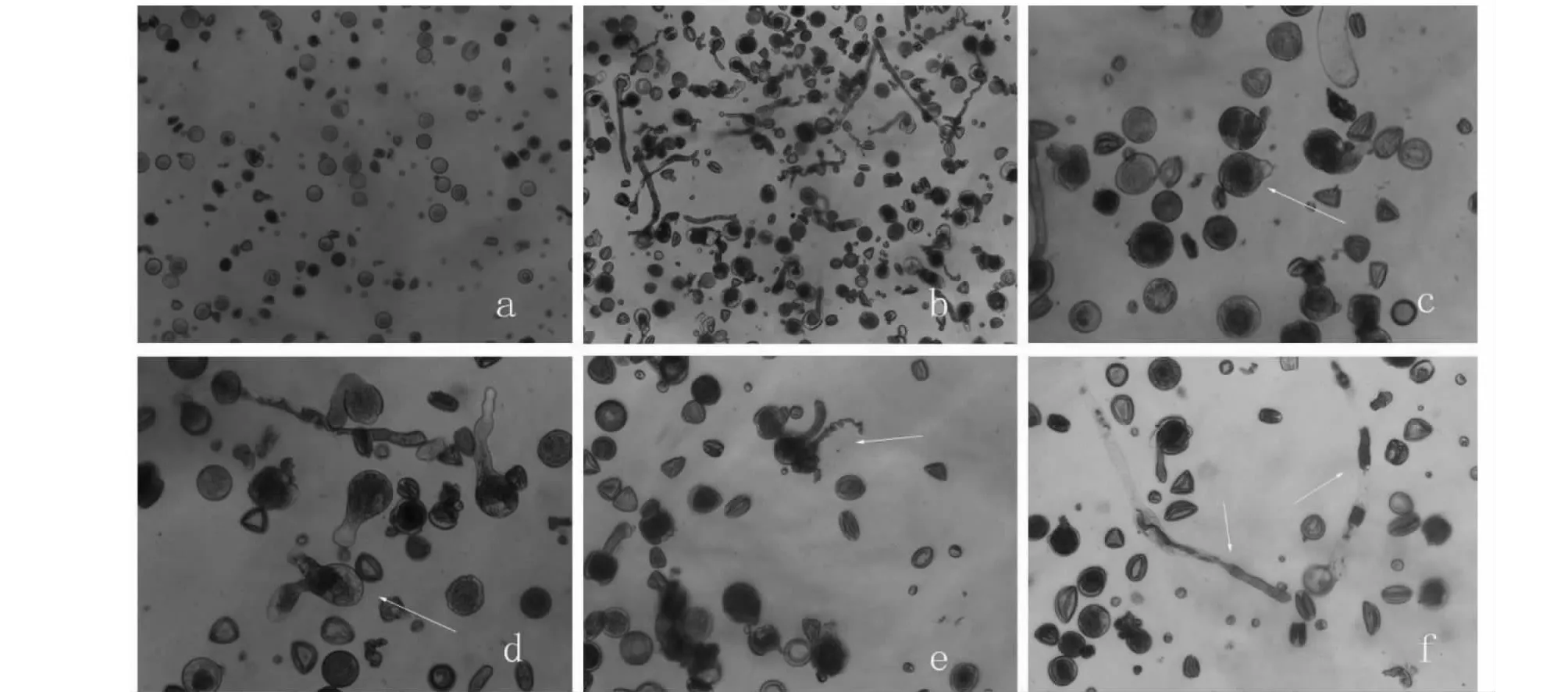
a.睡蓮花粉在蒸餾水中培養4 h的狀態;b.睡蓮花粉在培養基中培養4 h的狀態;c.睡蓮花粉萌發的初始階段;d.睡蓮花粉管開始伸長,內含物質進入花粉管;e.花粉管扭曲異常;f.花粉管伸長后,內含物在花粉管的分布情況a. The condition of pollen in distilled water for 4 hours; b. The condition of pollen in medium for 4 hours; c. The initial stage of pollen germination; d. pollen tube begins to elongate and inclusion enters pollen tube; e. Abnormal distortion of pollen tube; f. Distribution of inclusions in pollen tube after elongation of pollen tube 圖2 花粉萌發及花粉管生長的動態變化Fig.2 The dynamic changes of pollen germination and pollen tube growth
H3BO3能刺激并增加花粉對糖類的吸收、運轉和代謝[21],參與花粉管頂端細胞壁合成,對花風管中果膠的合成有著重要作用[22],使酸性果膠轉變呈酯化果膠,而酯化果膠存在于花粉管頂端,有助于提高花粉管頂端的延展性[8]。硼離子對質外體結合鈣離子和游離鈣離子有影響,可以增加細胞內的游離鈣離子,使其達到啟動花粉萌發的最佳濃度[23]。硼離子的加入能有效促進Nymphaea‘Paul Stetson’睡蓮花粉的萌發和花粉管的生長,20 mg/L的硼離子更適宜睡蓮花粉的萌發,在10 %蔗糖+20 mg/L CaCl2的基礎上,花粉萌發率達到20.66 %。
Ca2+是花粉萌發、花粉管生長不可缺少的,外源施加的Ca2+能促進花粉的萌發[23],Bednarska[24]通過在培養基中加入Ca2+通道阻塞劑發現花粉萌發受到抑制,證明了Ca2+對花粉萌發的影響。楊夢飛等[14]的試驗中,培養基未加入Ca2+,除埃及白睡蓮外,其余睡蓮花粉萌發率均不到10 %,這與本試驗的結果較一致。在濃度適宜的蔗糖、H3BO3的培養基中,補充少量的外源Ca2+能顯著提高Nymphaea‘Paul Stetson’睡蓮花粉的萌發率,過高的Ca2+會造成Ca2+中毒,反而抑制花粉的萌發[25]。龔明和曹宗巽[26]研究結果認為,Ca2+能啟動花粉萌發和調節花粉管生長。本研究結果表明,Nymphaea‘Paul Stetson’睡蓮花粉在缺少Ca2+的培養基中,萌發率非常低,隨著Ca2+的加入,萌發率大幅度提高。
3.2 花粉管的生長情況
4 h以前,睡蓮花粉萌發率會隨著培養時間顯著增加,4 h以后趨于穩定,花粉管長度在培養2 h以前迅速增加,2 h后達到一個相對穩定的水平,此結果與楊夢飛等[14]的研究結果基本一致。
試驗中所觀察到的睡蓮花粉粒或花粉管中的內含物質可能是生殖核及營養核或微絲骨架[27]。游韓莉等[28]研究發現花粉在離體萌發過程中,營養核和生殖核會陸續進入到花粉管內,微絲骨架排列與花粉細胞核的移動存在一定的關系,隨著花粉的萌發,微絲骨架逐漸聚集,推動營養核和生殖核向花粉管內移動。花粉管中的細胞核行為及花粉管內的微絲骨架的分布是一個復雜的過程[29],對此次試驗中觀察到的花粉中的內含物質需要進一步進行熒光標記,才能進行更準確和深入的研究分析。
4 結 論
最適合‘保羅蘭’睡蓮的花粉離體萌發的培養基為10 %蔗糖+20 mg/L或40 mg/L H3BO3+20 mg/L CaCl2,花粉離體萌發率為15.76 %~20.66 %,花粉管生長長度為139.28~141.11 μm,最佳鏡檢時間為4 h。

