進境菜豆種子中普通細菌性疫病菌的分離和鑒定
文朝慧 何蘇琴 左佳妮 王溪橋 尤佳

摘要對經甘肅口岸進境的30批菜豆 Phaseolus vulgaris種子進行了普通細菌性疫病菌的檢測,利用選擇性培養基MT從波蘭進境菜豆種子上分離到1株細菌597,對該分離物進行菌落形態特征觀察、致病性測定、16S rDNA及16S23S rDNA ITS序列分析和特異性PCR檢測。結果表明,該分離物在MT培養基上菌落呈黃色、圓形、黏稠、表面光滑向外隆起、菌落周圍有水解圈。分離物597接種菜豆幼苗后導致葉片枯萎,接種點干枯。結合菌落形態、16S23S rDNA ITS序列、特異性PCR檢測結果,將分離物597鑒定為地毯草黃單胞桿菌菜豆致病變種Xanthomonas axonopodis pv. phaseoli。
關鍵詞菜豆種子;地毯草黃單胞桿菌菜豆致病變種;普通細菌性疫病;鑒定
中圖分類號:S 436.43, S41.31
文獻標識碼:A
DOI:10.16688/j.zwbh.2018101
菜豆普通細菌性疫病1893年首次被報道[1],引起該病害的病原物有多種,其中一些菌株在培養基上可以產生褐色素,稱為褐色致病菌株[2],褐色和非褐色致病菌株作為菜豆普通細菌性疫病的致病菌曾被統稱為Xanthomonas campestris pv. phaseoli[3]。隨著研究的深入,Vauterin等[45]發現非褐色菌株不同于褐色菌株,因此將非褐色菌株歸于X. axonopodis,成為一個新的變種,而褐色菌株也作為一個新的變種被稱為褐色黃單胞菌褐色亞種X. fuscans subsp. fuscans (Xff)[6]。目前普遍認為菜豆普通細菌性疫病是由地毯草黃單胞桿菌菜豆致病變種X. axonopodis pv. phaseoli (Xap)和褐色黃單胞菌褐色亞種X. fuscans subsp. fuscans (Xff)所引起的。
帶菌種子是菜豆普通細菌性疫病最重要的初侵染源[79],10 000粒種子中有1粒帶菌種子即可引起菜豆普通細菌性疫病的發生流行[10]。病原菌通常寄生于菜豆種子的種皮或者胚中,寄生于胚中的病原菌在種子處理中難以去除[911],易感菜豆品種的帶菌種子發芽后在種苗期即表現癥狀[12],抗性強的菜豆品種即使在種苗期不表現癥狀,所結種子也會被感染[13],因此帶菌種子在菜豆普通細菌性疫病的流行中起著重要作用。本研究通過對進境菜豆種子中菜豆普通細菌性疫病病原菌進行檢測和鑒定,以期明確進境菜豆種子中菜豆普通細菌性疫病病原菌的種類,為進出境檢驗檢疫和制定病害防治策略提供依據。
1材料與方法
1.1供試種子樣品
30份供試菜豆種子為2015年經甘肅口岸進境的菜豆種子。
1.2培養基及主要試劑
MT選擇性培養基:蛋白胨10.0 g,氯化鈣0.25 g,酪氨酸0.5 g,瓊脂粉18.0 g,脫脂奶粉10.0 g,放線菌酮200.0 mg,氨芐80.0 mg,鹽酸萬古霉素10.0 mg,吐溫80 10.0 mL,蒸餾水1 000 mL。
NA培養基:氯化鈉5.0 g,牛肉膏3.0 g,蛋白胨10.0 g,瓊脂粉18.0 g,蒸餾水1 000 mL,調節pH為6.6~7.2。
LB液體培養基:胰蛋白胨10.0 g,酵母提取物5.0 g,氯化鈉10.0 g,蒸餾水1 000 mL。
PCR及電泳相關試劑:PCR buffer、dNTPs、rTaq聚合酶、loading buffer購自寶生物(大連)工程有限公司,新型植物基因組DNA提取試劑盒購自北京天根生化科技有限公司,引物由寶生物工程(大連)有限公司合成。
1.3病原菌的分離與培養
每份菜豆種子取100粒浸泡在300 mL 0.8%無菌生理鹽水中,加入300 μL 1%吐溫20,4℃靜置過夜后在搖床上180 r/min室溫振蕩30 min。用紗布將種子濾除,10 000 r/min離心30 min,將沉淀用0.8%無菌生理鹽水懸浮,1 000 r/min離心3 min,取上清液12 000 r/min離心5 min,得到的沉淀用無菌生理鹽水懸浮即為測定菌液。取10 μL菌液依次稀釋為10-1、10-2、10-3,均勻涂布在MT平板培養基上,置于28℃培養箱中培養4~5 d后,挑取有雙水解圈的黃色菌落劃線接種到新的NA培養基上純化,挑取單菌落獲得純培養。
1.4致病性測定
分別采用噴霧接種法和莖節接種法[14]將純培養分離物接種到菜豆幼苗上進行致病性測定。
營養土經高溫高壓滅菌后裝在塑料花盆(24 cm×16 cm×18 cm)中,澆透水靜置24 h后播種菜豆。播種后的花盆置于溫度25℃,L∥D=11 h∥13 h,相對濕度85%~95%的人工氣候箱中培養,待長出2片真葉后接種。
挑取長勢良好的菜豆幼苗分為2組,每組4盆苗,每盆2株苗,1組采用噴霧接種,另1組采用莖節接種。每處理3次重復,對照幼苗用無菌水接種處理。采用噴霧接種時,先將培養于NA培養基48~72 h的分離物用無菌水沖洗至無菌離心管,配制成1×108 cfu/mL的菌懸液,用無菌噴壺將菌懸液噴灑到菜豆植株表面至有菌液滴落。采用莖節接種時,用滅菌牙簽蘸取培養于NA培養基上48~72 h的分離物刺穿菜豆植株第一莖節,牙簽與菜豆植株莖稈保持45°,刺穿后將牙簽旋轉兩周后緩慢拔出。將接種后的菜豆苗置于人工氣候箱中繼續培養,每天觀察植株發病情況,記錄癥狀特點。待植株出現明顯病狀后,根據柯赫氏法則,取病健交界處葉片或莖稈組織進行病菌分離,將分離菌與接種物進行形態特征比較,并用PCR進行檢測,完成致病性測試程序。
1.5病原物的分子生物學鑒定
2.5特異性分子鑒定
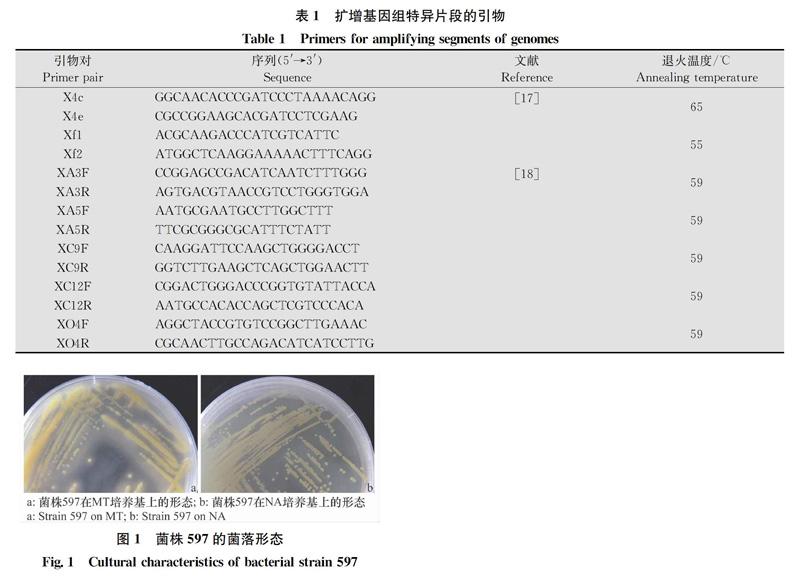
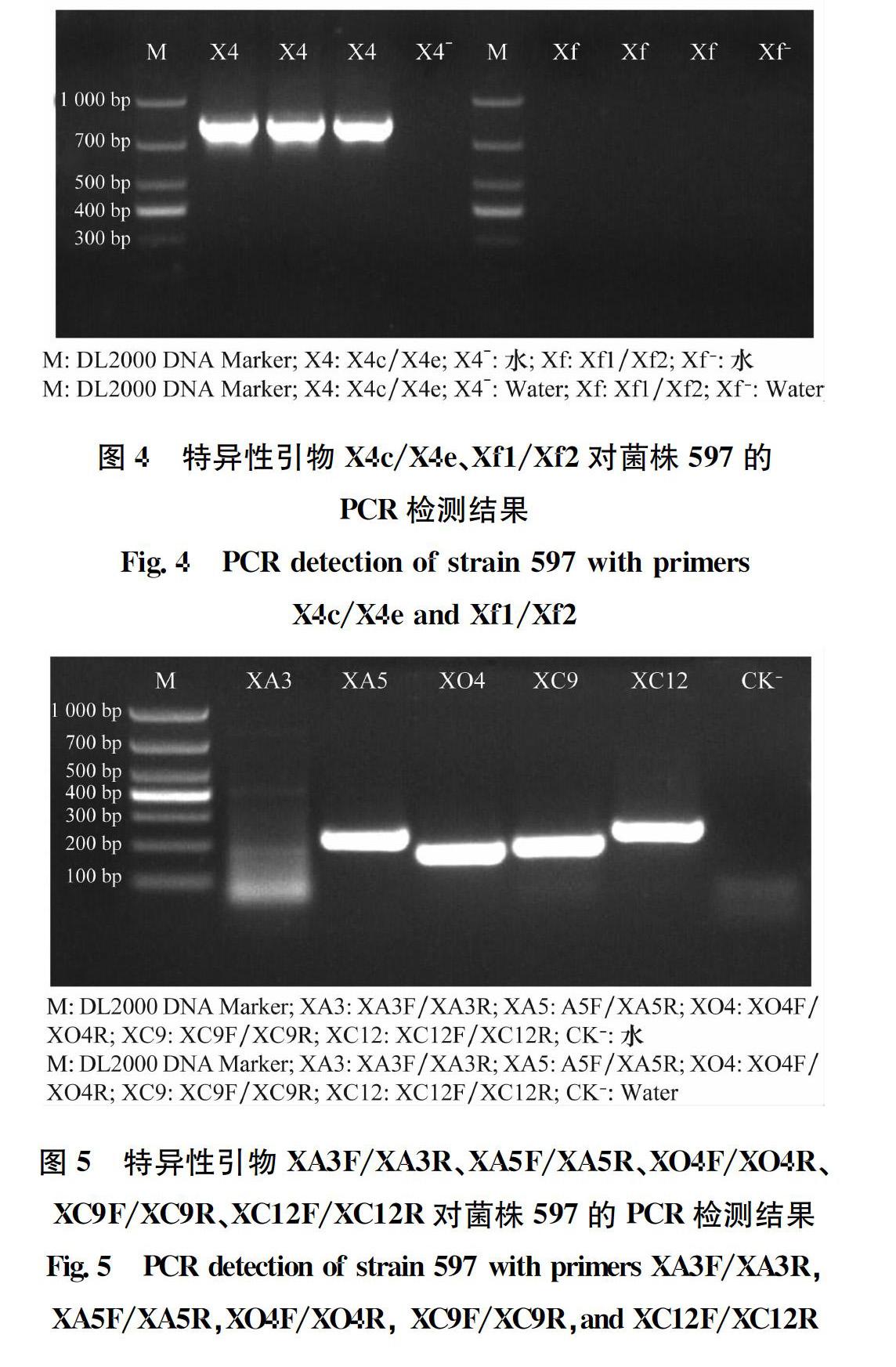
利用特異性檢測引物X4c/X4e、Xf1/Xf2對分離物597的基因組DNA進行PCR擴增(圖4),引物X4c/X4e產生730 bp左右的特異性片段;而引物Xf1/Xf2未產生目標片段。利用特異性引物XA3F/XA3R、XA5F/XA5R、XO4F/XO4R、XC9F/XC9R、XC12F/XC12R對菌株597的基因組DNA進行PCR擴增(圖5),引物XA3F/XA3R未產生目標片段,而引物XA5F/XA5R、XO4F/XO4R、XC9F/XC9R、XC12F/XC12R均產生特異性片段。由于特異性檢測引物X4c/X4e對X. axonopodis pv. phaseoli (Xap)和X. fuscans subsp. fuscans (Xff)均具有特異性,引物Xf1/Xf2僅對Xff具有特異性[17];引物XA5F/XA5R、XO4F/XO4R、XC9F/XC9R、XC12F/XC12R對Xap具有特異性,引物XA3F/XA3R對Xff具有特異性[18],由此可初步判斷分離物597為地毯草黃單胞菌菜豆變種。
3討論
菜豆又稱四季豆,是我國重要的豆科蔬菜作物,在蔬菜的周年供應中起著重要作用。菜豆普通細菌性疫病在世界各地主要菜豆產區均有發生,在美國[78]、加拿大[12]、歐洲[9,19]、亞洲[14]、非洲[13]均有報道。種子傳播是該病害最主要的傳播方式[711]。近年來,甘肅作為對外繁育種子原種進口大省,從美國、法國、德國、捷克、匈牙利、意大利、荷蘭、波蘭、羅馬尼亞、西班牙、土耳其、俄羅斯、日本、韓國、越南、泰國、中國臺灣等國家和地區進口菜豆種子數量增長迅速,種子攜帶細菌性病原物的幾率增大。病原菌通過種子傳帶形成異地擴散和蔓延,將嚴重影響作物產量和品質,正確進行細菌性病原物的鑒定,是種子健康檢測、保護育種基地安全的需要。
本研究對2015年甘肅口岸進境的30批菜豆種子進行菜豆普通細菌性疫病菌的檢測,在1批波蘭進境的菜豆種子中檢出菜豆普通細菌性疫病菌。
目前,菜豆普通細菌性疫病主要病原菌有兩種,即地毯草黃單胞桿菌菜豆致病變種X. axonopodis pv.phaseoli (Xap)和褐色黃單胞菌褐色亞種X. fuscans subsp.fuscans (Xff),2種病原菌具有相同的寄主范圍和流行學特征[19],除褐色黃單胞菌褐色亞種在培養條件下能夠產生褐色素外,兩者具有相似的生化表型[20]。利用16S rDNA和16S23S rDNA ITS序列分析及構建系統發育樹是鑒定細菌的通用技術,本研究中菌株597的16S rDNA序列和16S23S rDNA ITS序列,與GenBank中地毯草黃單胞桿菌菜豆致病變種的相應序列具有100%的一致性。結合病原菌形態學特征、致病性測定、特異性PCR檢測,證實了進境菜豆種子上的分離物597為地毯草黃單胞桿菌菜豆致病變種X. axonopodis pv. phaseoli,為防止病原物的傳播危害提供了依據。
參考文獻
[1]ZAUMEYER W J. The bacterial blight of beans caused by Bacterium phaseoli[J]. USDA Technical Bulletin, 1930, 186: 136.
[2]GOODWIN P H, SOPHER C R. Brown pigmentation of Xanthomonas campestris pv. phaseoli associated with homogentistic acid [J]. Canadian Journal of Microbiology, 1994, 40(1): 2834.
[3]DYE D W, DRADBURY J F, GOTO M, et al. International standards for naming pathovars of phytopathogenic bacteria and a list of pathovar names and pathotype strains [J]. Review of Plant Pathology, 1980, 59(4): 153168.
[4]VAUTERIN L, HOSTE B, KERSTERS K, et al. Reclassification of Xanthomonas [J]. International Journal of Systematic Bacteriology, 1995, 45(3): 472489.
[5]VAUTERIN L, RADEMAKER J, SWINGS J. Synopsis on the taxonomy of the genus Xanthomonas [J]. Phytopathology, 2000, 90(7): 677682.
[6]SCHAAD N W, POSTNIKOVA E, LACY G H, et al. Reclassification of Xanthomonas campestris pv. citri (ex Hasse 1915) Dye 1978 forms A, B/C/D, and E as X. smithii subsp citri (ex Hasse) sp. nov. nom. rev. comb. nov., X. fuscans subsp. aurantifolii (ex Gabriel 1989) sp. nov. nom. rev. comb. nov., and X. alfalfae subsp. citrumelo (ex Riker and Jones) Gabriel et al., 1989 sp. nov. nom. rev. comb. nov.; X. campestris pv. malvacearum (ex Smith 1901) Dye 1978 as X. smithii subsp smithii nov. comb. nov nom. nov.; X. campestris pv. alfalfae (ex Riker and Jones, 1935) Dye 1978 as X. alfalfae subsp. alfalfae (ex Riker et al., 1935) sp. nov. nom. rev.; and ―var. fuscans‖ of X. campestris pv. phaseoli (ex Smith, 1987) Dye 1978 as X. fuscans subsp. fuscans sp. nov [J]. Systematic and Applied Microbiology, 2005, 28: 494518.
[7]CAFATI C R, SAETTLER A W. Transmission of Xanthomonas phaseoli in seed of resistant and susceptible Phaseolus genotypes [J]. Phytopathology, 1980, 70(7): 638640.
[8]ARNAUDSANTANA E, PENAMATOS E, COYNE D P, et al. Longevity of Xanthomonas campestris pv. phaseoli in naturally infested dry bean (Phaseolus vulgaris) debris[J]. Plant Disease, 1991, 75(9): 952953.
[9]DARRASSE A, BUREAU C, SAMSON R, et al. Contamination of bean seeds by Xanthomonas axonopodis pv. phaseoli associated with low bacterial densities in the phyllosphere under field and greenhouse conditions[J]. European Journal of Plant Pathology, 2007, 119(2): 203215.
[10]WELLER D M, SAETTLER A W. Evaluation of seedborne Xanthomonas phaseoli and Xanthomonas phaseoli var. fuscans as primary inocula in bean blights [J]. Phytopathology, 1980, 70(2): 148152.
[11]BURKHOLDER W H. The bacterial blight of bean: a systemic disease [J]. Phytopathology, 1921, 11(2): 6169.
[12]SUTTON M D, Wallen WALLEN V R. Epidemiological and ecological relations of Xanthomonas phaseoli and Xanthomonas phaseoli var. fuscans on beans in southwestern Ontario, 19611968 [J].Canadian Journal of Botany,1970,48(7):13291334.
[13]MABAGALA R B. The effect of populations of Xanthomonas campestris pv. phaseoli in bean reproductive tissues on seed infection of resistant and susceptible bean genotypes [J]. European Journal of Plant Pathology, 1997, 103(2): 175181.
[14]陳泓宇,徐新新,段燦星,等.菜豆普通細菌性疫病病原菌鑒定[J]. 中國農業科學, 2012,45(13):26182627.
[15]LANE D J. 16S/23S rRNA sequencing [M]∥STACKEBRANDT E, GOODFELLOW M. Nucleic acid techniques in bacterial systematics. New York: John Wiley and Sons, 1991: 115175.
[16]LI X, DE BOER S H. Selection of polymerase chain reaction primers from an RNA intergenic spacer region for specific detection of Clavibacter michiganensis subsp. spedonicus[J]. Phytopathology, 1995, 85(8): 837842.
[17]AUDY P, LAROCHE A, SAINDON G, et al. Detection of the bean common blight bacteria, Xanthomonas campestris pv. phaseoli and X. c. phaseoli var. fuscans, using the polymerase chain reaction [J].Phytopathology,1994,84(10):11851192.
[18]ALBUQUERQUE P, CARIDADE C M, MARCAL A R, et al. Identification of Xanthomonas fragariae, Xap, and Xanthomonas fuscans subsp. fuscans with novel markers and using a dot blot platform coupled with automatic data analysis [J].Applied and Environmental Microbiology, 2011, 77(16): 56195628.
[19]BILJANA T, SVETLANA M, EMIL R, et al. Susceptibility of bean genotypes to Xanthomonas campestris pv. phaseoli in greenhouse conditions[J]. Pesticides and Phytomedicine, 2008, 23:167173.
[20]ALAVI S M, SANJARI S, DURAND F, et al. Assessment of the genetic diversity of Xanthomonas axonopodis pv. phaseoli and Xanthomonas fuscans subsp. fuscans as a basis to identify putative pathogenicity genes and a type III secretion system of the SPI1 family by multiple suppression subtractive hybridizations [J]. Applied and Environmental Microbiology, 2008, 74(10): 32953301.
(責任編輯:田喆)

