土霉素廢水對斑馬魚的生物毒性效應研究
高問 武鵬鵬 王雅學 沈洪艷

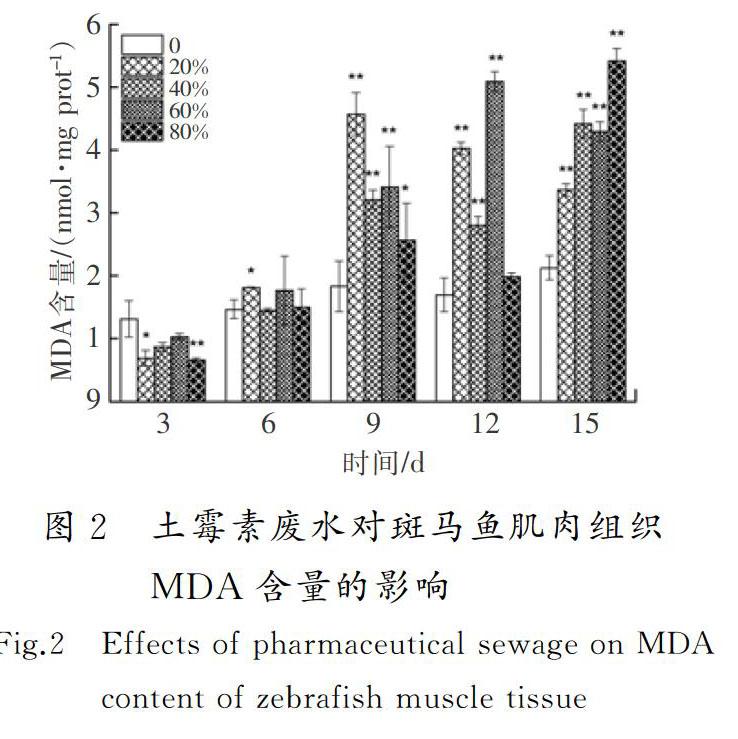
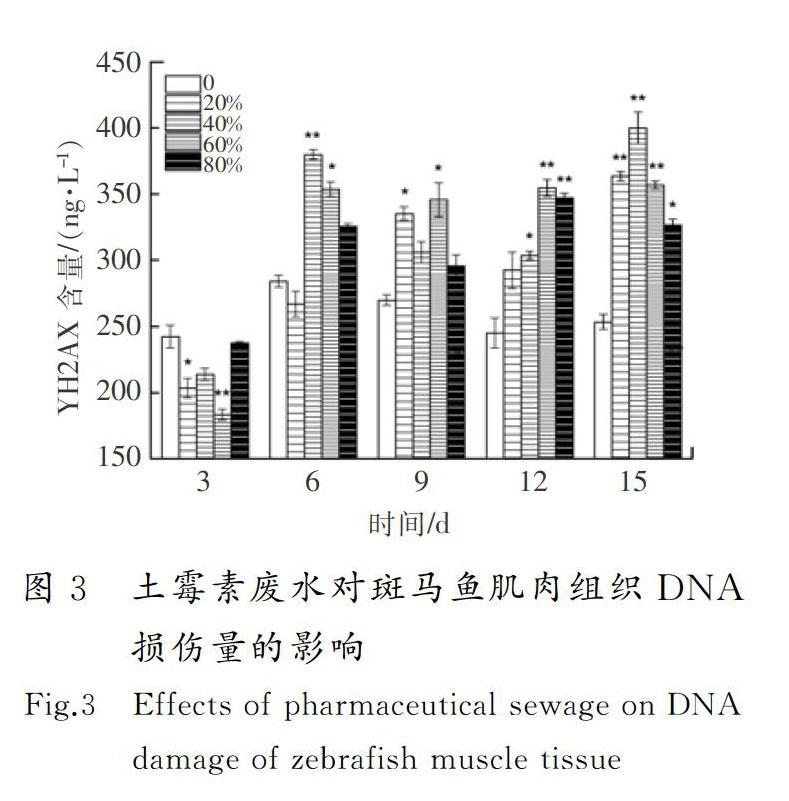
摘要:為了明確土霉素廢水的生物毒性效應,采用暴露實驗方法,研究了土霉素廢水對斑馬魚的毒性效應。結果顯示:對斑馬魚而言,土霉素廢水屬于低毒物質,斑馬魚暴露3~9 d時,其SOD活性和POD活性受到不同程度的抑制,12 d時受到顯著誘導(0.01 關鍵詞:環境毒理學;土霉素廢水;斑馬魚;超氧化物歧化酶;丙二醛;DNA損傷 中圖分類號:X503225;R994.6文獻標志碼:A GAO Wen,WU Pengpeng,WANG Yaxue,et al.Study of the biological toxicity of oxytetracycline wastewater on zebrafish[J].Journal of Hebei University of Science and Technology,2019,40(1):38-44.Study of the biological toxicity of oxytetracycline wastewater on zebrafish GAO Wen1,2, WU Pengpeng1,2, WANG Yaxue1,2, SHEN Hongyan1,2 (1.School of Environmental Science and Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018,China;2. Laboratory of Hebei Province for Medical Molecular Chemistry, Shijiazhuang, Hebei 050018,China) Abstract:In order to clarify the biotoxic effects of oxytetracycline wastewater, the toxicity effects of oxytetracycline wastewater on zebrafish are studied by exposure test. The results show that oxytetracycline wastewater is a low toxic substance to zebrafish. The SOD activity and POD activity of zebrafish are differently inhibited at 3~9 d. At 12 d, SOD activity and POD activity are significantly induced (0.01 Keywords:environmental toxicology; oxytetracycline wastewater; zebrafish; superoxide dismutase; malonaldehyde; DNA damage 作為一種高效藥物,抗生素近年來被廣泛用于治療人和動物疾病[1]。據統計,全球抗生素的年使用量為10萬~20萬t,其中60%的抗生素由中國生產。中國是生產和使用抗生素的大國,土霉素產量居世界第一[2-4]。生產土霉素需經過菌種發酵和提取精制,生產過程中產生大量廢水,生產1 t土霉素廢水排放量平均為1.3 t[5]。根據中國環境保護方面的相關規定,抗生素類制藥企業需要在廠內配備污水處理系統,生產廢水經處理達標后才能排入市政管網。大部分制藥廠對土霉素生產廢水采用生化法處理,經此方法處理后雖然BOD,COD及氨氮等污染物可以達標排放,但其中仍有土霉素殘留。據報道:美國2個污水處理廠的抗生素去除率分別為23%和72%,中國3個污水處理廠對抗生素的去除率為56%~70%[6-7],WATKINSON等[8]在澳大利亞監測的污水處理廠的抗生素質量濃度高達65 μg/L。沈洪艷等[9]采用暴露實驗方法研究了不同體積比鏈霉素生產廢水對錦鯉魚抗氧化酶和MDA含量的影響,結果表明,處理后的鏈霉素廢水低濃度長期暴露會對錦鯉魚的抗氧化系統造成傷害。河北科技大學學報2019年第1期高問,等:土霉素廢水對斑馬魚的生物毒性效應研究吳志剛等[10]研究了處理后的青土霉素廢水對錦鯉魚的抗氧化酶活性和MDA含量的影響,同樣得到了青土霉素廢水會對錦鯉魚抗氧化系統造成傷害的結論。蔡夢婷等[11]以土霉素純品和重金屬復合為實驗材料,探討了抗生素-重金屬復合暴露的水生態毒性。聞洋等[12]研究了88%鹽酸土霉素純品對斑馬魚的急性毒性及氧化應激的影響,發現該土霉素純品為低毒物質。 目前,關于土霉素對水生生物的毒性研究主要集中在土霉素純品,對土霉素廢水的毒性效應研究相對匱乏,研究處理后的土霉素廢水對斑馬魚的毒性效應具有重要的現實意義。筆者通過暴露實驗,檢測斑馬魚的抗氧化酶活性、MDA含量和DNA損傷,明確處理后的土霉素廢水對水生生物的毒性,并為進一步研究土霉素在水環境中的生態毒性效應提供科學根據。 1材料與方法 1.1主要儀器設備 紫外可見分光光度計(UV-2550,日本島津公司);酶標儀(SpectraMax190,美國美谷分子儀器有限公司);高速離心機(TG16-WS,湖南湘儀實驗室儀器開發有限公司);水浴鍋(DK-S26,上海精宏實驗設備有限公司);漩渦混合器(XW-80A,上海米青科實業有限公司);高純水蒸餾器(SYZ-A,江蘇金壇市宏華儀器廠);溶解氧測定儀(JPBJ-608,上海精密科學儀器有限公司);酸度計(FE20,梅特勒-托利多儀器上海有限公司);低溫冰箱(海爾BBC-226STV);分析天平(EL204,梅特勒-托利多儀器上海有限公司);水硬度計(YD300)等。 1.2水樣和試劑 土霉素廢水,取自某藥廠污水處理廠二沉池出水。 考馬斯亮蘭,MDA,SOD,POD試劑盒,均從南京建成生物研究所購買;磷酸化組蛋白H2AX(γ-H2AX)試劑盒,從上海卡努生物科技有限公司購買;pH值為7.4的磷酸緩沖溶液(PBS),購買于試劑公司自行調試;0.9%生理鹽水,購自河北省水利醫院;冰乙酸、無水乙醇,兩者均為分析純。 1.3受試生物 選用斑馬魚(Danio rerio)為受試生物,購買于上海博舜生物科技有限公司。斑馬魚體長為(2505±040)mm,體重(0.20±0.05)g,選擇同批次、規格整齊、體色光澤、魚鰭完整舒展的斑馬魚。將斑馬魚采用5%(質量分數,下同)的食鹽水進行消毒處理后送入實驗室,之后放入48 h曝氣的脫氯自來水中馴養1周,實驗用水符合GB 11607—1989《漁業水質標準》,整個馴養過程中斑馬魚的死亡率小于5%。實驗前24 h對斑馬魚停止喂食,且整個實驗期間也不喂食。 1.4方法 根據《水和廢水監測分析方法》中的魚類毒性實驗方法開展土霉素廢水對斑馬魚的預實驗[13]。在預實驗中,斑馬魚暴露于100%體積濃度的土霉素廢水96 h后無死亡現象。因此,預實驗沒有獲得土霉素廢水對斑馬魚的24 h絕對致死濃度(24 h LC100)和96 h的無死亡濃度(96 h LC0)。根據中國魚類急性毒性實驗的分級標準,確定土霉素廢水對斑馬魚屬于低毒物質,可直接進行亞急性毒性實驗。 采用浸浴染毒法[14]進行亞急性毒性實驗,設定20%,40%,60%,80% 4個體積濃度組和一個空白對照組,每組體積濃度設置3個平行,土霉素廢水用脫氯自來水進行稀釋,配成不同體積濃度的實驗溶液。在5 L玻璃魚缸中分別加入4 L實驗溶液,將在實驗室馴養7 d以上的斑馬魚放入各濃度組中,每組投放25尾斑馬魚,暴露15 d,每 3 d測一次生化指標。 1)實驗條件 實驗溶液pH值維持在7.4~7.6,水溫控制在(22±1)℃,總硬度為100 mg/L;溶解氧含量不小于5 mg/L。實驗期間須連續曝氣,并進行遮光處理,為了保證廢水的體積濃度一致,每隔24 h更換實驗溶液1次;每天測定1次水溫、pH值、硬度及溶解氧含量等實驗溶液的基本指標。 2)樣品處理 每次測試前從相應體積濃度組中取3條實驗魚,快速解剖并取肌肉組織(0.1~0.2 g),在預冷的0.86%生理鹽水中進行漂洗,用濾紙拭干,準確稱量待測組織質量后放入勻漿器中。用移液器按1∶9(質量體積比,g∶mL)量取預冷的0.86%的生理鹽水置于勻漿器中,充分勻漿8 min,整個勻漿過程在冰水浴中進行。待組織勻漿充分研碎后,用高速冷凍離心機以3 000 r/min的轉速離心10 min,取上清液待測。其中進行γ-H2AX樣本處理時只需將生理鹽水替換為pH值為7.4的磷酸鹽緩沖溶液(PBS)。 3)測試方法 SOD采用黃嘌呤氧化酶法測定,POD采用愈創木酚比色法測定,MDA采用硫代巴比妥酸(TBA)比色法測定,γ-H2AX采用雙抗體夾心法測定。 4)統計結果 統計結果采用(平均值±標準偏差)表示,用SPSS22對數據進行單因素方差分析,用最小顯著差數法(LSD)對同一天內組間數據進行顯著性差異分析。0.01 2結果與討論 2.1土霉素廢水對斑馬魚肌肉組織SOD活性和POD活性的影響 SOD是生物體內一種保護性酶,具有清除體內自由基、控制脂質過氧化及減輕膜氧化損傷的作用[15-16]。土霉素廢水對斑馬魚肌肉組織SOD活性的影響見圖1 a)。由圖1 a)可以看出,第3 d時,4個體積濃度組SOD活性均受到抑制,20%和40%體積濃度組的SOD活性分別達到了實驗期間的最小值(40.95 U/mg prot,37.10 U/mg prot)。這可能是由于暴露起初魚體因外來物質的進入,斑馬魚機體用于抵抗土霉素廢水脅迫而產生大量超氧陰離子自由基(O2-),過量的O2-消耗了大量的SOD,使得SOD活性降低,或者自由基抑制圖1土霉素廢水對斑馬魚肌肉組織SOD和POD活性的影響 Fig.1Effects of pharmaceutical sewage on SOD activity and POD activity of zebrafish muscle tissue 了機體SOD的酶活性,SOD因合成受阻導致活性降低[17]。沈洪艷等[18]在研究頭孢噻肟鈉對斑馬魚SOD活性、MDA含量及DNA損傷的影響中發現,實驗第3 d暴露組均受到了抑制;第6 d,抑制水平有所緩解,這可能是斑馬魚機體正在適應土霉素廢水的環境,并且此時斑馬魚體內其他的氧化酶(如GSH等)可能發揮著作用;第9 d,60%體積濃度組受到了顯著抑制(0.01 POD是一類氧化還原酶,具有清除過氧化氫、酚類、胺類和醛類的作用。土霉素廢水對斑馬魚肌肉組織的POD活性影響見圖1 b)。由圖1 b)可以看出,暴露第3 d,不同體積濃度組的POD活性均低于對照組,4個體積濃度組的POD活性均為極顯著抑制(P<0.01),這可能是由于暴露初期土霉素廢水誘導機體產生的氧自由基或在SOD酶的作用下生成過氧化氫,而POD有催化、清除過氧化氫和有機過氧化物的作用[21],從而使機體內POD及其同工酶消耗,導致POD活性降低,各組反應一致表明了魚體POD遇到氧化脅迫就會啟動反應機制。第6 d,60%體積濃度組的POD活性高于對照組,其他暴露組POD活性均低于對照組,但無顯著性抑制,這可能是外源污染物隨著暴露時間的延長對機體產生了輕微刺激,機體POD酶增加以清除體內的代謝產物,H2O2和O2-等分解成沒有毒性的小分子物質,減輕對細胞的損傷,防止活性氧自由基啟動膜脂過氧化作用來保護細胞生物膜不被破壞[22]。第9 d,4個暴露組POD活性與對照組相比均表現出輕微的抑制作用,說明機體中POD酶仍對H2O2和O2-發生著消除反應。第12 d,20%和40%體積濃度組與空白對照組相比無明顯差異(P>0.05),可能是在低體積濃度暴露組中,機體能夠較為正常地產生POD酶用來消除外來物質的影響;60%體積濃度組與對照組相比,受到了極顯著性誘導(P<0.01),達到了實驗期間的最大值(2.72 U/mg prot),這可能是由于暴露進入魚體內的外源污染物達到了一定水平,機體需要產生更多的POD消耗底物的活性氧自由基。第15 d,各暴露組POD活性均低于空白對照組,20%,40%和80%體積濃度組出現了顯著性抑制(0.01 2.2土霉素廢水對斑馬魚肌肉組織MDA含量的影響(圖2) MDA是生物膜中的不飽和脂肪酸在自由基作用下生成的一種脂質過氧化代謝產物[25]。由圖2可以看出,第3 d,與對照組相比,暴露組的MDA含量受到不同程度的抑制作用,這可能是因為魚體內抗氧化防御系統成分(SOD,POD,GSH,GST)的參與,較大限度地降低了機體活性氧濃度。第6 d,暴露組MDA含量與對照組相比,無顯著差異(P>0.05)。第9~15 d,與相應對照組相比,暴露組MDA含量均出現極顯著性誘導(P<0.01),暴露組MDA含量均有很大程度的升高。這可能是由于土霉素廢水已經進入斑馬魚肌肉組織內,造成機體內產生大量的活性氧自由基,發生脂質過氧化產生脂質過氧化產物[26]。第9 d,20%體積濃度組達到最大值(4.57 nmol/mg prot)。第12 d,60%體積濃度組達到實驗最大值(5.09 nmol/mg prot)。馮濤等[27]也發現苯并(a)芘對大彈涂魚肝臟的暴露時間和濃度均對MDA濃度有顯著影響。第15 d,與對照組相比,各暴露組同樣受到極顯著性誘導(P<0.01),并且80%體積濃度組達到實驗最大值(5.41 nmol/mg prot),這說明魚體內抗氧化系統已經遭受到較大程度的損傷,使得氧自由基增多,與不飽和脂肪酸結合引起脂質過氧化過程,MDA含量增多卻得不到消解,最終導致膜系統嚴重受損。沈洪艷等[28]也發現高濃度的鏈霉素廢水對斑馬魚產生了嚴重的氧化損傷。整體來看,各暴露組在不同時間段MDA含量整體呈“Λ”型變化趨勢。 2.3土霉素廢水對斑馬魚肌肉組織中DNA的損傷 人們普遍認為DNA雙鏈斷裂(double stranded breaks,DSBs)是最嚴重的DNA損傷,無論何種因素造成DSBs,H2AX都會被誘導磷酸化為γ-H2AX與簇集[29],因此γ-H2AX含量可以成為檢測細胞DNA損傷的一個特異指標。土霉素廢水對斑馬魚肌肉組織γ-H2AX含量的影響見圖3。由圖3可以看出,第3 d,暴露組γ-H2AX含量均低于對照組,說明在暴露初期土霉素廢水就已經對斑馬魚肌肉組織(SOD活性、MDA含量)產生了一定的機體損傷,正常的H2AX磷酸化(γ-H2AX)并未及時形成,導致γ-H2AX含量降低[30]。第6 d,除了20%體積濃度組低于對照組外,其他暴露組γ-H2AX含量均大于對照組,并且40%體積濃度組受到極顯著性差異(P<0.01),60%體積濃度組受到顯著性差異(0.01 2.4指標關系分析 system index機體抗氧化系統指標機理見圖4。當機體受到外來污染物攻擊時,會發生應激反應,產生大量活性氧自由基,活性氧就有可能對DNA造成損傷或脂質過氧化產生新的氧化自由基醛基(MDA)對機體造成傷害。SOD和POD屬于抗氧化酶,當機體活性氧自由基過多時,為了避免機體損傷,活性氧自由基可以被SOD催化發生歧化反應生成過氧化物。過氧化物(如H2O2)對機體同樣具有一定傷害,又會被POD及其同工酶進一步分解成無傷害的小分子物質。從圖1可以看出,SOD與POD各濃度組隨著時間均呈“抑制—誘導—抑制”的變化趨勢,因此具有一定的正相關。由于POD存在多種同工酶,所以POD的變化趨勢更趨于穩定。當過量的ROS無法被SOD消除時,就會直接造成DNA損傷,DNA遭到損傷又會反過來阻礙SOD的合成。由圖1 a)和圖3可以看出,隨著暴露時間的增加,高濃度組DNA受到了一定程度的損傷,在第12 d,80%體積濃度組的SOD活性受到極顯著抑制,被認為是由于DNA損傷,阻礙了SOD合成而造成的。當SOD活性遭到抑制或由于DNA受損阻礙SOD合成時,活性氧就會脂質過氧化產生氧化自由基醛基(MDA),MDA是氧化損傷最終形成的脂質過氧化物。從圖1和圖2可以看出,與對照組相比,高濃度暴露組SOD與POD的活性隨著暴露時間的增加主要呈現抑制作用,與此相反,暴露組MDA與其對照組相比,主要呈現出誘導作用。因此,SOD和POD與MDA具有一定的負相關,MDA含量可以間接指示機體自由基水平,并且是毒性作用和保護作用的綜合反映[34]。從酶系間的變化差異而言,POD變化趨勢比SOD更趨于穩定,規律性更強。但在對濃度的敏感性方面,從圖1可知,SOD更優于POD,POD在濃度組間無明顯變化趨勢。從對機體損傷方面的指標變化差異而言,土霉素廢水脅迫產生自由基水導致的DSBs修復完成后,γ-H2AX去磷酸化恢復為H2AX,MDA含量比γ-H2AX含量更為明顯地指示機體自由基水平,γ-H2AX含量則能夠明顯反映細胞DNA的受損情況。 3結論 1) 對斑馬魚而言,處理后體積分數為20%,40%,60%和80%的土霉素廢水屬于低毒物質。 2) 處理后體積分數為20%,40%,60%和80%的土霉素廢水對斑馬魚肌肉組織中的SOD活性、POD活性和MDA含量影響顯著:前中期(3~9 d)土霉素廢水對斑馬魚SOD活性和POD活性主要為抑制作用,后期(12~15 d)主要為誘導作用;土霉素廢水對斑馬魚MDA含量主要表現為誘導作用,其破壞了機體的抗氧化系統,造成了一定的氧化損傷,但損傷程度在機體的防御范圍之內。 3) 處理后體積分數為80%的土霉素廢水,對斑馬魚肌肉組織存在較大的環境風險。 4) 處理后體積分數為20%,40%,60%和80%的土霉素廢水脅迫斑馬魚產生的氧化應激反應,可能是導致DNA損傷的重要機制之一。 5) 土霉素廢水成分復雜,因此需對土霉素廢水的主要成分及各成分作用產生的毒性效應進行更為深入的研究。 參考文獻/References: [1]郭學濤.針鐵礦/腐殖酸對典型抗生素的吸附及光解機理研究[D].廣州:華南理工大學,2014. GUO Xuetao.Sorption and Photolysis of Antibiotics by Geethite/Humic Acid[D]. Guangzhou: South China University of Technology, 2014. [2]XU Weihai, ZHANG Gan, ZOU Shichun, et al. Determination of selected antibiotics in the Victoria Harbour and the Pearl River, South China using high-performance liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Environmental Pollution, 2006, 145(3): 672-679. [3]封例忠.青霉素廢水的生化處理研究[D].沈陽:東北大學,2009. FENG Lizhong. Research on the Biochemical Treatment of Penicillin Wastewater[D]. Shenyang: Northeastern University, 2009. [4]林秀軍.抗生素類制藥廢水生物處理性研究[D].北京:中國礦業大學,1998. LIN Xiujun. Study on Biological Treatment of Antibiotic Pharmaceutical Wastewater[D]. Beijing: China University of Mining and Technology, 1998. [5]沈洪艷,吳志剛,高吉喜,等.青土霉素廢水出水對斑馬魚抗氧化指標的影響[J].河南科技大學學報:自然科學版,2013,34(3):78-82. SHEN Hongyan, WU Zhigang, GAO Jixi, et al. Effect of wastewater effluent of penicillin and oxytetracycline on antioxidant index of Danio rerio[J]. Journal of Henan University of Science and Technology:Natural Science, 2013, 34(3): 78-82. [6]BROWN K D, KULIS J, THOMSON B, et al. Occurrence of antibiotics in hospital, residential, and dairy effluent, municipal wastewater, and the Rio Grande in New Mexico[J]. Science of the Total Environment, 2006, 36(2/3): 772-783. [7]LI Bing, ZHANG Tong. Mass flows and removal of antibiotics in two municipal wastewater treatment plants[J]. Chemosphere, 2011, 83(9): 1284-1289. [8]WATKINSON A J, MURBY E J, KOLPIN D W, et al. The occurrence of antibiotics in an urban watershed: From wastewater to drinking water[J]. Science of the Total Environment, 2008, 407(8): 2711-2723. [9]沈洪艷,武晨虹,王麗新,等.鏈霉素廢水對錦鯉魚抗氧化酶及MDA含量的影響[J].安全與環境工程,2013,20(6):65-68. SHEN Hongyan, WU Chenhong, WANG Lixin, et al. Impacts of streptomycin wastewater on the antioxidative enzyme activities and malondialdehyde content in cyprinus carpio[J]. Safety and Environmental Engineering,2013, 20(6): 65-68. [10]吳志剛,沈洪艷,高吉喜,等.青土霉素廢水出水對錦鯉肝臟抗氧化酶活性和丙二醛含量的影響[J].江西農業大學學報,2013,35(3):587-592. WU Zhigang, SHEN Hongyan, GAO Jixi, et al. Effects of wastewater effluent of penicillin and oxytetracycline on SOD, CAT activities and MDA content in liver tissue of cyprinus carpio[J]. Acta Agriculturae Universitatis Jiangxiensis, 2013, 35(3): 587-592. [11]蔡夢婷,侯國權,奚豪,等.典型抗生素與重金屬銅復合暴露對淡水綠藻和斑馬魚的聯合毒性[J].浙江樹人大學學報(自然科學版),2018,18(2):11-15. CAI Mengting, HOU Guoquan, XI Hao, et al. Combined toxicity of typical antibiotics and heavy metal copper exposure to freshwater green algae and zebrafish[J]. Journal of Zhejiang Shuren University,2018, 18(2): 11-15. [12]聞洋,陳寒嫣,楊炳君,等.典型獸用抗生素對斑馬魚的急性毒性及氧化應激的影響[J].吉林師范大學學報(自然科學版),2018,39(2):94-98. WEN Yang, CHEN Hanyan, YANG Bingjun, et al. Effects of typical veterinary antibiotics on acute toxicity and oxidative stress in zebrafish[J]. Journal of Jilin Normal University (Natural Science Edition), 2018, 39(2): 94-98. [13]韓杰,葉行,許人冀.阿特拉津與氯氟菊酯聯合染毒對鯽器官SOD活性的影響[J].貴州農業科學,2010,38(9):136-137. HAN Jie, YE Xing, XU Renji. Effect of atrazine and cypermethrin on superoxide dismutase activity in organs of carassius auratus[J]. Guizhou Agricultural Sciences, 2010, 38(9): 136-137. [14]邱郁春.水污染魚類毒性實驗方法[M].北京:中國環境科學出版社,1992. [15]沈洪艷,王冰,趙月,等.氧氟沙星對錦鯉抗氧化系統和DNA損傷的影響[J].環境科學與技術,2015,38(12):59-66. SHEN Hongyan, WANG Bing, ZHAO Yue, et al. Effects of ofloxacin on antioxidant system and DNA damage of Cyprinus carpio[J]. Environmental Science & Technology, 2015, 38(12): 59-66. [16]FANG Yunzhong, YANG Sheng, WU Guoyao. Free radical homeostasis[J]. Progress in Physiological Sciences, 2004, 35(4): 337-343. [17]張國霞.水體中硝基芳烴誘導魚體氧化應激生物標志物研究[D].石家莊:河北科技大學,2012. ZHANG Guoxia. Study on Oxidative Stress Biomarker of Fish Induced by Nitroaromatic in Water[D]. Shijiazhuang: Hebei University of Science and Technology, 2012. [18]沈洪艷,焦曉會,武彤.頭孢噻肟鈉對斑馬魚SOD活性、MDA含量及DNA損傷的影響[J].環境科學學報,2015,35(8):2626-2632. SHEN Hongyan, JIAO Xioahui, WU Tong. Effects of cefotaxime sodium on SOD activity, MDA content and DNA damage in zebrafish[J]. Acta Scientiae Circumstantiae, 2015, 35(8): 2626-2632. [19]劉嫦娥,段昌群,王旭,等.丁草胺和乙草胺對蚯蚓CAT和SOD活性的影響[J].環境化學,2008(6):756-761. LIU Change, DUAN Changqun, WANG Xu, et al. Effects of butylchlor and ethychlor on CAT and SOD activity of earthworm[J]. Environmental Chemistry, 2008(6): 756-761. [20]王荻,李紹戊,馬濤,等.諾氟沙星對兩種鱘體內SOD活力影響的比較研究[J].中國畜牧獸醫,2011,38(7):34-37. WANG Di, LI Shaowu, MA Tao, et al. Effect of norfloxacin on SOD activity in two species of sturgeons[J]. Chinese Animal Husbandry Veterinarian, 2011, 38(7): 34-37. [21]DUNFORD H B, STILLMAN J S. On the function and mechanism of peroxidases[J]. Coordination Chemistry Reviews, 1976, 19(2): 187-251. [22]JIA Shouju, YING Xueping, CHEN Yanle, et al. A study on isozymes changes during variant development periods of eriocheir sinensis[J]. Transaction of Oceanology and Limnology, 2004, 4: 52-60. [23]李敏,趙月,曹志會,等.鏈霉素廢水對斑馬魚POD活性和GSH含量的影響[J].安全與環境工程,2015,22(3):1-5. LI Min, ZHAO Yue, CAO Zhuihui, et al. Impact of streptomycin wastewater on activity of peroxidae (POD) and the content glutathione (GSH) in the muscle tissues of danio rerio[J]. Safety and Environmental Engineering, 2015, 22(3): 1-5. [24]宋志慧,王慶偉.Cu2+,Cd2+,Cr6+脅迫對斑馬魚抗氧化酶活性的影響[J].安徽農業科學,2011,39(8):4739-4741. SONG Zhihui, WANG Qingwei. Effect of Cu2+, Cd2+, and Cr6+ stress on the anti-oxidative enzyme activities in danio rerio[J]. Journal of Anhui Agricultural Sciences, 2011, 39(8): 4739-4741. [25]陳璦,周玫.自由基醫學[M].北京:人民軍醫出版社,1991. [26]王麗新.鏈霉素廢水誘導斑馬魚氧化應激反應與生態風險評價研究[D].石家莊:河北科技大學,2014. WANG Lixin. Oxidation Stress Response and Ecological Risk Assessment for Zebra Fish Induced by Streptomycin Wastewater[D]. Shijiazhuang: Hebei University of Science and Technology, 2014. [27]馮濤,鄭微云,洪萬樹,等.苯并(a)對大彈涂魚肝臟抗氧化防御系統影響的初步研究[J].海洋科學,2000(5):27-30. FENG Tao, ZHENG Weiyun, HONG Wanshu, et al. The effect of benzo (a) on the antioxidant defense system of the liver of large mudskids[J]. Marine Sciences, 2000(5): 27-30. [28]沈洪艷,王麗新,楊金迪,等.鏈霉素生產廢水對斑馬魚肌肉組織SOD活性和MDA含量的影響[J].河北科技大學學報,2014,35(3):303-308. SHEN Hongyan, WANG Lixin, YANG Jindi, et al. Effects of streptomycin wastewater on SOD activity and MDA content in muscle tissuesof zebrafish[J]. Journal of Hebei University of Science and Technology, 2014, 35(3):303-308. [29]余艷柯,陸源,余應.γH2AX:DNA 雙鏈斷裂的標志[J].中國藥理學與毒理學雜志,2005,19(3):237-240. YU Yanke, LU Yuan, YU Ying. γH2AX: A biomarker for DNA of double-stranded breaks[J]. Chinese Journal of Pharmacology and Toxicology, 2005, 19(3): 237-240. [30]HUEN M S, CHEN Junjie. Assembly of checkpoint and repair machineries at DNA damage sites[J]. Trends in Biochemical Sciences, 2010, 35(2): 101-108. [31]DANIDL R, RAMCHARAN J, ROGAKOU E, et al. Histone H2AX is phosphorylated at sites of retroviral DNA integration but is dispensable for postintegration repair[J]. Journal of Biological Chemistry, 2004, 279(44): 45810-45814. [32]NAZAROV I B, SMIRNOVA A N, KRUTILINA R I, et al. Dephosphorylation of histone γ-H2AX during repair of DNA doublestrand breaks in mammalian cells and its inhibition by calyculin A[J]. Tadiation Research, 2003, 160(3): 309-317. [33]冉茂良,高環,尹杰,等.氧化應激與DNA損傷[J].動物營養學報,2013,25(10):2238-2245. RAN Maoliang, GAO Huan, YIN Jie, et al. Oxidative stress and DNA damage[J]. Chinese Journal of Animal Nutrition, 2013, 25(10): 2238-2245. [34]LAI Yanhe, HE Binyuan, FAN Hangqing, et al. Effects of cadmium stress on the activities of antioxidant enzymes,digestive enzymes and the membrane lipid peroxidation of the mangrove mud clam Geloina coaxans (Gmelin) [J]. Acta Ecologica Sinica, 2011, 31(11): 3044-3053.

