超敏HBV DNA檢測在慢性HBV感染者中的動態監測價值
王同同,郜玉峰,曹雯君,葉 郡,鄒桂舟,李緒桐,孔雪杰
慢性乙型肝炎病毒(hepatitis B virus,HBV)感染是全球性的公共衛生問題,可導致嚴重的感染后果,包括肝硬化和肝癌,DNA作為病毒復制最重要的指標,可反映肝炎病毒的復制活性,能夠對慢性HBV感染患者進行病情評估和療效監測[1-2]。慢性乙型肝炎防治指南(2015版)指出慢性HBV感染治療目標是最大限度長期抑制 HBV復制,HBV DNA檢測不到[3]。但目前臨床上采用的傳統熒光定量PCR法,對于病毒載量≤500 IU/ml的標本,無法準確的反映病毒復制情況,允許病毒在低水平的復制,造成肝臟持續的炎癥損傷,肝功能的異常不能及時找出原因,給臨床工作帶來一定困擾,同時指南已指出對于HBV DNA的檢測建議采用靈敏度和精確度高的檢測方法。該文利用超敏HBV DNA的檢驗技術試圖從病毒學的角度給出部分解釋;同時結合乙型肝炎病毒E抗原(hepatitis B e antigen,HbeAg)、谷丙轉氨酶(alanine transaminase,ALT)以及肝功能其他主要指標進一步探討超敏HBV DNA的臨床應用價值[4-5]。
1 材料與方法
1.1 病例資料收集2017年1月~2018年1月就診于安徽醫科大學第二附屬醫院感染科370例傳統PCR法檢測HBV DNA陰性的門診患者,男女比例為4.67(182/39),年齡19~74(44.36±12.12)歲,其中未治療的149例,治療組221例;治療組按照超敏結果分為超敏陰性組,超敏陽性組;按照治療時間又分為治療半年、1年、2年、3年,分別為47例、63例、41例、56例。入組標準:① 診斷均符合中國慢性乙型肝炎防治指南(2015版)的診斷標準,既往有乙肝病史或HBsAg陽性超過6個月;② 排除酒精性肝病、脂肪肝、自身免疫性肝病、其他嗜肝病毒以及環境因素引起的肝功能異常;③ 排除合并其他系統疾病,如心血管疾病、風濕免疫系統疾病、代謝性疾病等;④ 排除梅毒、艾滋病等感染性疾病。所有入組的研究對象均簽署知情同意書。
1.2 檢測方法
1.2.1HBV DNA兩種方法的血清水平檢測 收取患者空腹靜脈血標本,3 500 r/min離心5 min,分離血清,-80 ℃低溫保存,避免反復凍融。超敏HBV DNA水平檢測采用德國進口QlAsymphony磁珠吸附法全自動核酸檢測儀及其配套試劑,正常范圍≤20 IU/ml;傳統HBV DNA檢測采用美國Agilent Mx3000P檢測儀,試劑盒為上海復星長征醫學科學有限公司的乙型肝炎病毒核酸檢測試劑盒(PCR-熒光探針法),正常范圍≤500 IU/ml。
1.2.2其他臨床指標檢測 乙肝五項定量采用雅培化學發光檢測;肝功能采用美國 Beckman 公司全自動生化檢測儀及配套試劑分別檢測,其中包括ALT(正常范圍:9~50 U/L)、谷草轉氨酶(aspartate transaminase,AST)(正常范圍:15~40 U/L)、堿性磷酸酶(alkaline phosphatase,ALP)(正常范圍:35~135 U/L)、谷氨酰轉肽酶(glutamyltranspeptidase,GGT)(正常范圍:7~45 U/L)、總膽紅素(total bilirubin,TBIL)(正常范圍: 3.4~17.1 μmol/L)、直接膽紅素(direct bilirubin,DBIL)(正常范圍: 0.0~3.4 μmol/L)、白蛋白(albumin,ALB)(正常范圍:40~55 g/L)、球蛋白(globulin,GLB)(正常范圍: 20~40 g/L)。
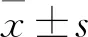
2 結果
2.1 超敏HBV DNA與ALT、HbeAg相關性入組221例核酸初治且傳統法檢測HBV DNA陰性的乙肝病毒感染者作為研究對象,超敏陽性率為44.34%;傳統檢測法(-)超敏檢測法(-)組123例,傳統檢測法(-)超敏檢測法(+)組98例,兩組中ALT異常率分別為23.58%(29/123),35.71%(35/98),χ2檢驗兩組比較差異有統計學意義(χ2=3.905,P=0.048);AST異常率分別為26.82%(33/123)、28.57%(28/98),兩組比較差異無統計學意義(χ2=0.083,P=0.773);HbeAg陽性率分別為21.95%、45.91%,兩組比較差異有統計學意義(χ2=14.264,P<0.05)。
2.2 肝功能中主要指標在兩組中的統計描述兩組中肝功能主要指標統計描述見圖1、表1。肝功能各指標血清學水平比較差異均無統計學意義(P>0.05)。

圖1 超敏(-)組與超敏(+)組兩組中ALT、AST血清水平比較
2.3 治療時間與超敏HBV DNA和ALT之間的趨勢關系進一步將所有患者按照治療時間長短分為未治療、半年、1年、2年、3年,超敏HBV DNA陽性率分別為74.49%、61.70%、52.38%、29.26%、33.93%,ALT異常率分別為41.61%、27.65%、34.92%、29.26%、26.78%。二者均采用Cochran-Armitage趨勢檢驗判斷與治療時間是否存在線性趨勢,檢驗結果顯示超敏HBV DNA與治療時間存在明顯的負性相關(χ2=39.823,P<0.001),即患者治療時間越長,超敏HBV DNA陽性率降低,而ALT也有一定的趨勢關系(χ2=4.029,P=0.045)。另外結果顯示抗病毒治療半年、1年、2年,超敏HBV DNA陽性率均大于50%。

表1 兩組中各肝功能指標統計描述
2.4 傳統PCR法檢測HBV DNA陰性的CHB患者其ALT異常中超敏HBV DNA陽性率ALT異常中超敏 HBV DNA陽性率分別為77.41%、76.92%、59.09%、30.77%、31.25%。采用Fisher精確檢驗(2×C)結果顯示,5組差異有統計學意義(χ2=18.922,P=0.001);兩兩比較采用Bonferroni法調整α水平,結果顯示未治療組與治療2年、3年差異有統計學意義(P=0.002,P=0.001)。
3 討論
HBV DNA定量檢測主要用于判斷患者體內病毒的復制情況,指導治療方案的選擇和療效的判斷。現臨床上應用較多的是傳統熒光PCR檢測技術,采用熱裂解法人工進行血清核酸提取純化,項目價格低,故臨床應用較廣,但對于病毒載量≤500 IU/ml的患者無法精確定量分析,從而造成漏檢,而超敏HBV DNA檢測技術定量線性范圍寬,降低了漏檢率,采用磁珠吸附法全自動核酸提取系統對血清標本進行核酸提取純化,回收率高,重復性好,定量方法采用內源性內參,定量分析更加準確,對于低病毒載量的患者更具優勢[6-7]。
戎國棟 等[8]研究結果顯示超敏法陽性檢出率高于傳統PCR法,差異有統計學意義(P<0.05)。本研究入組221例抗病毒治療且傳統法檢測HBV DNA陰性的乙肝病毒感染者,超敏陽性率為44.34%,靈敏度相較于傳統法檢測的HBV DNA更高,差異有統計學意義(P<0.05),與上述報道觀點一致,同時研究結果也表明傳統法檢測HBV DNA陰性的患者,超敏HBV DNA可能為陽性,而HBV DNA能直接反映患者體內病毒量的多少,也是病毒復制活躍程度的直接指標,因此不容忽視。
HbeAg是由HBV核心基因(前C區)編碼的可溶性蛋白,是病毒復制、傳染的主要指標,與血清HBV DNA水平變化有很好的一致性;ALT主要存在于肝細胞質中,是反映肝細胞早期損害極為敏感的指標[9-10]。本研究按照超敏結果分為兩組,結果顯示超敏檢測組(+)中ALT異常率和HbeAg陽性率較超敏檢測組(-)差異有統計學意義(P<0.05),與張玥 等[11]報道的結果一致。本研究兩組中肝功能各指標血清學水平比較差異均無統計學意義(P>0.05),這與石玉如 等[12]人的報道并不一致,考慮可能為超敏檢測法(+)組較報道中高濃度組HBV DNA水平低有關,但研究結果顯示超敏檢測組(+)中ALT、AST、ALP和ALB血清學水平均略高于超敏檢測組(-)。故超敏HBV DNA同時結合乙型肝炎五項與肝功能聯合診斷,能更好地了解病毒復制情況和肝細胞損害程度,為治療提供可靠的臨床依據[13]。
實際臨床工作中,部分抗病毒治療的慢性HBV感染患者HBV DNA≤500 IU/ml,但ALT和(或)AST顯示異常,排除其他原因導致的肝功能異常,病毒導致肝臟炎癥性損傷仍是重點考慮因素。本研究結果顯示ALT異常中超敏DNA的陽性率與抗病毒治療時間成反比,但在接受治療2年后陽性率仍高達59.09%,說明病毒低水平復制造成肝臟持續炎癥反應可能為ALT異常的主要原因。值得注意的是隨著治療時間的增加,ALT異常率并沒有明顯的下降趨勢,未治療、半年、1年的異常率分別為41.61%、27.65%、34.92%,目前暫考慮與入組樣本量少有關。另外,抗病毒治療2年、3年的超敏HBV DNA陽性率分別為29.26%、33.93%,而ALT異常患者中超敏HBV DNA陽性率分別為30.77%、31.25%,二者都存在一定程度的升高,具有一致性,這表明患者對藥物的應答率下降,超敏HBV DNA的定量檢測對藥效評估,耐藥預測有一定價值[14]。
綜上所述,超敏HBV DNA定量檢測對傳統法檢測HBV DNA陰性,尤其是肝功能異常的患者有較高的臨床監測價值。有關超敏HBV DNA的定量結果與肝臟硬度測量值、乙肝五項定量結果等乙肝相關指標需要進一步探索分析。

