辛基羥肟酸在氟碳鈰礦表面的吸附機理
王介良,曹釗,王建英,張雪峰,雷霄,馮宏杰
(1.內蒙古科技大學 礦業研究院,內蒙古 包頭,014010;2.廣東省資源綜合利用研究所,廣東 廣州,510650;3.稀有金屬分離與綜合利用國家重點實驗室,廣東 廣州,510650;4.內蒙古科技大學 內蒙古自治區白云鄂博礦多金屬資源綜合利用重點實驗室,內蒙古 包頭,014010)
稀土被譽為“工業味精”、新世紀高科技及功能材料的“寶庫”,是發展高新技術的戰略性元素[1],廣泛應用于電子、石油化工、冶金、機械、能源、輕工、環境保護、農業及國防工業等領域[2-3]。氟碳鈰礦是輕稀土的主要來源[4],其為半可溶性鹽類礦物,主要包括鈰和鑭等稀土元素,分子式為 RECO3F,稀土氧化物的質量分數約為75%。浮選是氟碳鈰礦富集回收的主要方法[5],針對氟碳鈰礦捕收劑的研究主要集中在脂肪酸[6]、烷基羥肟酸[2]、萘系羥肟酸[7-9]、磷(膦)酸類[10-11]等。其中,脂肪酸類捕收劑選擇性差,浮選溫度高,添加大量抑制劑[12],磷(膦)酸鹽類捕收劑在酸性條件下才能取得較好的浮選效果[13],均未被廣泛應用于氟碳鈰礦的工業生產。羥肟酸類捕收劑對稀土浮選的選擇性強,在我國包頭、冕寧、微山湖稀土礦[14]以及美國 Mountain pass[15]、加拿大 Nechalacho[16]、澳大利亞 Mt Weld[17]等稀土礦得到成功應用。捕收劑在氟碳鈰礦表面的作用機制已有相關研究。王成行等[18-19]通過結合紅外光譜和 XPS 測試研究認為水楊羥肟酸、辛基羥肟酸在氟碳鈰礦表面的吸附為化學吸附,生成穩定的—C=O—RE—O—N—五元環螯合物;任俊等[20]研究認為1-羥基-2-萘羥肟酸與氟碳鈰礦表面Ce3+生成螯合物的化學吸附的同時,存在不均勻的物理吸附。吸附動力學和熱力學計算廣泛應用于環境科學技術[21]和選礦技術研究,曹永丹等[22]通過吸附動力學和熱動力學計算,表明 Cu2+和 Ni2+在蛇紋石表面的吸附機理是單層吸附;朱玉霜等[23]在 12~55℃的條件下測試辛基羥肟酸在錫石表面的吸附量,并通過計算出的吸附熱判斷出辛基羥肟酸在錫石表面的吸附過程為化學吸附;徐龍華等[24]通過吸附等溫線測量、熒光探針技術以及沉降實驗等研究,從微觀上描述了季銨鹽在高嶺石表面的吸附特性和吸附層結構;張國范等[25]通過吸附量測試及溶液化學計算等研究手段發現:當 pH 為 7左右時,油酸鈉在閃鋅礦表面主要發生化學吸附,礦物表面成分為(C17H33COO)2Zn,其表面還有可能有物理吸附;當pH為10時,吸附則主要以物理吸附為主;而通過吸附的動力學和熱力學行為來分析羥肟酸捕收劑在氟碳鈰礦表面的作用機理的研究少有報道。因此,本文作者通過辛基羥肟酸 OHA在氟碳鈰礦表面的吸附動力學和熱力學研究闡明辛基羥肟酸 OHA在氟碳鈰礦表面的吸附行為,并結合純礦物浮選實驗、Zeta電位測試及XPS分析辛基羥肟酸OHA在礦物表面的吸附機理。
1 實驗
1.1 試樣制備
氟碳鈰礦取自山東微山湖稀土礦,經手選除雜、破碎、磨礦及重選除雜和弱磁選除磁鐵礦后,得到38~75 μm粒級的氟碳鈰礦單礦物作為單礦物實驗用純礦物,其REO品位為71.21%,按氟碳鈰礦理論REO品位74.88%計算,其純度為95%左右。
1.2 主要試劑
實驗所用辛基羥肟酸(OHA)、NaOH和HCl等試劑均為分析純,實驗用水為去離子水。
1.3 實驗方法
1.3.1 氟碳鈰礦吸附OHA動力學和熱力學
1)吸附量測定。使用UV-L5S紫外可見分光光度計進行吸附量的測定,根據辛基羥肟酸OHA與Fe3+絡合顯色的原理,在25 mL容量瓶中加入10 mL待測OHA溶液,再加入5 mL無水乙醇,1 mL質量分數為1%的FeCl3溶液,加水定容,搖勻靜置10 min,以空白試劑作參比,在500 nm處測定辛基羥肟酸的吸光度A。配置不同質量濃度OHA溶液,繪制OHA的標準曲線[26]如圖1所示。通過標準曲線計算過濾液中的OHA質量濃度,再根據吸附量公式(1)計算OHA在礦物表面藥劑的吸附量。
2)吸附動力學。將0.5 g 氟碳鈰礦加入30 mL、159.23 mg/L的 OHA溶液中,調至一定pH,吸附反應溫度為25℃,在磁力轉子攪拌器上攪拌,吸附t時刻后過濾,用UV-L5S紫外可見分光光度計測量濾液OHA質量濃度ρt,按照式(1)計算出氟碳鈰礦t時刻的OHA吸附量qt。將氟碳鈰礦對 OHA的吸附過程進行一級和二級動力學擬合,擬合方程分別如式(2)和式(3)所示,動力學擬合參數見表1。
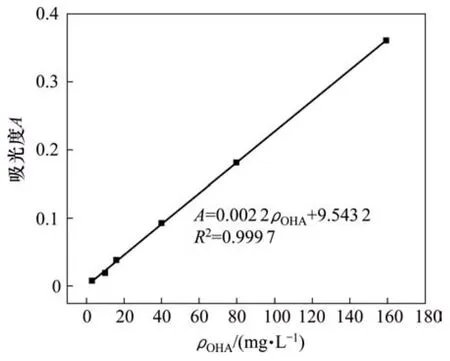
圖1 辛基羥肟酸溶液的吸光度標準曲線Fig.1 Standard adsorption curve of OHA solution
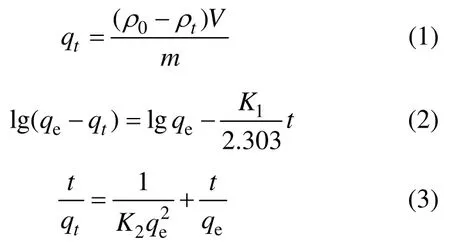
式中:ρ0和ρt分別為OHA初始質量濃度和吸附t時刻后過濾液殘余質量濃度,mg/L;V為礦漿體積,L;m為氟碳鈰礦質量,g;qe和qt分別為平衡吸附量和t時刻吸附量,mg/g;K1為一級吸附速率常數,min-1;K2為二級吸附速率常數,g/(mg·min)。
3)吸附熱力學。配制質量濃度分別為 15.923,39.808,79.615,119.423和159.230 mg/L的OHA溶液,每種各取30 mL置于100 mL 燒杯中,加入0.5 g的氟碳鈰礦后調整到一定pH,吸附反應溫度為25℃,達到吸附平衡后采用中速濾紙進行過濾,用UV-L5S紫外可見分光光度計測試濾液中殘余 OHA的質量濃度,按照式(4)計算出平衡吸附量qe,對氟碳鈰礦吸附OHA過程分別進行 Langmuir等溫吸附方程擬合和Freundlich等溫吸附方程擬合,Langmuir 等溫吸附方程和 Freundlich 等溫吸附方程公式分別如式(5)和式(6)所示。
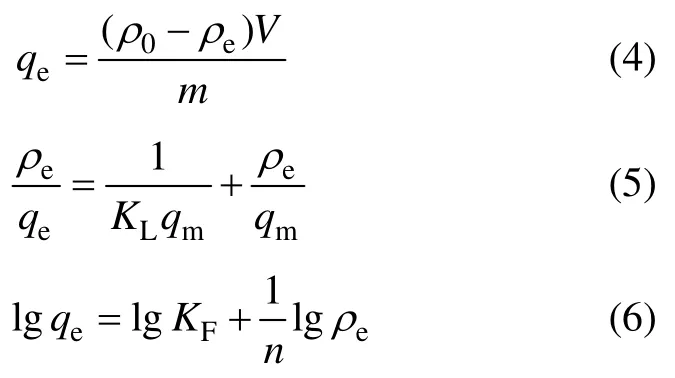
式中:ρe為OHA吸平衡后過濾液殘余質量濃度,mg/L;qm為飽和吸附量,mg/g;KL為 Langmuir吸附常數,L/mg;KF為 Freundlich 吸附常數;1/n為吸附強度。
1.3.2 純礦物浮選實驗
氟碳鈰礦浮選在 XFGCII-35型試驗室用充氣掛槽浮選機中進行,葉輪轉速1 992 r/min,浮選溫度為室溫,每次稱取2.00 g實驗礦樣加入到40 mL浮選槽中,加30 mL去離子水,采用HCl或NaOH調整到指定pH,加入一定質量濃度的OHA,每次加藥后調漿2 min,浮選前將pH再調整到指定pH,然后浮選刮泡4 min,對泡沫產品和槽內產品分別過濾、干燥稱質量,計算浮選回收率。
1.3.3 Zeta電位測試
采用 Brookhaven ZetaPlus Analyzer分析儀測試Zeta電位。將純礦物用瑪瑙研缽研磨至粒徑小于 5 μm,每次精確稱取10 mg置于100 mL 1 mmol/L的KCl溶液中,用HCl或NaOH調節pH,依次加入一定量的EDTA或OHA,每次加藥后磁力攪拌5 min,取上述樣品加入樣品池,在Zetaplus Zeta電位測定儀上測量,每個樣品重復測量3次,取平均值作為相應pH條件下的Zeta電位。
1.3.4 XPS測試
采用Thermo Scientific ESCALAB 250Xi 型X線光電子能譜儀進行XPS測試。稱取1 g氟碳鈰樣品置于小燒杯中,用HCl或NaOH調節pH至9.5左右,按照浮選條件加入一定濃度的浮選藥劑,每次加藥后磁力攪拌5 min,過濾并用相同pH去離子水洗滌礦物2次,將過濾產物50℃下真空干燥后進行XPS測試。XPS測試條件為:單色化Al Kα射線光源,射線能量hν=1 486.6 eV,光斑直徑為 500 μm,真空度為 5×10-8Pa,C 1s矯正值為284.8 eV;全譜掃描結合能范圍為0~1 300 eV,步長為1.0 eV,通過能為100 eV;N 1S高分辨譜通過能為 30 eV,步長為 0.05 eV。采用CasaXPS進行譜峰分析和分峰擬合。
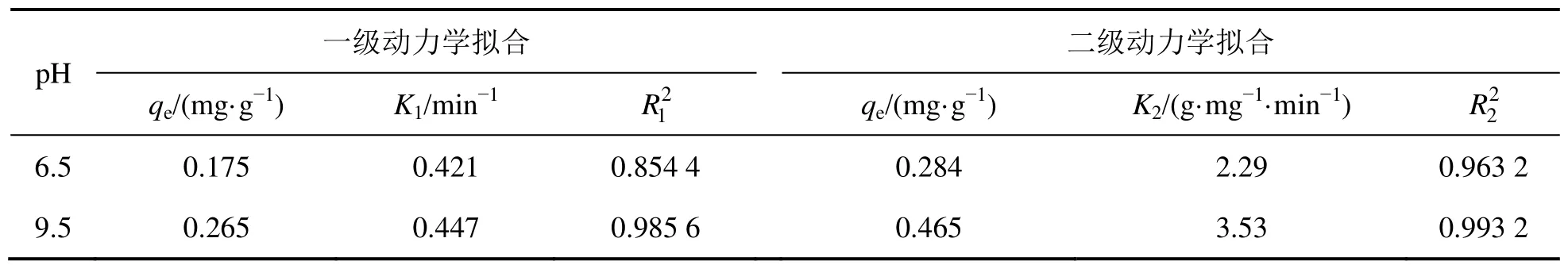
表1 氟碳鈰礦吸附辛基羥肟酸的動力學擬合參數Table 1 Kinetics fitting parameters of OHA adsorption on bastnaesite
2 結果與討論
2.1 氟碳鈰礦吸附OHA動力學和熱力學
2.1.1 吸附動力學
圖2所示為辛基羥肟酸OHA質量濃度為159.23 mg/L、溫度為25℃、吸附時間為15 min時,pH對氟碳鈰礦吸附辛基羥肟酸OHA的影響。由圖2可知:當pH小于9.5時,隨pH升高,辛基羥肟酸OHA在氟碳鈰礦表面吸附量增大;當pH大于9.5時,隨pH升高,辛基羥肟酸OHA在氟碳鈰礦表面吸附量減小。當 pH=9.5時,辛基羥肟酸在氟碳鈰礦表面吸附量最大。分析認為,隨pH增大,辛基羥肟酸解離程度大,溶液中辛基羥肟酸根離子含量增加,從而增大其在氟碳鈰礦表面的化學吸附;而pH過高(pH>9.5)時,礦物表面電負性增強,由于靜電斥力而阻礙辛基羥肟酸陰離子在礦物表面的吸附,導致辛基羥肟酸在氟碳鈰礦表面的吸附量減小。

圖2 pH對氟碳鈰礦吸附辛基羥肟酸的影響Fig.2 Effect of pH on adsorption amount of OHA on bastnaesite
圖3所示為辛基羥肟酸OHA質量濃度為159.23 mg/L、溫度為25℃時,在pH為6.5和9.5條件下,氟碳鈰礦對辛基羥肟酸 OHA吸附量隨時間的變化曲線。由圖3可知:隨吸附時間增加,辛基羥肟酸吸附量逐漸增加,吸附時間為10 min時,氟碳鈰礦吸附辛基羥肟酸OHA趨于平衡。
圖4和圖5所示分別為辛基羥肟酸OHA質量濃度為159.23 mg/L、溫度為25℃時,在pH為6.5和9.5條件下,氟碳鈰礦吸附辛基羥肟酸的一級動力學擬合和二級動力學擬合結果,擬合參數見表1。由表1可知:擬合指數,說明氟碳鈰礦吸附辛基羥肟酸OHA更符合二級動力學模型;pH=9.5時氟碳鈰礦吸附辛基羥肟酸的二級動力學擬合吸附速率常數(3.53)大于pH=6.5時吸附速率常數(2.29),說明pH=9.5時,辛基羥肟酸OHA在氟碳鈰礦吸附更快。
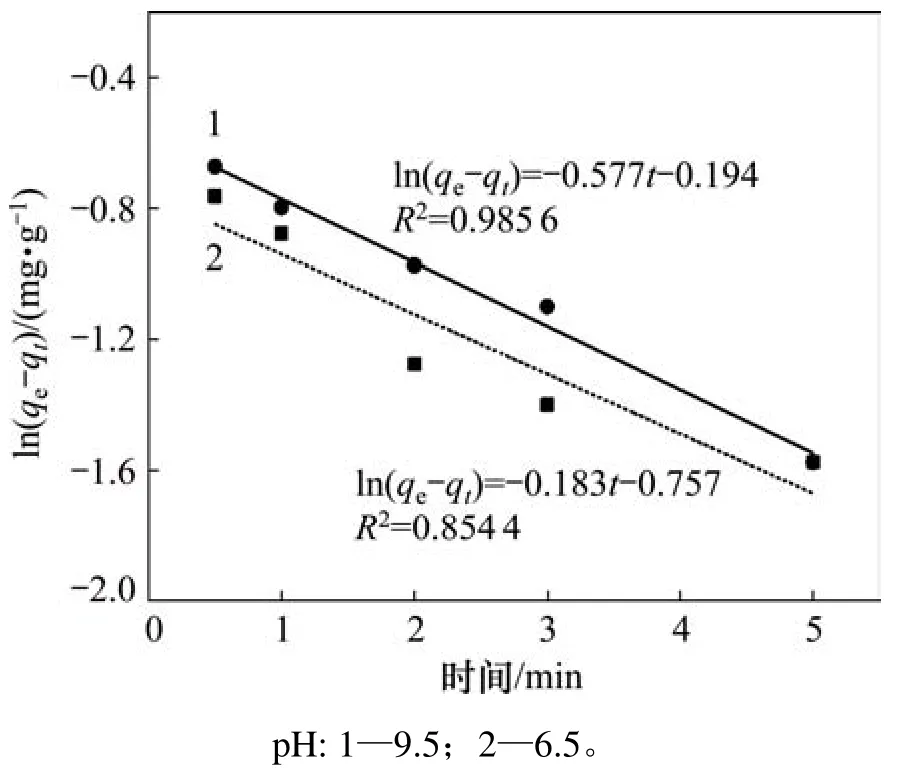
圖4 氟碳鈰礦吸附辛基羥肟酸的一級動力學擬合Fig.4 First-order kinetics fitting of OHA adsorption on bastnaesite
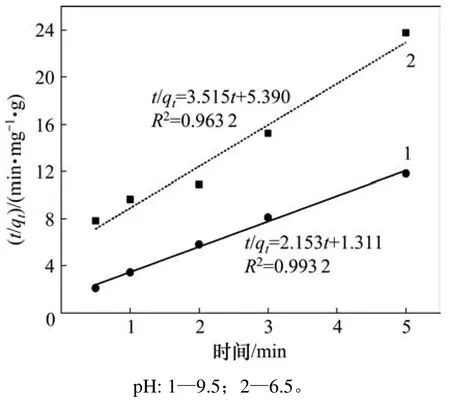
圖5 氟碳鈰礦吸附辛基羥肟酸的二級動力學擬合Fig.5 Second-order kinetics fitting of OHA adsorption on bastnaesite
2.1.2 吸附熱力學
圖6所示為pH分別為6.5和9.5、溫度為25℃時,氟碳鈰礦對辛基羥肟酸 OHA吸附量隨濃度的變化曲線。由圖6可知:隨辛基羥肟酸OHA質量濃度的增加,氟碳鈰礦對辛基羥肟酸 OHA吸附量隨之增大;pH=9.5時,辛基羥肟酸OHA在氟碳鈰礦表面吸附量隨辛基羥肟酸 OHA質量濃度的增加而增大的趨勢更明顯,說明溶液pH為9.5時較pH為6.5時更有利于辛基羥肟酸OHA在氟碳鈰礦表面的吸附。
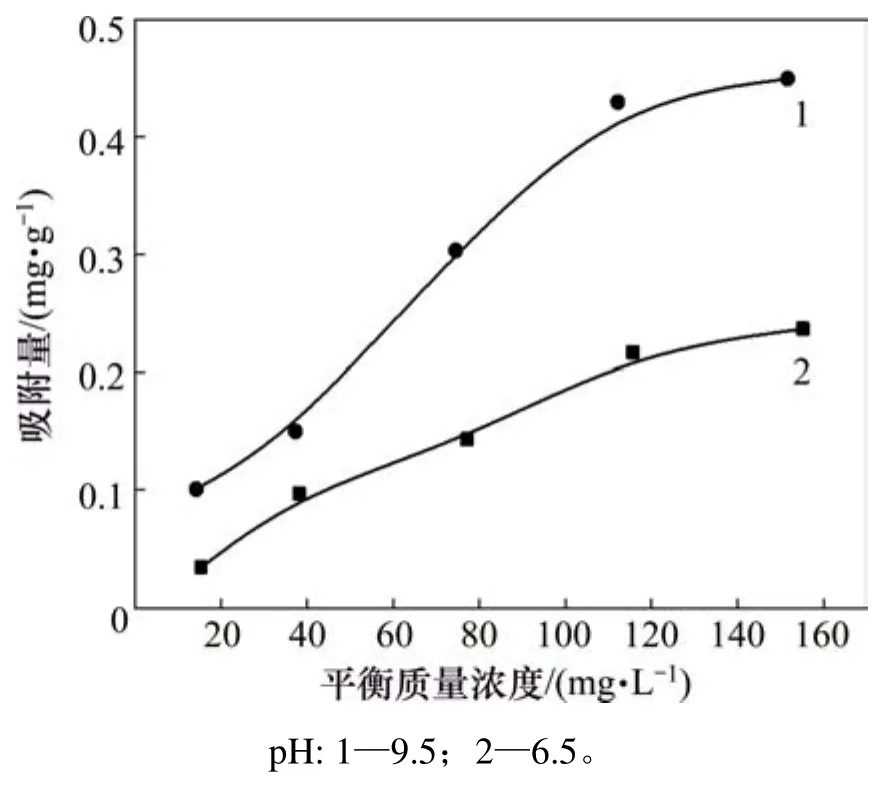
圖6 辛基羥肟酸濃度對吸附量的影響Fig.6 Effect of OHA mass concentration on adsorption mount of OHA on bastnaesite
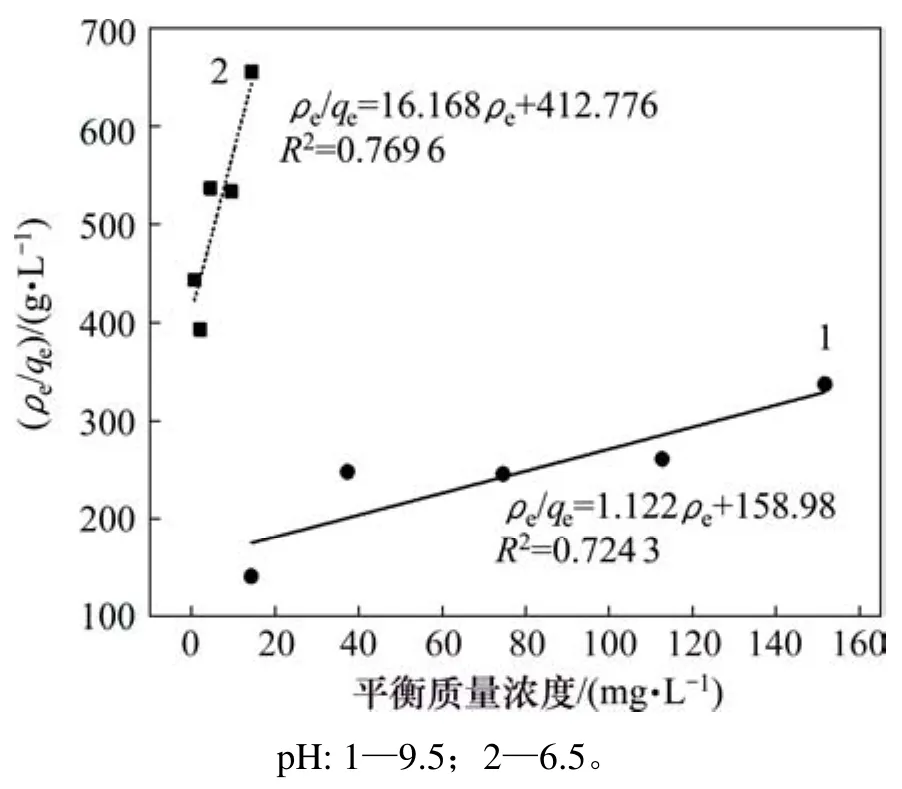
圖7 氟碳鈰礦吸附辛基羥肟酸的Langmuir擬合Fig.7 Langmuir fitting of OHA adsorption on bastnaesite

圖8 氟碳鈰礦吸附辛基羥肟酸的Freundlich擬合Fig.8 Freundlich fitting of OHA adsorption on bastnaesite

表2 氟碳鈰礦吸附辛基羥肟酸的等溫擬合參數Table 2 Isothermal adsorption fitting parameters of OHA on bastnaesite
圖7和圖8所示分別為pH為6.5和9.5、溫度為25℃時,氟碳鈰礦吸附辛基羥肟酸的 Langmuir和Freundlich擬合,擬合參數見表2。由表2可知:等溫擬合指數,說明氟碳鈰礦吸附辛基羥肟酸符合Freundlich等溫吸附方程,辛基羥肟酸OHA在氟碳鈰礦表面的吸附是多層、不均勻吸附,即同時存在物理吸附和化學吸附。Freundlich方程中非線性指數1/n反映吸附質吸附位點能量分布特征,吸附常數KF反映吸附能力的強弱,KF越大,吸附能力越大;1/n越小,吸附強度越大[27]。由表2可知:氟碳鈰礦在 pH=9.5時吸附辛基羥肟酸 OHA能力優于 pH=6.5時的吸附能力。
2.2 純礦物浮選
固定辛基羥肟酸OHA用量為40 mg/L、浮選溫度為25℃,考察pH對氟碳鈰礦可浮性的影響,結果如圖9所示。由圖9可知:當礦漿pH小于9.5時,隨著pH升高,氟碳鈰礦的浮選回收率增大,在pH=9.5時,氟碳鈰礦達到最大回收率86.73%;當礦漿pH大于9.5時,隨著 pH升高,氟碳鈰礦的浮選回收率減小,氟碳鈰礦浮選的最佳pH為9.5,結合pH對氟碳鈰礦吸附辛基羥肟酸的影響結果(圖2)可知,辛基羥肟酸在氟碳鈰礦表面吸附量越大,其浮選回收率越高。
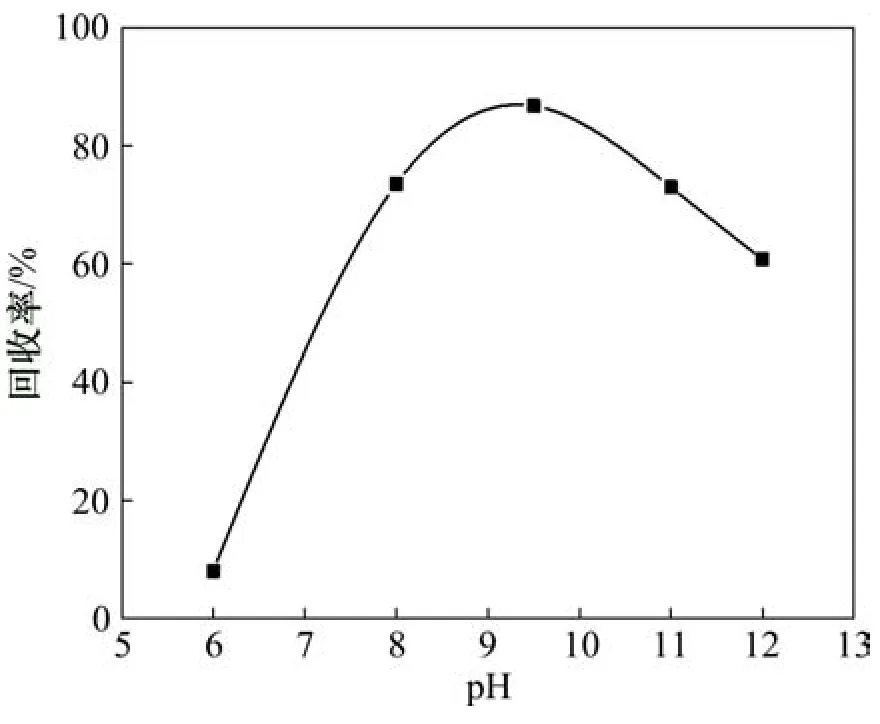
圖9 pH對氟碳鈰礦可浮性的影響Fig.9 Effect of pH on floatability of bastnaesite
固定礦漿pH=9.5、浮選溫度為25℃,考察辛基羥肟酸 OHA用量對氟碳鈰礦可浮性的影響,結果如圖10所示。由圖10可知:隨著辛基羥肟酸OHA用量的增加,氟碳鈰礦的浮選回收率增大,當辛基羥肟酸OHA用量大于40 mg/L時,繼續增加辛基羥肟酸OHA用量,氟碳鈰礦回收率基本不再增加,因此,氟碳鈰礦浮選的最佳辛基羥肟酸OHA用量為40 mg/L。
2.3 辛基羥肟酸與氟碳鈰礦作用的Zeta電位測試
圖11所示為辛基羥肟酸OHA質量濃度對氟碳鈰礦Zeta電位的影響。由圖11可知:無OHA時,氟碳鈰礦等電點為 pH=6.8 左右;與 OHA作用后的氟碳鈰礦Zeta電位負移,主要為帶負電的羥肟酸根離子和中性羥肟酸分子在氟碳鈰礦表面吸附后,降低或屏蔽了氟碳鈰礦表面的正電性所致;且隨著辛基羥肟酸OHA質量濃度的大,氟碳鈰礦Zeta電位負移程度增大,說明隨辛基羥肟酸質量濃度增大,其在氟碳鈰礦表面吸附量增加,這與辛基羥肟酸 OHA濃度和氟碳鈰礦吸附量的關系研究結果一致。
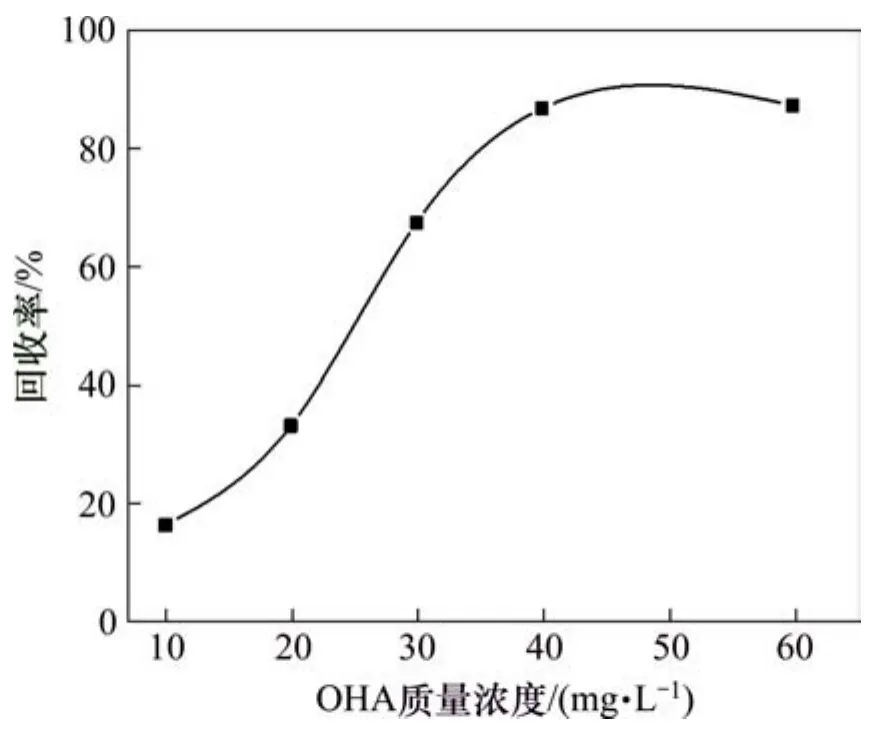
圖10 辛基羥肟酸質量濃度對氟碳鈰礦可浮性的影響Fig.10 Effect of OHA mass concentration on floatability of bastnaesite
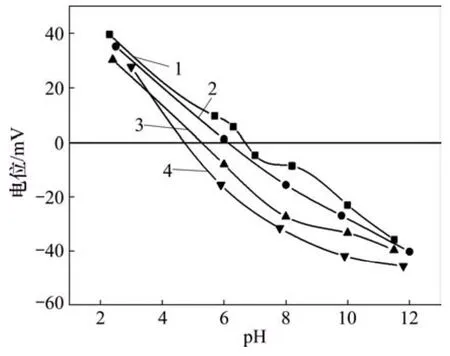
圖11 辛基羥肟酸質量濃度對氟碳鈰礦Zeta電位的影響Fig.11 Zeta potentials of bastnaesite as function of OHA mass concentration
2.4 辛基羥肟酸與氟碳鈰礦作用的 XPS分析

圖12 辛基羥肟酸、辛基羥肟酸鈰沉淀物及辛基羥肟酸作用前后氟碳鈰礦XPS全譜Fig.12 XPS survey scan of OHA,OHA-Ce,bastnaesite before and after conditioned with OHA
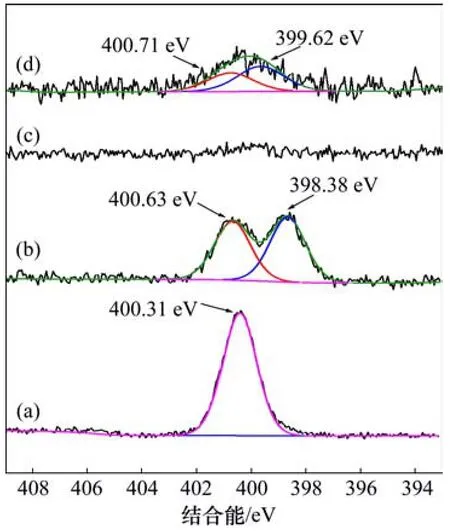
圖13 辛基羥肟酸、辛基羥肟酸鈰沉淀物及辛基羥肟酸作用前后氟碳鈰礦N 1s XPS 窄譜Fig.13 N1s XPS narrow scan of OHA,OHA-Ce,bastnaesite before and after conditioned with OHA
圖12和圖13所示分別為辛基羥肟酸OHA、辛基羥肟酸鈰沉淀物及辛基羥肟酸作用前后氟碳鈰礦的XPS全譜及N 1s XPS 窄譜。由圖12(a)和(b)可知:OHA XPS全譜在 400 eV左右處出現 N峰,OHA與Ce反應生成絡合沉淀XPS全譜在880~915 eV,100 eV和200 eV處出現Ce峰。從圖13(a)和(b)可知:OHA在 400.3 eV處為 1對稱峰,OHA與Ce反應后N峰分裂為400.63 eV 和398.38 eV 2處峰;由圖12(c)和(d)可知:與辛基羥肟酸作用前,氟碳鈰礦表面無N峰,與辛基羥肟酸作用后,氟碳鈰礦表面400 eV處出現N峰。從圖13(c)和(d)可知:OHA作用后氟碳鈰礦表面 N 1s 峰擬合為400.71 eV和399.62 eV 2處峰,這與OHA與Ce反應生成絡合沉淀物的N 1s 峰位相一致。Ni等[28-29]研究表明辛基羥肟酸 N 1s 峰僅在 400.3 eV 處有1對稱峰,但在燒綠石等礦物表面吸附后,其N 1s 峰分裂為 400.6 eV 和 399 eV 左右的2處峰,分別對應于中性羥肟酸分子R—CO—NH—OH 和去質子后的羥肟酸根 R—CO—NH—O—,即分別代表羥肟酸在礦物表面的物理吸附和化學吸附,表明辛基羥肟酸在氟碳鈰礦表面的吸附是化學吸附和物理吸附共存,這與吸附熱力學研究結果相符合,且辛基羥肟酸在氟碳鈰礦表面吸附后N 1s 399.62 eV處化學吸附峰較400.71 eV處物理吸附峰更強,說明辛基羥肟酸在氟碳鈰礦表面的吸附以化學吸附為主。
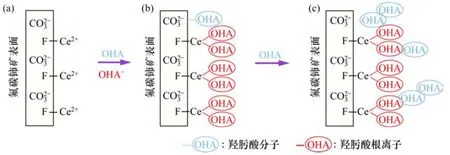
圖14 辛基羥肟酸在氟碳鈰礦表面的吸附過程模型Fig.14 Possible adoption process of OHA on bastnaesite surface
根據以上實驗及測試分析,可推測辛基羥肟酸OHA在氟碳鈰礦表面的吸附過程如圖14所示。由圖14可知:辛基羥肟酸在氟碳鈰礦表面同時發生化學吸附和物理吸附,辛基羥肟酸對氟碳鈰礦的吸附作用機制:1)羥肟酸根陰離子OHA-與氟碳鈰礦表面暴露的Ce3+發生螯合反應生成OHA-Ce沉淀,形成化學吸附;2)羥肟酸 OHA分子中的氫與氟碳鈰礦表面中的氧形成氫鍵,發生物理吸附;3)溶液中游離的羥肟酸分子OHA與在氟碳鈰礦表面已吸附的OHA分子生成氫鍵和烴鏈間疏水締合作用,形成不均勻的物理吸附層。
3 結論
1)辛基羥肟酸在氟碳鈰礦表面吸附符合二級動力學模型,等溫吸附過程符合Freundlich吸附模型;弱堿性條件下(pH=9.5)辛基羥肟酸在氟碳鈰礦表面的吸附速度更快、吸附量更大,該條件下氟碳鈰礦的浮選回收率最高。
2)辛基羥肟酸在氟碳鈰礦表面的吸附為多層、不均勻吸附,是物理吸附和化學吸附共同作用的結果,但以化學吸附為主。吸附機理為:羥肟酸根陰離子OHA-與氟碳鈰礦表面暴露的 Ce3+發生螯合反應生成OHA-Ce沉淀,形成化學吸附;羥肟酸分子OHA與氟碳鈰礦表面的氧以氫鍵形式形成物理吸附,同時,溶液中游離的羥肟酸分子 OHA與氟碳鈰礦表面已吸附上的 OHA分子形成氫鍵和烴鏈間疏水締合作用,產生不均勻的物理吸附。

