山茶油抑菌性能和機理的研究
李橋妹 黎冬明 洪艷平 鄭國棟
(江西農業大學食品科學與工程學院;江西省天然產物與功能食品重點實驗室,南昌 330045)
山茶油屬于山茶科油茶樹種子的提取物,是我國唯一能與西方橄欖油相媲美的高含油酸的特種油脂,被譽為“東方的橄欖油”[1]。山茶油具有良好的保健功能,不飽和脂肪酸可以有效預防冠心病、高血壓等心血管疾病,活性物質、山茶皂素、茶多酚等分別具有強心、溶血栓及降低膽固醇等作用,甾醇、生育酚、角鱉烯等能增強兔疫功能,提高人體抗病能力,延緩人體衰老[2]。
山茶油在臨床應用上具有較好的消炎作用,它不僅能解決幼兒因尿布引起的濕疹等皮膚疾病,也能用于皮膚輕度燒傷、燙傷等,具有很好的治療效果[3]。此外,山茶油還具有清熱抗炎、抗紫外線、抗菌等功效。
目前對山茶油抑菌機理的研究還鮮見相關報道,蔣艷玲等[4~5]比較了粗制茶油與精制茶油對各種微生物的抑菌效果,研究結果表明,無論粗制還是精制的山茶油在較低體積濃度都可抑制菌體生長,而且抑菌作用受pH和溫度的影響較小,在pH4~9之間,茶油具有較好的抑菌效果,其抑菌作用在120 ℃的高溫下不受影響,充分說明山茶油抑制微生物的成分具有很高的穩定性。
當前,我國的茶油主要以食用為主,在醫療、食品和化妝領域均有廣闊的發展前景[6-8]。從目前對山茶油抑菌效果的研究可知,山茶油具有很好的抑菌作用,但是抑菌機理尚不明確。本研究以大腸桿菌和金黃色葡萄球菌為實驗菌,對山茶油的抑菌機理進行探討,皆在為山茶油的進一步開發應用提供參考。
1 材料與方法
1.1 實驗材料與儀器
1.1.1 實驗材料
山茶油;牛血清白蛋白(BSA);考馬斯亮藍G-2509;丙酮、95%乙醇、85%磷酸、NaCl:AR;大腸桿菌(Escherichiacoli)、金黃色葡萄球菌(Staphylococcusaureus)。
1.1.2 主要儀器
V-5600型可見分光光度計;DDS-308+型智能電導率儀。
1.2 方法
1.2.1 丙酮的抑菌作用驗證
移取10mL培養液于各試管中,加入0.2 mL菌懸液,加入0、0.6、1.2、1.56、1.68、1.74、1.764 mL丙酮,再加入相對應體積的無菌生理鹽水,配制成總體積為12 mL的混合液,于37 ℃恒溫培養24 h后,測定各試管中OD600值。
1.2.2 山茶油最低抑菌濃度(MIC)的測定
參照呂淑霞等[9]對乳酸鏈球菌素(Nisin)抑菌作用及其抑菌機理的研究。移取10 mL培養液于試管中,加入0.2 mL菌懸液,加入相對應體積的山茶油和丙酮,使其配制成一系列濃度的總體積為12 mL的混合液:10%、5%、2%、1%、0.5%、0.3%,于37 ℃恒溫培養24 h。陽性對照:僅含菌,不含山茶油和丙酮;陰性對照:不加菌懸液,為同一系列濃度的山茶油混合液。測定各試管中OD600值,與陰性對照管OD600值相同的最小山茶油濃度,即為最低抑菌濃度。
1.2.3 山茶油對菌生長曲線的影響
參照呂淑霞等[9]的研究。向培養液中加入菌懸液、山茶油、丙酮,配制成最低抑菌濃度的混合液,于37 ℃恒溫培養,以不加山茶油與丙酮為對照組,每隔1 h取樣測定OD600值,平行測定3次,取平均值,繪制OD600值隨時間而變化的曲線。
1.2.4 堿性磷酸酶含量測定
參照周先漢等[10]對蜂膠提取物抑菌活性及其抑菌機理的研究。向培養液中加入菌懸液、山茶油、丙酮,配制成最低抑菌濃度的混合液,于37 ℃恒溫培養,作用0、5、15、30、90、120、180 min后,取樣于510 nm下測吸光度,平行測定3次,取平均值,同時做不含山茶油與丙酮的對照,繪制OD510值隨時間而變化的曲線[12]。
1.2.5 電導率值測定
參照孫京新等[11]對茶多酚對假單胞菌抑菌機理研究。向培養液中加入菌懸液、山茶油、丙酮,配制成最低抑菌濃度的混合液,于37 ℃恒溫培養,作用0、5、15、30、90、120、180 min后,從中移取一小部分,用于電導率的測定,同時測定不含山茶油與丙酮的對照,以時間為橫坐標,電導率值為縱坐標,繪制變化曲線。
1.2.6 還原糖含量測定
向培養液中加入菌懸液、山茶油、丙酮,配制成最低抑菌濃度的混合液,于37 ℃恒溫培養,作用1、2、3、4、5、6、17 h后,取1 mL待測液于試管中,將1 mL DNS溶液加入其中,在沸水中煮沸5 min后,取出,立即加入8 mL蒸餾水,使其快速降溫,于540 nm處測吸光值,平行測定,同時測定不含山茶油與丙酮的對照。根據葡萄糖標準曲線,將OD540值轉換成相對應的還原糖含量值,繪制還原糖含量隨時間而變化的曲線。
1.2.7 蛋白質含量測定
參照張赟彬等[12]荷葉精油對肉類食品中常見致病菌的抑菌機理研究及趙英永等[13]對考馬斯亮藍G-250染色法測定草烏中可溶性蛋白質含量的研究進行測定。向培養液中加入菌懸液、山茶油、丙酮,配制成最低抑菌濃度的混合液,于37 ℃恒溫培養,用考馬斯亮藍G-250法測定培養液中蛋白質含量,于0、3、6、18、36 h取樣,于595 nm處測吸光度,同時設正常組對照[12~13]。根據蛋白質標準曲線,將OD540值轉換成相對應的蛋白質含量值,繪制出OD540值隨時間變化的曲線。
2 結果與討論
2.1 丙酮的抑菌作用驗證
比較加入一定體積丙酮的混合液吸光值與僅含菌懸液的吸光值,見表1。兩者之間相差較小,可得大腸桿菌和金黃色葡萄球菌的生長繁殖受丙酮的影響較小。
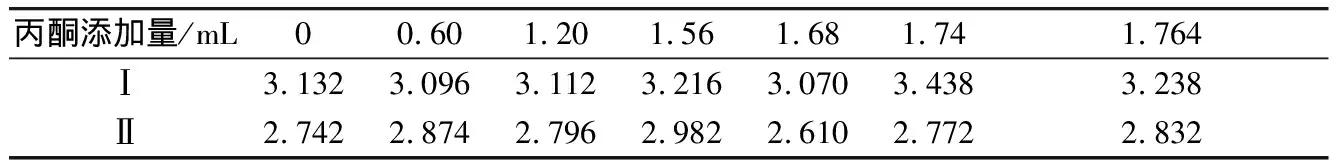
表1 丙酮的抑菌性驗證
注:“Ⅰ”代表含大腸桿菌的混合液吸光值,“Ⅱ”代表含金黃色葡萄球菌的混合液吸光值。
2.2 山茶油抑菌性能
2.2.1 山茶油最低抑菌濃度的測定
以金黃色葡萄球菌、大腸桿菌為試驗菌,通過測定各試管的OD600值,來判斷菌的生長情況。由表2可知,當山茶油濃度為10%、5%、2%、1%、0.5%時,含大腸桿菌的混合液吸光值與未加菌的山茶油混合液吸光值幾乎一致,即無菌生長;而當山茶油濃度降為0.3%時,含大腸桿菌的混合液吸光值劇增至1.244,由此可證明0.3%的山茶油濃度已經不能抑制大腸桿菌的生長了,即有菌生長,由此可說明能抑制大腸桿菌的最低山茶油濃度為0.5%,同理可知能抑制金黃色葡萄球菌的最低山茶油濃度為1%,由表3可知:山茶油對大腸桿菌的抑制效果強于金黃色葡萄球菌。
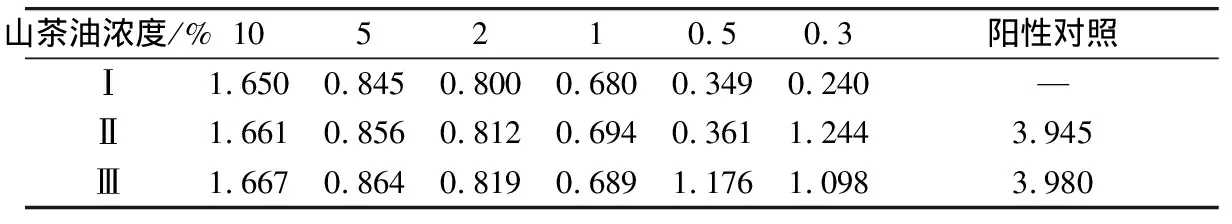
表2 不同濃度OD600值測定
注:Ⅰ代表山茶油混合液吸光值,Ⅱ代表含大腸桿菌的混合液吸光值,Ⅲ代表含金黃色葡萄球菌的混合液吸光值,—代表無此實驗。
注:+代表有菌生長,—代表無菌生長,Ⅰ代表大腸桿菌生長情況,Ⅱ代表金黃色葡萄球菌生長情況。
2.2.2 山茶油對細菌生長曲線的影響
細菌的生長曲線可分為4個階段:延滯期、指數期、穩定期和衰亡期。
由圖1可知,不加山茶油與丙酮的對照組,其生長曲線呈較典型的“S”型;而實驗組的生長曲線則發生明顯變化,由此可知,山茶油在延滯期便對金黃色葡萄球菌和大腸桿菌產生作用,從而抑制細菌的繁殖,使其生長曲線呈現為一條平緩線。
由實驗組變化率可知,金黃色葡萄球菌實驗組變化率更大,抑制效果更弱,從而表明山茶油對G+細菌的抑制效果弱于G-細菌,這可能是因為G+細菌細胞壁厚度大,肽聚糖和磷壁酸的含量多,而G-細菌細胞壁厚度比G+細菌薄,肽聚糖層也很薄,故機械強度較G+細菌弱,山茶油更易對G-細菌起作用,即山茶油對大腸桿菌的抑制效果強于金黃色葡萄球菌。
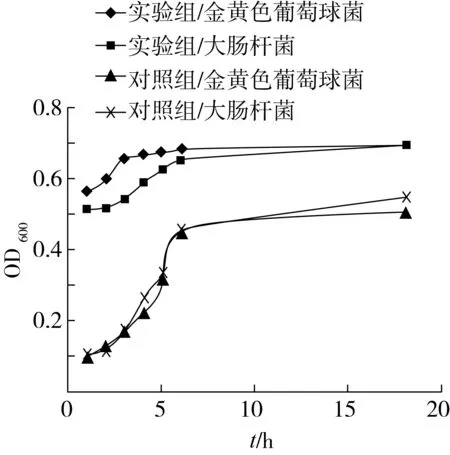
圖1 山茶油對金黃色葡萄球菌與大腸桿菌的生長曲線的影響
2.3 山茶油抑菌機理
2.3.1 山茶油對堿性磷酸酶的影響
在細菌細胞壁與細胞膜的間隙中存在著堿性磷酸酶,它在一般情況下不會外泄,當細菌處于不利條件或受到抑菌劑的作用時,細胞壁通透性便增大,堿性磷酸酶便滲出[10]。通過在510 nm下測定堿性磷酸酶的含量,探究山茶油對大腸桿菌和金黃色葡萄球菌的作用方式。

圖2 金黃色葡萄球菌與大腸桿菌的堿性磷酸酶含量變化
由圖2可知,堿性磷酸酶含量的初始值不為0,這有可能是因為菌懸液中存在裂解死亡的菌體,從而使堿性磷酸酶外泄,導致初始值不為0;未加山茶油與丙酮的對照組,其堿性磷酸酶含量無明顯變化,而加了山茶油與丙酮的實驗組,其堿性磷酸酶含量先增加后趨于平緩。由此可證明,山茶油通過改變細胞壁的通透性,致使存在于細胞壁與細胞膜之間的堿性磷酸酶外泄,堿性磷酸酶含量上升;而隨著時間的延長,堿性磷酸酶含量變化趨于平緩,這可能是因為山茶油與細菌已作用完全,抑菌效果減弱,故后期堿性磷酸酶含量無明顯變化。
實驗組變化率可知,大腸桿菌的堿性磷酸酶含量變化率更大,與本研究得出的山茶油對大腸桿菌的抑制效果強于金黃色葡萄球菌的結論相呼應。
2.3.2 山茶油對電導率值的影響
細胞膜是維持細胞內正常滲透壓的結構屏障,能選擇性地控制細胞內外營養物質和代謝產物的運送,是包圍細胞質的最佳“容器”。當細菌受到不利影響時,細胞膜滲透性有所改變,細胞內小分子物質逸出,導致電導率值增大[14]。通過測定電導率的變化,來判斷山茶油對細菌細胞膜滲透性的影響。
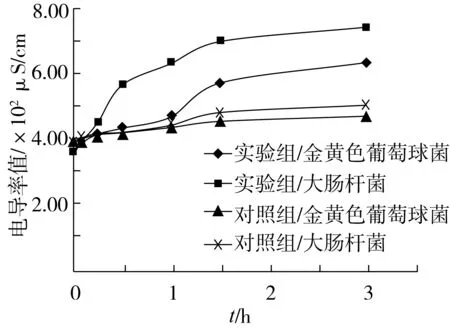
圖3 金黃色葡萄球菌與大腸桿菌的電導率值變化
由圖3可知,未加山茶油與丙酮的對照組,其電導率值增長趨勢較緩,說明對照組的細菌正常生長,細胞膜滲透性良好;而加了山茶油與丙酮的實驗組,其電導率值有明顯的增大,細胞內容物滲出。由此可說明,山茶油可通過影響細胞膜的滲透性,使細胞內小分子物質逸出,影響細菌的正常生理功能,從而起到抑菌作用。
由實驗組電導率的變化值可知,添加了山茶油溶液的大腸桿菌電導率值變化率更大,由此可知,山茶油對大腸桿菌的抑制效果強于金黃色葡萄球菌。
2.3.3 山茶油對還原糖的影響
用葡萄糖標準溶液測定葡萄糖含量-吸光度標準曲線,如圖4,其線性方程為y=0.541 8x-0.032 6。
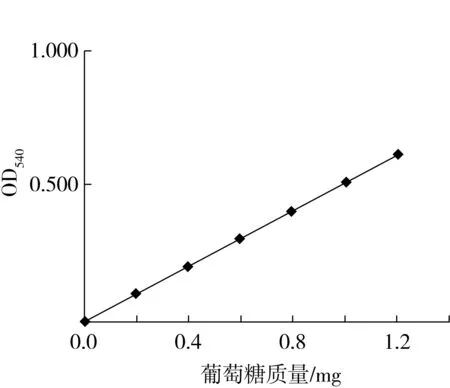
圖4 葡萄糖標準曲線
將已測的大腸桿菌混合液及金黃色葡萄球菌混合液的還原糖吸光值通過線性方程進行計算,由此可得還原糖含量隨時間的變化曲線,如圖5。
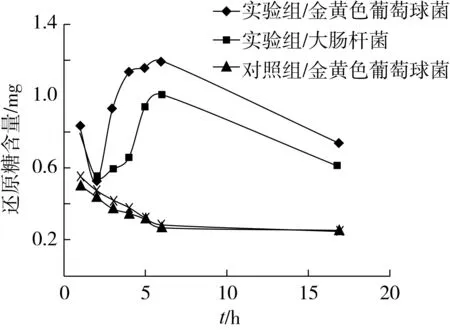
圖5 金黃色葡萄球菌與大腸桿菌的還原糖變化曲線
由圖5可知,對照組還原糖含量隨時間變化趨勢為先減小后趨于平穩,這可能是因為培養基中存在還原糖,細菌生長繁殖需要還原糖,因此還原糖含量先降低;而后期趨于平緩則有可能是因為還原糖已基本耗盡,利用率下降,或者是因為細菌已達到衰亡期,利用還原糖能力下降[15]。
實驗組還原糖的變化趨勢則為先減小后急劇增大最后減小,前期還原糖含量降低有可能是因為山茶油對細菌的作用還未影響細胞膜的完整性,細胞內容物包括糖類未泄出,細菌正常地利用培養基中的還原糖進行生長,因此還原糖含量降低;而后急劇增大則可能是因為山茶油已影響細胞膜的完整性,使細胞內容物泄出,因此還原糖含量增大;最后還原糖含量降低,可能是因為山茶油對細菌的影響已作用完全,存活的細菌繼續利用培養基中的還原糖生長繁殖。
2.3.4 山茶油對蛋白質含量的影響
用牛血清白蛋白測定蛋白質含量與吸光度的標準曲線,如圖6,其線性方程為y=1.61x+2.420 6。
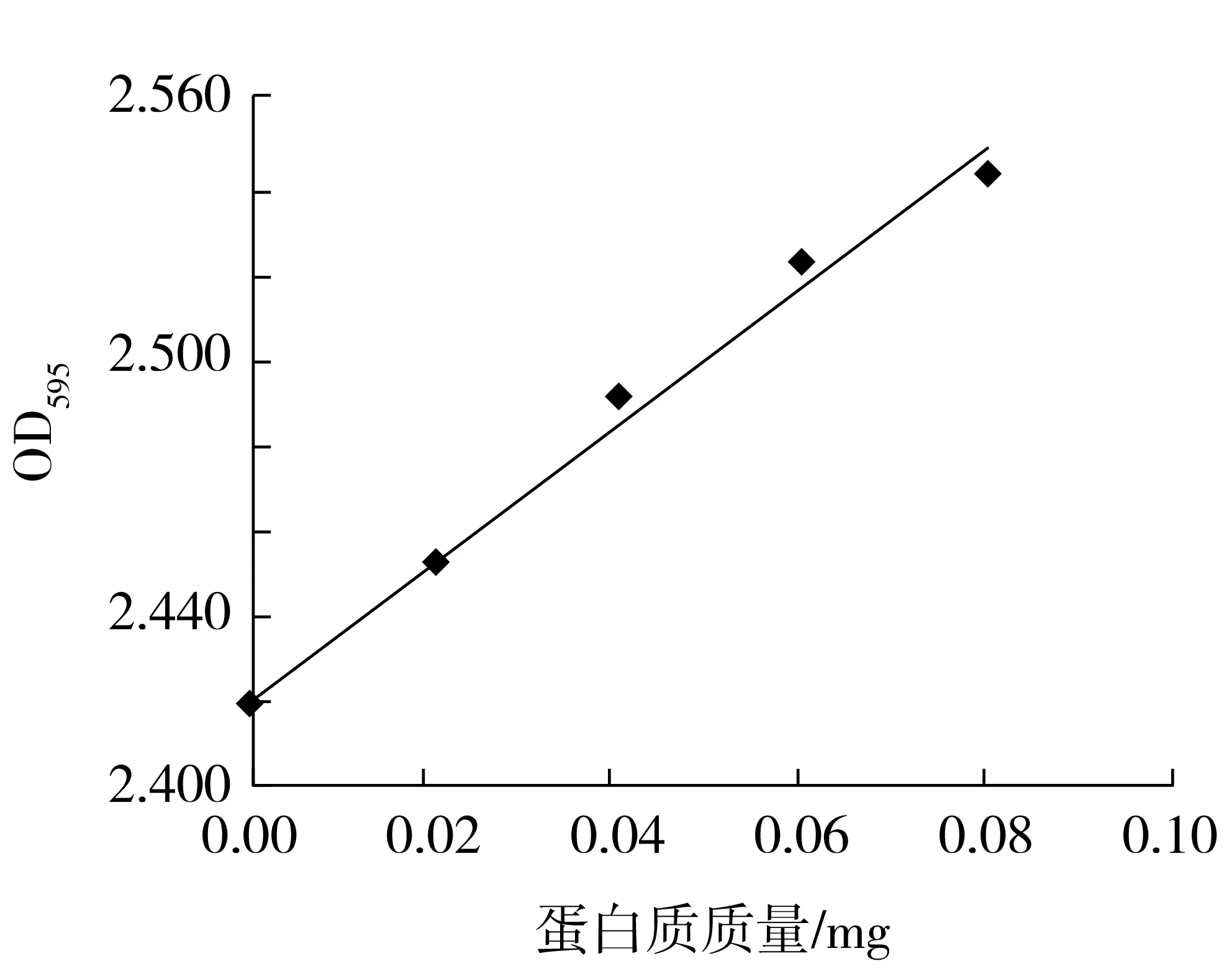
圖6 蛋白質標準曲線
將已測的大腸桿菌混合液及金黃色葡萄球菌混合液的蛋白質吸光值通過線性方程進行計算,由此可得蛋白質含量隨時間的變化曲線,如圖7。
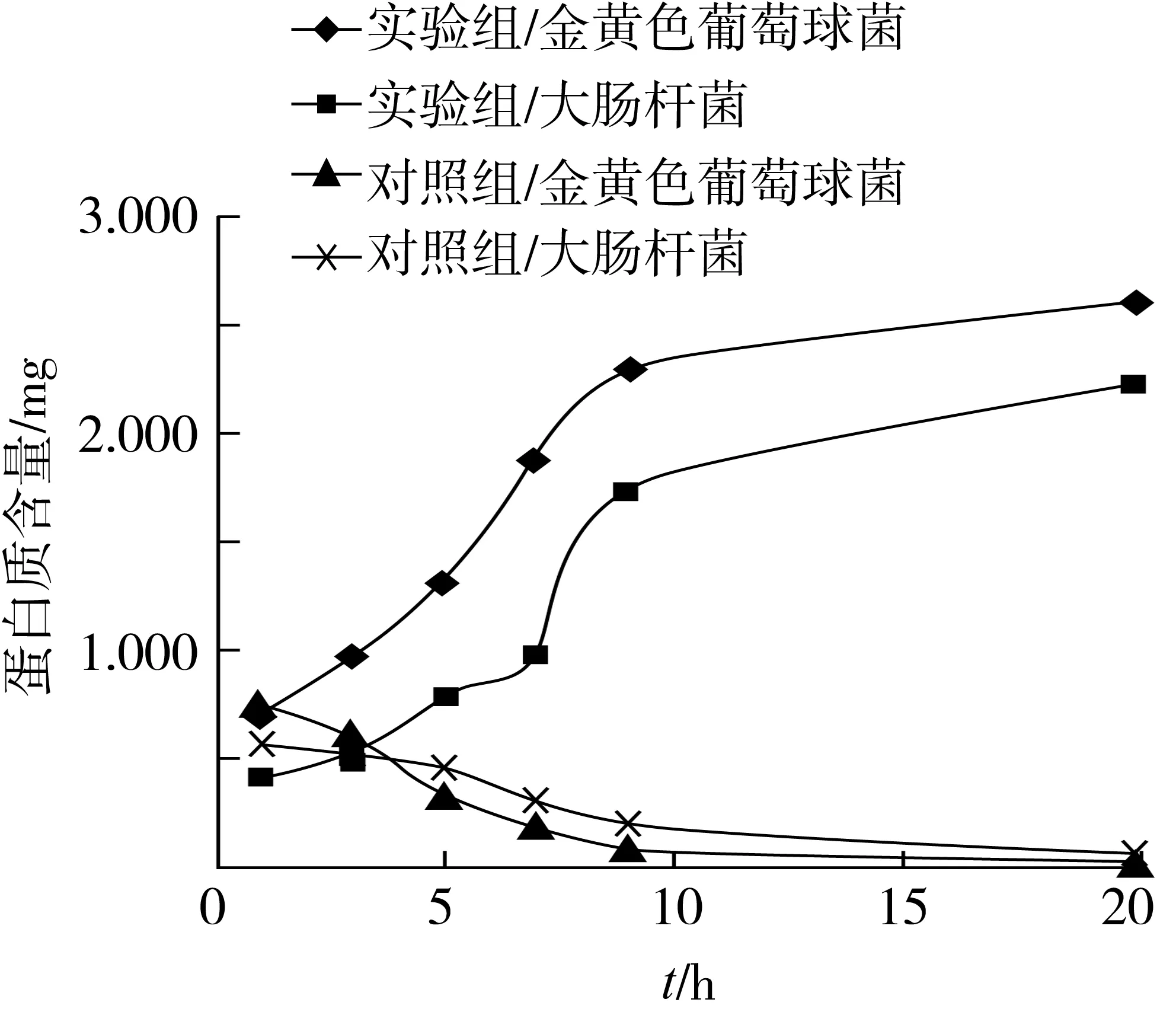
圖7 金黃色葡萄球菌與大腸桿菌的蛋白質變化曲線
由圖7可知,對照組蛋白質含量變化曲線呈先下降平緩的趨勢,這可能是因為細菌生長需要氮源,牛肉膏和蛋白胨為細菌繁殖提供氮源,因此對照組中蛋白質含量先下降,后期呈漸緩的趨勢則可能是因為牛肉膏和蛋白胨含量已幾乎耗盡,或者是因為細菌的生長已達到衰亡期,消耗蛋白質的能力下降[16]。
而實驗組中蛋白質含量呈增長趨勢,這有可能是因為細胞膜的完整性被破壞,使細胞內容物包括蛋白質泄出,由此可知:山茶油通過破壞細胞膜的完整性,來起到抑菌作用。由實驗組變化率可知,大腸桿菌蛋白質含量增長趨勢強于金黃色葡萄球菌,即山茶油對大腸桿菌的抑菌效果強于金黃色葡萄球菌。
3 結論
山茶油具有較好的抑菌效果。山茶油對細菌的作用始于延滯期,其對大腸桿菌與金黃色葡萄球菌的最低抑菌濃度分別為0.5%、1%,對G-的抑制效果強于G+。
由堿性磷酸酶含量、電導率值、還原糖含量以及蛋白質含量變化,可知山茶油的抑菌機理主要是通過影響細胞壁和細胞膜的通透性甚至破壞細胞膜的完整性來達到抑菌作用。

