丙型肝炎病毒感染患者血清及PBMC中miR-122、miR-29b的表達
何雪琴,王靳琎,余飛,魏英,周青珍,向小衛,桑明,陳琴華,2
(1湖北醫藥學院附屬東風醫院,湖北十堰 442000;2武當特色中藥研究湖北省重點實驗室)
丙型肝炎(丙肝)是嚴重威脅人類健康的傳染病之一,易轉變為慢性潛伏感染,且多數患者可能發展為肝硬化甚至肝癌,全世界范圍約有31.1%的肝癌病例由丙型肝炎病毒(HCV)感染所致[1~3]。丙肝起病隱匿,感染初期約80%患者無明顯癥狀,易漏診。目前診斷HCV感染的“金指標”是HCV-RNA定量,但其與丙肝的嚴重程度并非絕對相關,多用于評估抗病毒的療效及判斷預后。微小RNA(miRNA)是一類參與基因轉錄后調控的小分子RNA,參與調控機體的多種生理過程[4,5], 并參與病毒感染和腫瘤的發生發展等病理過程[6]。miR-122為肝臟中特異性表達的miRNA,占肝臟總miRNA的72%,對肝臟生理功能有重要調節作用,在HBV、HCV等嗜肝性病毒感染過程中發揮重要的調控功能[7]。miR-122可作為HCV感染早期診斷和預后判斷的潛在生物學標志物。2018年7月,我們檢測了HCV感染及HBV感染患者血清和外周血單個核細胞(PBMC)中miR-122和miR-29b表達,探討二者與HCV感染的關系,為丙肝的預防、診斷和治療提供新思路。
1 資料與方法
1.1 臨床資料 隨機選取2016年6月~2018年6月湖北省十堰市國藥東風總醫院收治的HCV感染者16例(HCV組),男10例、女6例,年齡(48±6)歲。HBV感染者30例(HBV組),男15例、女15例,年齡(47±4)歲。同時感染HCV和HBV者12例(HCV+HBV組),男8例、女4例,年齡(48±4)歲。三組均經血清HCV-RNA、HBV-RNA定量檢測明確診斷。另納入30例查體健康志愿者作為對照組,男15例、女15例,年齡(45±4)歲。各組年齡、性別方面差異均無統計學意義(P均>0.05)。本研究通過我院倫理委員會批準實施,所有研究對象知情同意,并簽署知情同意書。
1.2 HCV-RNA及HBV-DNA定量檢測 按HCV-RNA定量和HBV-DNA定量檢測試劑說明書設置相關儀器參數并操作,試劑盒均購自中山大學達安基因股份有限公司,HCV試劑盒的檢測下限為1.0×103IU/mL,HBV試劑盒的檢測下限為5.0×102IU/mL。
1.3 RNA提取 采用TRIzol法。所有研究對象采集5 mL EDTA抗凝血用于分離PBMC,同時采集5 mL無添加劑外周血分離血清。每毫升TRIzol加入氯仿200 μL,劇烈振蕩15 s,室溫靜置10 min,離心(12 000 g,15 min,4 ℃);吸取上層水相加等體積異丙醇,顛倒混勻,冰上靜置10 min,離心(12 000 g,10 min,4 ℃);棄上清,加1 mL預冷的75%乙醇(DEPC水現配)洗滌,離心(8 000 g, 5 min,4 ℃);棄上清,加入DEPC 20 μL水溶解RNA,測RNA濃度并計算所需RNA體積,每個樣品取4 μg的RNA做逆轉錄,因此每管中需加入的RNA體積為VRNA(μL)=4/CRNA。
1.4 血清和PBMC中miR-122、miR-29b表達檢測 miRNA的逆轉錄及實時熒光定量PCR: 采用Thermo逆轉錄試劑盒說明書合成cDNA,本次試驗以cel-miRNA-39為內參, 擴增反應體系參照相關試劑盒說明書進行。逆轉錄反應總體系為20 μL。EP管中加入VRNA+V水+1 μL Oligdt (共12 μL),PCR儀70 ℃,反應5 min;取出置于冰上,加入預混液(1 μL RNasin、1 μL rRNasin、4 μL 5×buffer和2 μL dNTP mix)共8 μL,PCR儀42 ℃反應60 min,合成的cDNA用于qRT-PCR。取4 μL逆轉錄cDNA為模板,以miR-122、miR-29b熒光定量PCR引物進行擴增,熒光定量PCR反應條件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,42個循環;72 ℃ 5 min。以2-△△Ct法進行結果比較分析,△△Ct =(Ct目的基因- Ct內參基因)實驗組-(Ct目的基因-Ct內參基因)對照組。
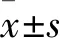
2 結果
2.1 各組血清和PBMC中miR-122表達比較 對照組、HCV組、HBV組、HCV+HBV組血清中miR-122表達分別為(8.2±1.4) ×10-3、(20±4) ×10-3、(9±3) ×10-3、(23±5) ×10-3;PBMC中miR-122表達分別為(1.43±0.29)×10-5、(4.53±0.83)×10-5、(1.67±0.46)×10-5、(4.49±1.14)×10-5。與對照組相比,HCV組、HCV+HBV組血清和PBMC中miR-122表達均升高,其中HCV組血清和PBMC中miR-122表達高于對照組(P均<0.05),HCV+HBV組血清和PBMC中miR-122表達與對照組比較差異無統計學意義(P均>0.05)。
2.2 各組血清和PBMC中miR-29b表達比較 對照組、HCV組、HBV組、HCV+HBV組血清中miR-29b表達分別為(3.35±0.48)×10-5、(2.44±0.517)×10-5、(2.05±0.27)×10-5、(6.87±1.74)×10-5;PBMC中miR-29b表達分別為(4.46±1.17)×10-4、(5.1±3.66)×10-4、(2.59±0.22)×10-4、(0.52±0.5)×10-4。與對照組相比,HCV組、HBV組、HCV+HBV組雖能檢測到血清和PBMC中miR-29b表達水平有所下降,但與對照組比較差異均無統計學意義(P均>0.05)。
3 討論
HCV屬于黃病毒科單股正鏈RNA病毒,HCV感染可引發丙型肝炎,因臨床癥狀隱匿,往往多年不被發現,隨著HCV在體內復制可持續損傷細胞,逐步發展為慢性肝炎、肝硬化、肝癌等嚴重肝病。因此,早期診斷HCV感染性疾病對防控HCV感染及相關疾病的治療和預后尤為重要。
自2005年Jopling等[8,9]首次報道miR-122可輔助HCV復制,miR-122就成為肝臟-HCV相互作用研究的焦點[10,11]。miR-122是肝臟特異性表達的微小RNA,參與肝臟的功能代謝,其可通過與HCV病毒的5′UTR兩個結合位點的相互作用促進病毒復制[12,13];miR-122還可通過在翻譯起始階段增強核糖體與病毒RNA的親和力促進HCV復制。此外miR-122還可調節肝細胞核因子6、AMP依賴蛋白激酶、過氧化物酶體增殖物活化受體等多種因子,影響肝臟的發育、分化和體內平衡及代謝功能[14]。有研究[15]表明,miR-122是HCV復制必須的宿主因子,HCV的穩定和增殖與肝臟表達的miR-122同HCV基因組功能性相互作用密切相關。本研究結果顯示,HCV感染后患者血清及PBMC中miR-122的表達均升高,其中HCV組中miR-122高于對照組,差異有統計學意義,此與Varnoholt等[16]結果一致。同時我們觀察到HCV和HBV雙重感染的患者血清及PBMC中miR-122表達高于HBV單一感染患者,提示HBV單一感染和HCV合并感染患者中miR-122的復雜相互作用需進一步研究和探索。
miR-122是第一個被證明與HCV復制相關的miRNA,且在肝臟中特異表達,miR-122占肝細胞表達miRNA的72%,參與調控肝細胞中多種代謝通路。抑制miR-122表達可能影響肝細胞代謝,因此其他在HCV與宿主相互作用中起作用的miRNA,亦可能成為抗HCV研究的靶標。目前研究報道了多種可影響HCV感染的miRNA[17],或由于HCV感染而發生改變的miRNA,如miR-29b、miR-196b等可抑制HCV復制[18~21],這些miRNA可作為抗HCV治療的新靶標,本研究中,單一感染HCV患者的血清及PBMC中miR-29b表達略降低,但與對照組比較差異無統計學意義,其原因可能是miR-29b在肝細胞中表達量較低,提示miR-29b在HCV相關性肝病中的作用有待進一步研究。
此外,我們的研究存在一些局限性。首先,收集大宗病例較困難,這可能導致統計結果不足以完全解決上述問題。其次,沒有進行血液標本采集,且并非所有的患者都有可用于病毒學檢測的血液樣本。因此,本研究無法控制某些因素可能影響miR-122表達或治療結果。
綜上所述,在感染HCV的患者中,血清和PBMC中miR-122表達升高,并且在單一感染HCV的患者中最高,miR-122有望成為HCV相關性肝病新的抗病毒藥物靶點或新的診斷生物標志物。

