妊娠期糖尿病患者并發子癇前期血清LCN-2、AOPP水平變化及意義
郭麗,張陳彥,郭影
(1天津市北辰中醫醫院,天津 300400;2石家莊市第一醫院;3河北醫科大學第三醫院)
妊娠期糖尿病(GDM)是妊娠期出現的糖尿病,是一種常見的妊娠合并癥。世界各國GDM的發生率在1%~14%,我國發生率為1%~5%,近年呈增高趨勢[1]。子癇前期(PE)是妊娠期特發性高血壓疾病,嚴重影響母嬰健康,是孕產婦和圍產兒病死率升高的主要原因[2]。據報道,GDM孕婦并發PE(GDM-PE)患病率可達6.0%~15%[3]。GDM-PE發病復雜,能導致體內多系統重要內臟器官功能損害,對母嬰造成嚴重危害,且發病時間越早,對母嬰結局的影響越大[4,5]。目前GDM-PE的發生機制尚未明確。人脂質運載蛋白2(LCN-2)是一種脂肪細胞因子,與胰島素抵抗、肥胖及其并發癥的發生密切相關,并在血管損傷及修復過程中發揮重要作用[6]。晚期氧化蛋白產物(AOPP)是一種新型的蛋白類氧化應激標志物,能損傷血管內皮細胞功能,在加重妊娠期高血壓進程中有重要作用[7,8]。2016年3月~2018年6月,我們檢測了GDM-PE患者血清中LCN-2和AOPP水平,并分析二者與血脂代謝及胰島素抵抗的相關性。現報告如下。
1 資料與方法
1.1 臨床資料 選擇2016年3月~2018年6月天津市北辰中醫醫院就診的單純GDM患者85例,年齡(29.12±4.05)歲,孕周(37.3±2.31)周,孕前BMI為(22.54±2.36)kg/m2,初產婦39例,經產婦46例。GDM-PE患者82例,年齡(30.14±5.39)歲,孕周(36.5±2.22)周,孕前BMI為(22.78±2.68)kg/m2,PE病情程度為輕度54例、重度28例,初產婦42例,經產婦40例。納入標準:①符合美國糖尿病協會(ADA)制定的75 g口服葡萄糖耐量試驗標準[9];②PE(輕度及重度)診斷標準依照我國目前現行的妊娠期高血壓疾病的診斷標準[10]。排除標準:①伴有慢性高血壓、急慢性肝炎、感染性疾病、紅斑狼瘡、腎臟疾病、內分泌疾病等病史;②合并免疫系統疾病;③伴精神疾病;④近期服用過影響血脂代謝的藥物者。另選取同期就診的健康孕婦50例為對照組,年齡(28.56±3.28)歲,孕周(37.2±2.45)周,孕前BMI為(21.78±2.12)kg/m2,初產婦27例,經產婦23例。三組年齡、孕周、孕前BMI、初產婦構成比差異無統計學意義(P均>0.05)。本研究通過我院倫理學委員會審核批準,取得研究者及其家屬同意且簽署知情同意書。
1.2 血清LCN-2、AOPP、甘油三酯(TG)、游離脂肪酸(FFAs)、尿酸(UA)和24 h尿蛋白檢測 納入研究的受試對象均于治療前清晨空腹狀態下抽取外周靜脈血液樣本4 mL,置于抗凝管中,3 000 r/min離心8 min,離心半徑15 cm,取上清置于4 ℃待測,若未及時檢測,置于-80 ℃凍存。采用全自動生化分析儀檢測受試者血清TG、FFAs、UA、24 h尿蛋白;采用ELISA法測定人血清中LCN-2和AOPP水平,試劑盒購于瑞士R&D Systems公司,嚴格按照試劑盒說明書進行。用穩態模擬法計算胰島素抵抗指數(HOMA-IR),HOMA-IR=(空腹胰島素×空腹血糖/22.5)。
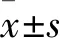
2 結果
2.1 各組血清LCN-2、AOPP、TG、FFAs、UA、HOMA-IR和24 h尿蛋白水平比較 GDM-PE組、GDM組血清LCN-2、AOPP、FFAs水平高于對照組(P均<0.05),且GDM-PE組高于GDM組(P<0.05);GDM-PE組血清TG、UA、24 h尿蛋白和HOMA-IR水平高于GDM組、對照組(P均<0.05),但GDM組、對照組血清TG、UA和HOMA-IR水平比較差異無統計學意義(P均>0.05),見表1。
2.2 GDM合并不同程度PE患者血清LCN-2、AOPP、TG、FFAs、UA、HOMA-IR和24 h尿蛋白水平比較 GDM合并重度PE患者血清LCN-2、AOPP、TG、FFAs、UA、HOMA-IR、24h尿蛋白水平均高于GDM合并輕度PE者(P均<0.05),其他指標比較差異無統計學意義。見表2。

表1 三組血清LCN-2、AOPP、TG、FFAs、UA、24 h尿蛋白和HOMA-IR水平比較
注:與對照組比較,*P<0.05;與GDM組比較,#P<0.05。

表2 GDM合并不同程度PE者血清LCN-2、AOPP、TG、FFAs、UA、24 h尿蛋白和HOMA-IR水平比較
2.3 GDM-PE患者血清LCN-2、AOPP與TG、FFAs、UA、24 h尿蛋白的相關性分析 Pearson相關性分析結果顯示,血清LCN-2與TG、FFAs、UA、HOMA-IR、24 h尿蛋白呈正相關(r分別為0.597、0.682、0.635、0.697、0.588,P均<0.05),血清AOPP與TG、FFAs、UA、HOMA-IR、24 h尿蛋白呈正相關(r分別為0.368、0.587、0.712、0.728、0.451,P均<0.05),且血清LCN-2與AOPP水平呈正相關(r=0.651,P<0.05)。
3 討論
GDM是妊娠期間特有的代謝性疾病,血糖升高引發微血管病變,細小血管內皮細胞增厚,管腔變窄,外周血管阻力升高,使得GDM并發妊娠期高血壓疾病的可能性較非糖尿病孕婦高2~4倍[11]。GDM-PE的患病率逐年升高,可能與患者存在嚴重的胰島素抵抗及內皮損傷有關。研究表明,與單純的GDM相比,GDM-PE更易導致巨大兒、早產、新生兒窒息、新生兒畸形的發生,嚴重時可致母體多器官功能的衰竭甚至死亡,嚴重危害母嬰的預后[12]。隨著分子生物學的發展,LCN-2被認為是與肥胖密切相關的新型炎癥因子,可能參與糖耐量減低、血脂異常、動脈粥樣硬化等多種通路;而AOPP作為一種新型的氧化應激標志物,在誘發炎性細胞因子形成和釋放、引起血管內皮損傷方面發揮重要作用。
LCN-2的相對分子質量約為25 kD,位于9q34染色體上,是一種主要由脂肪細胞分泌的新型細胞脂肪因子。LCN-2可與基質金屬蛋白酶9結合,形成共聚化合物,促進組織中膠原蛋白的降解,參與血管損傷和修復過程,同時可激活脂肪細胞中的過氧化物酶增殖物激活受體γ發揮脂肪細胞的活性作用。本研究發現,GDM-PE組血清LCN-2、FFAs水平高于GDM組及對照組,GDM-PE組TG、HOMA-IR水平高于GDM組、對照組,差異均有統計學意義,可見LCN-2蛋白可能在GDM-PE發生中有重要作用。相關報道[13]表明,LCN-2參與胰島素抵抗、慢性炎癥反應、糖脂代謝及血管內皮細胞的損傷過程。本研究中GDM-PE重度者血清LCN-2、FFAs、TG、HOMA-IR水平均高于GDM-PE輕度者,差異有統計學意義,且LCN-2水平與AOPP和脂代謝相關指標及HOMA-IR水平呈正相關。胰島素抵抗引起的血清高胰島素狀態能導致一氧化氮的合成下降及脂質紊亂,影響前列腺素E2的合成,增加外周血管阻力,從而使血壓增高。由此可見,GDM-PE患者體內存在血脂代謝紊亂與胰島素抵抗,且隨著疾病的加重而增加,LCN-2水平能反映患者GDM-PE病情嚴重程度。
近年研究表明,妊娠期糖尿病的發生發展與氧化應激密切相關[14],氧化損傷是機體氧化機制和損傷防御機制動態平衡被打破,產生大量過氧化物,破壞細胞和組織而導致血管內皮損傷。AOPP作為氧化應激的最終反應產物,能誘導上皮細胞活性氧(ROS)的產生,促使脂質氧化,導致內皮細胞的損傷。本研究中GDM-PE組、GDM組AOPP水平高于對照組,且GDM-PE重度者AOPP水平高于GDM-輕度者,差異均有統計學意義。AOPP作為氧化應激的分子標志物,在血管內皮組織損傷PE的炎癥反應過程充當介質發揮作用,可通過激活內皮細胞上的NADPH,引起下游細胞外調節蛋白激酶、NF-κB相關通路蛋白的過表達,從而誘導內皮細胞損傷[15]。Pearson積矩相關性分析結果顯示,血清AOPP水平與TG、FFAs、UA、HOMA-IR和24 h尿蛋白水平均呈正相關。表明AOPP蛋白可能參與了GDM-PE的發生,且AOPP水平能反映患者GDM-PE的嚴重程度,可作為評估患者病情的參考指標。
血清UA和24 h尿蛋白與腎功能密切相關[16]。本研究結果顯示,GDM-PE患者的血清UA和24 h尿蛋白水平明顯升高,且隨著病情的加重而升高,表明GDM-PE患者可能存在腎異常狀況。相關性分析結果顯示,LCN-2與AOPP均與血UA和24 h尿蛋白呈正相關,表明LCN-2與AOPP可作為預測和檢測患者腎功能受損狀況的指標。本研究中血清LCN-2和AOPP水平呈正相關,原因可能是GDM-PE患者脂肪細胞分泌大量LCN,脂代謝紊亂,加劇了患者胰島素抵抗、慢性炎癥反應等病變過程,增強機體氧化應激狀態,最終導致氧化應激終產物AOPP因子的持續升高,進一步加劇疾病發展[17,18]。
綜上所述,GDM-PE患者血清LCN-2與AOPP水平均升高,GDM-PE患者血清LCN-2和AOPP水平與患者血脂代謝紊亂、胰島素抵抗密切相關;檢測血清LCN-2和AOPP水平對于早期預測GDM-PE和腎功能損害及病情判斷有一定意義。

