2型糖尿病患者頸動脈內膜中層厚度與基因啟動子-156位點G/C多態性的關系
李明政,鄧建新,陳淑娟
(深圳市第二人民醫院,廣東深圳 518000)
2型糖尿病(T2DM)是臨床最為常見的基礎疾病之一,由遺傳、環境等因素共同作用所致,以糖代謝紊亂為主要臨床特征[1,2]。近年來,隨著人們生活水平的逐漸提高,加之飲食習慣的不斷改變,T2DM的發病人數日益增多[3,4]。研究顯示,動脈粥樣硬化是導致T2DM患者死亡的重要原因,而頸動脈內膜中層厚度(CIMT)是目前臨床廣泛用以評估機體動脈粥樣硬化情況的有效指標,且與糖尿病早期大血管病變的發生有一定相關性[5]。另有研究報道證實,在T2DM患者中趨化因子配體5濃度與CIMT呈正相關,趨化因子配體5在急性冠脈綜合征的發生中起重要作用[6]。由于基因啟動子-156位點是趨化因子配體5的重要位點,具有一定的G/C多態性,因此推測趨化因子配體5基因啟動子-156位點G/C多態性可能與T2DM患者CIMT密切相關。2018年4月,我們探討了T2DM患者CIMT與基因啟動子-156位點G/C多態性的關系,旨在為臨床T2DM的治療提供新的靶點和思路。
1 資料與方法
1.1 臨床資料 選取2016年4月~2018年4月我院收治的T2DM患者180例,納入標準[7]:①患者均符合T2DM相關診斷標準;②年齡≥18周歲;③無臨床資料缺失。排除標準:①合并肝、腎、肺等臟器功能嚴重受損者;②伴有嚴重心腦血管疾病、急慢性感染性疾病、免疫系統疾病及嚴重糖尿病急性代謝并發癥者;③無法正常交流或存在神經系統疾病者;④正參與其他研究者。入選的180例T2DM患者男95例、女85例,年齡33~82(51.03±11.54)歲;BMI 19~30(25.74±3.51)kg/m2。本研究經醫院倫理委員會批準,患者均知情同意。
1.2 CIMT測量 采用頸動脈超聲進行測定,檢測儀器為ACUSON X300型彩色多普勒超聲診斷儀(德國西門子公司),設置探頭頻率為7.5~12 MHz。按照CIMT的不同分成單純T2DM組(CIMT≤0.9 mm)及CIMT增厚組(CIMT為0.9~1.3 mm)。
1.3 血液生化指標檢測 采用全自動生化分析儀檢測空腹血糖(FPG)、甘油三酯(TG)、總膽固醇(TC)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)水平;采用放射免疫法檢測空腹胰島素(FINS)水平,并計算胰島素抵抗指數(HOMA-IR)值,HOMA-IR=FPG×FINS/22.5。
1.4 基因啟動子-156位點G/C多態性檢測 采用多聚酶鏈式反應限制性片段長度多態性技術。首先采集患者空腹外周靜脈血2 mL,通過非離心柱型DP319-01試劑盒,提取白細胞基因組DNA。隨后參照基因庫以及文獻資料設計PCR擴增目的片段:正向引物:5′-CTCCTCCTGGCCACCCTGC-3′,反向引物:5′-TCAAGCTTTGGGATGCTGGGGAA-3′。PCR反應體系包括15 μL的PCR緩沖液;10 mmol/L dNTPS 4.0 μL;正反向引物各4.0 μL;DNA產物4.0 μL;Tap酶0.5 μL,加水至50 μL。反應條件:95 ℃預變性10 min,95 ℃ 30 s、61 ℃ 30 s、72 ℃ 30 s,共40個循環。擴增片段長度114 bp,分離純化擴增產物,測序并和GeneBank中的基因型對比,并通過NRU1限制性內切酶予以酶切處理。隨后將酶切產物通過15%聚丙烯酰胺電泳,以溴乙錠染色30 min,于紫外燈下觀察基因型。
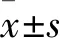
2 結果
2.1 兩組臨床及實驗室相關指標比較 單純T2DM組78例,男40例、女38例,年齡(48.32±10.66)歲,BMI(25.62±3.47)kg/m2;CIMT增厚組102例,男55例、女47例,年齡(55.76±12.33)歲,BMI(25.83±3.35)kg/m2,兩組性別、BMI比較差異無統計學意義。單純T2DM組年齡、FINS、HOMA-IR、TC、LDL-C水平較CIMT增厚組低(P均<0.05),見表1。

表1 兩組實驗室相關指標比較
2.2 兩組基因啟動子-156位點G/C多態性比較 CIMT增厚組基因啟動子-156位點GG基因型比例較單純T2DM組低,而CC基因型比例較單純T2DM組高(P均<0.05),見表2。
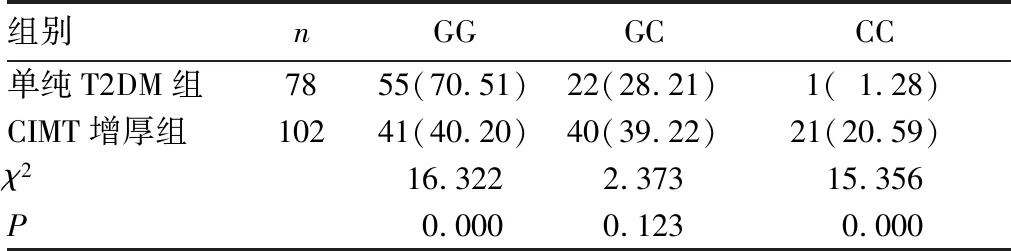
表2 兩組基因啟動子-156位點G/C多態性比較[例(%)]
2.3 T2DM患者CIMT與各因素的相關性分析 PT2DM患者CIMT與基因啟動子-156位點CC基因型、年齡、FINS、HOMA-IR、LDL-C均呈正相關(r分別為0.632、0.683、0.602、0.711、0.589,P均<0.05)。
2.4 影響T2DM患者CIMT增厚的多因素Logistic回歸分析 多因素Logistic回歸分析結果顯示,基因啟動子-156位點CC基因型、年齡、In(HOMA-IR)、LDL-C均為T2DM患者CIMT增厚的獨立危險因素(P均<0.05)。見表3。
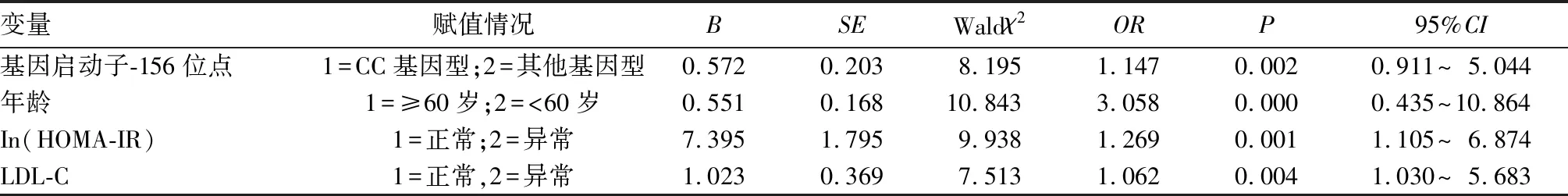
表3 影響T2DM患者CIMT增厚的多因素Logistic回歸分析
3 討論
流行病學研究表明,T2DM可在一定程度上增加心血管疾病患者的發病率及病死率,其中有50%以上的T2DM患者死于動脈硬化性疾病[8~10]。內膜增厚是動脈粥樣硬化早期病理改變,且有研究證實CIMT與心血管疾病的危險因素呈正相關[11,12]。頸動脈作為全身中型動脈窗口之一,其硬化程度和冠心病及外周動脈硬化性疾病存在密切關系,且CIMT增加可作為預測心血管病發病及病死率的獨立危險因素。因此,通過測量CIMT可作為早期動脈粥樣硬化的有效指標。另有研究報道表明,炎癥在冠狀動脈疾病的發生發展中起重要作用,特別是對于趨化因子于動脈硬化形成及斑塊破裂過程中所發揮的作用越來越受重視[13,14]。炎癥細胞可能通過直接或間接作用導致血管內皮損傷,同時促使一氧化氮功能降低,甚至失活,并迅速分解釋放出大量的自由基引發血管痙攣及脂質代謝紊亂,從而促進動脈粥樣硬化的發生發展。炎癥可能是啟動冠狀動脈粥樣硬化過程的啟動子。其中趨化因子配體5可于損傷部位募集中性粒細胞,從而加劇局部炎癥損傷,進一步促進CIMT增厚,最終在冠狀動脈疾病的進程中發揮重要作用[15,16]。
趨化因子配體5基因位于染色體4q13-q21,其中存在兩個單核苷酸多態性位點:啟動子區域的-156G>C,外顯子398G>A,而啟動子區域的-156G/C基因多態性直接影響趨化因子配體5基因的表達。趨化因子配體5作為趨化因子超家族的CXC亞族成員之一,參與了炎癥、變態反應、自身免疫性疾病及腫瘤的發生發展,有極強的粒細胞趨化作用。本研究結果顯示,CIMT增厚組基因啟動子-156位點GG基因型人數占比較單純T2DM組低,而CC基因型人數占比較單純T2DM組高,與劉波等[17,18]報道結果類似,說明基因啟動子-156位點G/C多態性可能與T2DM患者的CIMT密切相關。推測基因啟動子-156位點G/C多態性可能通過影響趨化因子配體5的表達,進一步對CIMT產生影響,最終導致冠狀動脈疾病的發生。此外,單純T2DM組年齡、FINS、HOMA-IR、TC、LDL-C水平較CIMT增厚組低,而HDL-C水平較CIMT增厚組高,與既往研究高度一致[19],說明上述各項因素均可能影響T2DM患者的CIMT水平。年齡是目前臨床所公認的動脈硬化危險因素之一,而FINS、HOMA-IR水平的增高易致高胰島素血癥的發生,進一步對動脈平滑肌增生產生刺激作用、降低纖溶酶活性,同時可啟動機體免疫系統,促進機體持續、輕微的慢性炎癥發生,繼而可能引發動脈硬化。TC、LDL-C水平是目前臨床應用最為廣泛反映機體血脂代謝情況的有效指標,而血脂代謝紊亂會對機體的血管內皮功能產生影響,促進動脈硬化的發生[20]。另外,經Pearson相關性分析發現,T2DM患者CIMT與基因啟動子-156位點CC基因型、年齡、FINS、HOMA-IR、LDL-C均呈正相關。表明基因啟動子-156位點G/C多態性與T2DM患者CIMT密切相關。原因可能是基因啟動子-156位點G/C多態性會對趨化因子配體5的濃度產生影響,進一步影響JAK/STAT/SOC信號通路抑制胰島素在肌肉中的作用,進一步對胰島素抵抗造成影響,引起胰島素抵抗。而胰島素抵抗是T2DM及動脈粥樣硬化的共同發病基礎,高胰島素血癥會刺激動脈平滑肌增生,同時降低纖溶酶活性,激活機體免疫系統,促使機體出現持續且輕微的慢性炎癥,最終引發動脈粥樣硬化[21~23]。進一步多因素Logistic回歸分析發現,基因啟動子-156位點CC基因型、年齡、HOMA-IR、LDL-C均是影響T2DM患者CIMT增厚的獨立危險因素。再次證實上述因素可能會影響T2DM患者CIMT增厚。其中趨化因子配體5基因-156位點多態性可能通過增加胰島素抵抗、加劇脂代謝紊亂及炎癥反應,從而促進動脈粥樣硬化。
綜上所述,T2DM患者CIMT與基因啟動子-156位點G/C多態性有關,基因啟動子-156位點G/C多態性可能在T2DM患者CIMT增厚過程中發揮促進作用。

