治療前血清MIC-1水平檢測在非小細胞肺癌診斷及靶向治療效果預測中的價值
孔蕾,王俊杰,王濟東,于甬華,張穎東,張永,崔迪
(1北京大學國際醫院,北京 102200;2山東省腫瘤醫院)
在全球范圍內肺癌是發病率和病死率較高的惡性腫瘤,我國2015年肺癌特異死亡率為39.81/10萬,患者預后差[1]。近年來全球肺癌發病率和病死率呈增高趨勢,肺癌中最常見的病理類型為非小細胞肺癌(NSCLC),隨著酪氨酸激酶抑制劑等新的分子靶向治療藥物用于NSCLC治療,患者的生存期得以延長[2],但對于已出現淋巴結轉移者,5年生存率明顯降低[3],因此對高危人群進行有效篩查和早期診斷是提高療效的關鍵。巨噬細胞抑制性細胞因子1(MIC-1)亦稱為PTGF-β,是TGF-β家族成員,是野生型p53的直接靶標[4]。MIC-1作為一種分泌蛋白,能通過自分泌和旁分泌的信號傳導方式,參與細胞增殖、凋亡等過程,并且在細胞遷移和血管生成中發揮作用。除了胎盤和一些神經組織外,正常生理條件下通常檢測不到,而在惡性腫瘤、心肌梗死和應激狀態下其表達高度上調[5]。血清MIC-1水平與腫瘤進展密切相關,血清水平升高與腫瘤的分期、分級等相關,如結直腸癌[6]、肺癌[7]等。MIC-1有望成為腫瘤進展和轉移的生物標志物。MIC-1具有抑制腫瘤的作用[8],如促進細胞凋亡、細胞周期停滯和抑制腫瘤細胞轉移等,但亦有報道,MIC-1在腫瘤晚期有促進腫瘤發生發展的作用[9]。2015年3月~2017年3月,我們對104例NSCLC患者血清MIC-1水平進行了檢測,探討治療前血清MIC-1水平在NSCLC診斷及靶向治療效果預測中的價值。現報告如下。
1 資料與方法
1.1 臨床資料 選取2015年3月~2017年3月我院收治的104例NSCLC患者(NSCLC組),納入標準:①患者經細胞學或組織病理檢查證實為NSCLC;②既往未接受過放、化療及靶向治療等治療;③患者及家屬均知情同意并簽署知情同意書;④CT、MRI等影像學檢查資料完整,能確定臨床分期。排除標準:①合并其他惡性腫瘤;②合并其他嚴重的心肺肝腎等器官疾病;③臨床資料或隨訪資料不完整。NSCLC組中男62例、女42例,年齡38~78(58.6±6.30)歲。腫瘤直徑≤3 cm者68例,>3 cm者36例;NSCLC病理類型:肺腺癌78例,鱗狀細胞癌12例,大細胞癌14例;腫瘤分期:Ⅲb期43例,Ⅳ期61例;腫瘤分化程度:高中分化74例,低分化31例。EGFR基因突變檢測結果:外顯子19缺失突變33例,外顯子21 L858R突變31例,外顯子18G719S/A/C突變8例,外顯子20 T790M突變4例,罕見突變6例,EGFR野生型22例。NSCLC組靶向治療的選擇結合EGFR基因突變檢測結果及患者意愿,58例口服厄洛替尼治療150 mg/(次·d),46例口服吉非替尼治療150 mg/(次·d),用藥持續到腫瘤進展或出現嚴重不良反應無法耐受。選取同期我院診治且經病理檢查確診的45例肺部良性疾病患者(良性組),其中男29例、女16例,年齡34~80(60.1±5.82)歲;肺大泡17例,炎性假瘤13例,肺結核球15例。選取同期于我院體檢健康者40例作為對照組,男28例、女12例,年齡33~79(59.2±7.05)歲。三組性別、年齡差異無統計學意義(P均>0.05)。
1.2 血清MIC-1檢測 抽取良性組治療前、對照組健康體檢時及NSCLC組治療前、治療后1、3、6個月清晨空腹靜脈血4 mL,靜置30 min,4 000 r/min離心15 min,-80 ℃冰箱保存待測。應用雙抗體夾心法檢測血清中MIC-1水平,試劑盒購自北京金紫晶生物技術有限公司,操作步驟嚴格按照試劑盒說明書進行。
1.3 療效評價 NSCLC組治療后1、3及6個月采用RECIST標準對患者進行療效評價[10],病灶消失至少持續4周為完全緩解(CR);腫瘤最大徑縮小30%以上且至少持續4周為部分緩解(PR);出現新病灶或腫瘤最大徑增大20%以上為疾病進展(PD);其他情況為病情穩定(SD)。CR+PR為治療有效,SD+PD為治療無效。
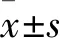
2 結果
2.1 三組治療前后血清MIC-1水平比較 治療前NSCLC組、良性組和對照組血清MIC-1水平分別為(1 205.85±106.71)、(613.21±86.40)、(380.33±56.63)pg/mL,三組間比較差異有統計學意義(F=16.573,P=0.000)。NSCLC組血清MIC-1水平高于良性組(t=5.573,P=0.000),良性組高于對照組(t=4.654,P=0.000)。NSCLC組治療后1、3、6個月血清MIC-1水平分別為(1 015.84±106.71)、(995.62±92.33)、(950.85±88.79)pg/mL,與治療前相比,NSCLC組治療后1、3及6個月血清MIC-1水平均降低(t分別為2.357、2.780、3.127,P分別為0.020、0.006、0.002)。
2.2 血清MIC-1水平與NSCLC患者臨床病理特征的關系 血清MIC-1水平與NSCLC患者病理分期有關(P<0.05),而與性別、年齡、腫瘤直徑、病理類型、分化程度及治療方案無關(P均>0.05)。見表1。
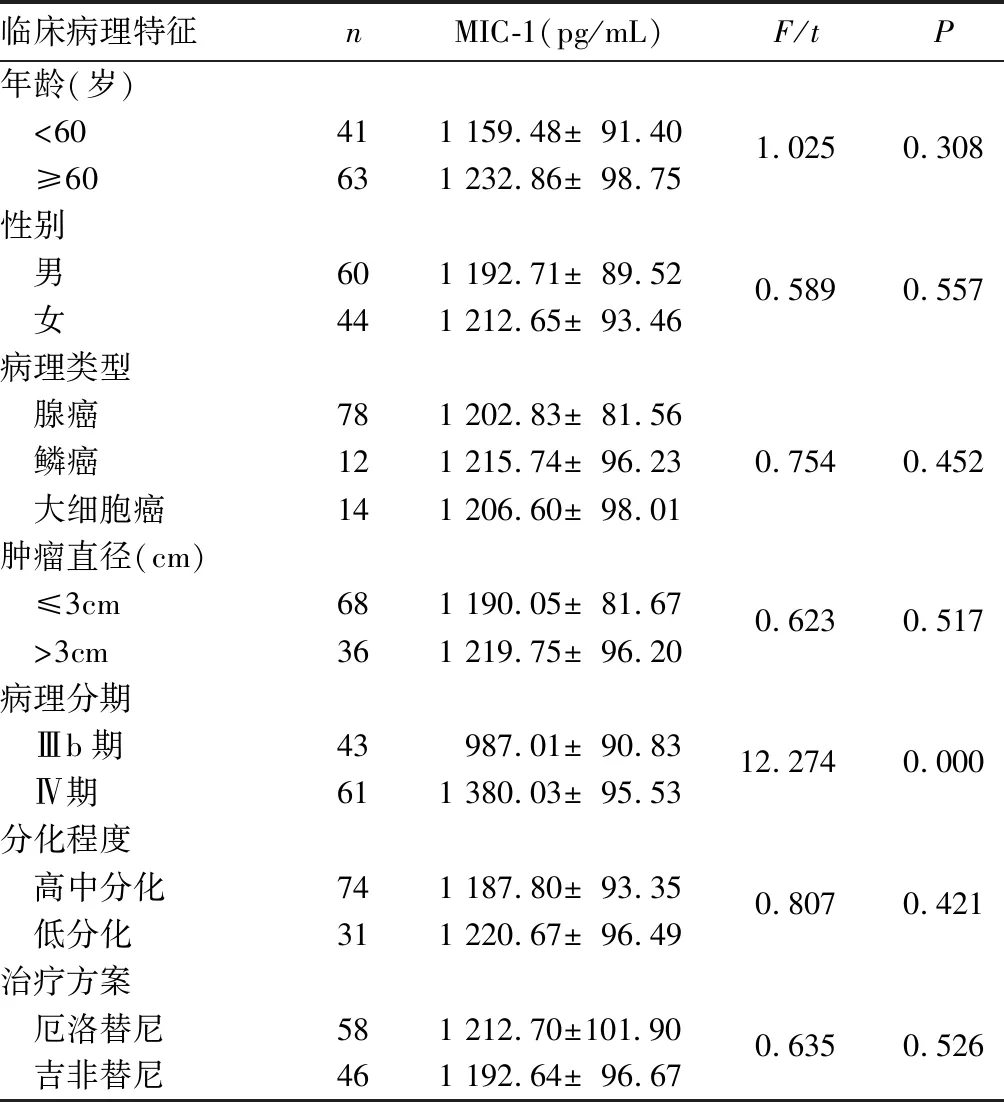
表1 血清MIC-1水平與NSCLC患者臨床病理特征的關系
2.3 血清MIC-1水平在NSCLC中的診斷價值 以對照組為對照,對NSCLC組做ROC曲線圖,見圖1,計算MIC-1的曲線下面積(AUC)為0.92(95%CI:0.87~0.96)。cut off值選擇曲線上近左上方Youden指數最大的切點。MIC-1的臨界參考值1 000 pg/mL,小于該值為陰性,大于等于該值為陽性,診斷的靈敏度和特異度分別為71.2%、93.6%。

圖1 血清MIC-1診斷NSCLC的ROC曲線
2.4 血清MIC-1水平與靶向治療療效的關系 NSCLC組靶向治療后6個月,CR 7例,PR 29例,SD 25例,PD 43例,治療有效(CR+PR)36例,治療無效(SD+PD)68例,總治療有效率34.62%。治療有效者治療前血清MIC-1水平為(915.84±86.71)pg/mL,治療無效者治療前血清MIC-1水平為(1 275.75±102.69)pg/mL,二者血清MIC-1水平比較差異有統計學意義(t=3.697,P=0.000)。
3 討 論
肺癌發病率與病死率較高,出現癥狀時多已進展為中晚期,手術難度大,同時由于腫瘤組織難以獲取,對組織學標本進行基因檢測較為困難。肺癌相關的血清學腫瘤標志物如癌胚抗原(CEA)、神經元特異性烯醇化酶(NSE)等對肺癌診斷、治療和預后評估有重要作用。但其診斷的靈敏度和特異度不高。β型轉化生長因子(TGF-β)超家族有40多個成員,該家族成員參與許多細胞功能和生物過程的調節,包括細胞增殖與凋亡、細胞外基質分泌和黏附、終末分化和發育。蛋白質MIC-1作為TGF-β家族成員,其可誘導軟骨和骨形成,并可通過抑制巨噬細胞活化來抑制炎癥[11]。近年來研究[12]表明,MIC-1在腫瘤發生發展過程中發揮重要調節作用。本研究結果顯示,NSCLC組治療前血清MIC-1水平高于良性組和對照組,與以往研究結果一致[13]。其機制可能與p53/ MIC-1信號轉導通路異常有關,野生型p53能結合到MIC-1的啟動子區域,抑制其表達影響下游信號轉導通路的激活。p53基因突變后,MIC-1表達增加,激活下游Smad3、Smad4及FAST-1等轉錄因子,促進c-myc、p15、CDC25A等靶基因的表達,進而促進細胞增殖[5]。本研究結果顯示,MIC-1的臨界參考值為1 000 pg/mL,其診斷NSCLC的靈敏度和特異度分別為71.2%、93.6%,表明檢測血清MIC-1是一種較高特異性的診斷指標。國內學者報道,MIC-1可作為早期NSCLC血清腫瘤生物標志物,有助于提高肺癌早期診斷且是預測患者預后的獨立預測指標[14]。
本研究結果顯示,NSCLC患者血清MIC-1水平與病理分期有關,而與性別、年齡、腫瘤直徑、病理類型、病理分級及治療方案無關。病理分期越高,NSCLC患者血清MIC-1水平越高,表明病理分期可能是影響血清MIC-1水平的因素。與以往研究結果一致[15],其機制可能是高分期腫瘤通過表達高水平MIC-1進而促進細胞的局部浸潤與遠處轉移。以往對晚期NSCLC的治療多以鉑類為基礎聯合化療。隨著NSCLC患者KRAS、EGFR等癌基因發現,臨床上應用吉非替尼、厄洛替尼等表皮生長因子受體酪氨酸激酶抑制劑對晚期NSCLC患者進行靶向治療,取得較好的臨床療效,并可延長晚期NSCLC患者的生存時間[16]。尋找NSCLC患者血清腫瘤標志物以評估NSCLC患者靶向治療的療效和預后,是近年來研究重點[17]。本研究結果顯示,NSCLC組靶向治療總有效率為34.62%,治療有效者靶向治療前血清MIC-1水平低于治療無效者,表明NSCLC患者治療前血清MIC-1水平有助于預測靶向治療的效果。其具體作用機制尚不清楚,有研究表明,對厄洛替尼耐藥的肺腫瘤細胞TGF-β1和TGF-β2分泌增加,TGF-β表達增加以自分泌方式激活相應信號轉導通路,導致腫瘤細胞獲得間充質樣形態,增加運動和侵襲能力,并增加厄洛替尼抗性[18]。
綜上所述,MIC-1可以作為一種新的診斷NSCLC的腫瘤標志物,患者血清MIC-1水平與腫瘤分期有關,檢測患者血清MIC-1水平有助于NSCLC的診斷,并預測靶向治療的有效性,尚需前瞻性、多中心及大樣本臨床實驗深入研究。

