轉化生長因子β1在煙曲霉暴露致支氣管哮喘大鼠氣道重塑中的作用
鄧林 徐浩 戰欣 劉曉玲 高福生濰坊醫學院6053;濰坊醫學院附屬醫院呼吸內科6000
煙曲霉菌是一種常見的霉菌,是重癥支氣管哮喘(哮喘)獨立的危險因素[1]。研究表明,在哮喘患者中,28.5%的患者煙曲霉抗原皮膚試驗呈陽性,且與哮喘嚴重程度呈明顯相關。英國學者Dening首先提出了真菌致敏的嚴重哮喘的概念,之后的學者們也嘗試著總結了其特征性表現。先前我們的試驗也證實,煙曲霉暴露確實可以加重哮喘大鼠氣道上皮下纖維化[2],但是具體機制仍不明確。
本研究通過對雞卵清蛋白(ovalbumin,OVA)致敏液致敏和OVA 激發液激發建立的哮喘大鼠模型,吸入煙曲霉菌分生孢子,從而研究轉化生長因子 β1(transforming growth factor-β1,TGF-β1)與氣道重塑之間的關系。
1 材料與方法
1.1 主要試劑與材料 煙曲霉菌株(濰坊醫學院附屬醫院細菌室),OVA 干粉(solarbio,中國北京索來寶科技有限公司),氫氧化鋁(中國天津博迪化工股份有限公司),SB-431542(中國上海前塵生物科技有限公司),Anti-TGF-β1抗體(美國abcam),Tris-EDTA 抗原修復液、抗鼠/兔通用型免疫組織化學檢測試劑盒(美國proteintech),TGF-β1酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)試劑盒(中國上海伊萊瑞特生物科技有限公司),Masson三色染色試劑盒(中國北京索萊寶有限公司),霧化器(boy037G 600型,pari德國),霧化箱(自制,密閉有機玻璃50 cm×27 cm×25 cm)。
1.2 制備煙曲霉菌孢子懸液、致敏液、霧化液取自于侵襲性肺曲霉菌病患者的一株煙曲霉。將煙曲霉在37 ℃的沙氏瓊脂平板培養基上培育2 周。參考文獻[2]的方法,制得分生孢子懸液,離心濃縮后,用血球計數板調整分生孢子濃度,每1 ml生理鹽水中含有1×105的分生孢子。致敏液:1 mg OVA+100 mg氫氧化鋁+1 ml生理鹽水混懸液,現用現配。霧化液:OVA 50 mg溶于注射用水5 ml,現用現配。
1.3 實驗動物及分組 選取健康清潔型的雄性wistar大鼠共32只,由濟南朋悅實驗動物有限公司提供[SCXK(魯)20140007],4~5 周齡,體質量140~170 g。本研究符合 《赫爾辛基宣言》的原則。在濰坊醫學院動物房飼養,室溫26 ℃,濕度50%,模擬晝夜燈光分別為12 h,標準飼料,自由飲水。隨機分為4組,每組8只。Ⅰ組(哮喘組):用致敏液致敏、霧化液激發的方式建立哮喘大鼠模型,致敏,在第1天、第8天,在大鼠兩腹股溝、腹和前肢皮下注射致敏液,每點0.2 ml,腹腔注射0.2 ml;霧化,在第15、18、21天,將大鼠放置于自制密閉有機玻璃箱(50 cm×27 cm×25 cm)內,連接霧化器,用霧化液進行霧化吸入激發,每周3次,每次30 min。Ⅱ組(哮喘+煙曲霉孢子吸入組):用致敏液致敏、霧化液激發的方式建立哮喘大鼠模型,在第23、26、30、33、37、40 天,經鼻滴入煙曲霉菌分生孢子懸液100μl,用10%水合氯醛(3 ml/kg)麻醉大鼠,經鼻滴入100μl煙曲霉孢子懸液,每側鼻孔滴入50μl,維持垂直體位10 min。Ⅲ組(哮喘+生理鹽水吸入組):用致敏液致敏、霧化液激發的方式建立哮喘大鼠模型,在第23、26、30、33、37、40天,經鼻滴入0.9%生理鹽水100μl。Ⅳ組(哮喘+煙曲霉孢子吸入+TGF-β1 抑制劑滴鼻組):用致敏液致敏、霧化液激發的方式建立哮喘大鼠模型,在第23、26、30、33、37、40天,經鼻吸入煙曲霉菌分生孢子懸液100μl,在每次分生孢子懸液吸入1 h 之前經鼻給予14 mg/L 的SB-431542 0.5 ml。SB-433542的劑量參考文獻[3],后在本實驗正式開始之前經預實驗證實所得。
1.4 手術與取材 各組大鼠于最后一次經鼻吸入煙曲霉孢子后24 h處死。取右肺上葉液氮中保存待用,將右肺下葉置于10%甲醛中固定72 h,常規脫水、石蠟包埋,5μm 厚切片,進行 HE 及Masson三色(Masson trichrome)染色。經氣管插管行左肺支氣管肺泡灌洗,回收的支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)經離心后,上清液-80 ℃保存。
1.5 ELISA ELISA 法測定BALF 上清液中TGF-β1 含量,取出 BALF 上清液,室溫孵育20 min,根據ELISA 試劑盒操作說明書步驟進行操作。用酶標儀在450 nm 波長測定各孔光密度(A)值。
1.6 肺組織中TGF-β1免疫組織化學染色 取已經包埋好的大鼠肺組織石蠟塊切片,脫蠟入水,制作組織切片。選取兔抗鼠TGF-β1單克隆抗體,工作濃度為1∶500,選取抗鼠/兔通用型二抗,DAB染色,HE復染,用中性樹脂封存切片。陽性結果為支氣管周圍細胞外基質,特別在氣道網狀基底膜區域、固有層以及黏膜下層出現黃色或棕黃色的顆粒。每只大鼠隨機選取5個直徑在500~1 000μm的細支氣管區,應用Image Pro-Plus software 6.0軟件計算陽性結果信號累積光密度。以TGF-β1染色陽性的IOD 表示TGF-β1表達水平。
1.7 肺組織HE染色、Masson染色 按照HE染色試劑盒說明進行染色。陽性結果為胞漿呈淡紅色,胞核呈藍黑色。在HE染色切片上,Olympus顯微鏡下放大200 倍,CCD 數字相機采集圖像,各只大鼠均于直徑500~1 000μm 的細支氣管區中取像,隨機選取5個視野,測量支氣管管壁厚度和支氣管平滑肌厚度。
按照Masson染色試劑盒說明進行染色。陽性結果為膠原纖維呈藍色,細胞核呈黑藍色。在Masson染色切片上,與上述方法一致,測量氣道上皮基底膜下20μm 區域內被染成藍色的非細胞部分的面積和該區域的總面積,以被染成藍色部分的面積占該區域總面積的百分比表示上皮下膠原纖維沉積的程度。
1.8 統計學分析 采用SPSS 17.0軟件進行統計學分析,定量資料以表示。2組間比較采用兩獨立樣本t檢驗,多組間比較采用單因素方差分析,組間均數檢測采用SNK 檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 BALF 上清液中 TGF-β1含量 Ⅱ 組 BALF中TGF-β1的含量[(85.06±14.30)μg/L]與Ⅲ組BALF中TGF-β1的含量[(38.90±8.31)μg/L]相比,TGF-β1水平明顯升高(t=7.89,P<0.01)。Ⅰ組BALF中TGF-β1 的含量[(33.21±5.14)μg/L]與Ⅲ組相比,TGF-β1水平差異無統計學意義(t=-1.64,P>0.05)。Ⅳ組BALF中TGF-β1的含量[(65.85±11.32)μg/L]與Ⅱ組相 比,TGF-β1水平降低(t=2.98,P<0.05)。
2.2 肺組織中TGF-β1免疫組織化學染色 Ⅱ組肺組織中TGF-β1 的表達(IOD 為2.13±0.15)與Ⅲ組肺組織中TGF-β1的表達相比(IOD 為0.90±0.07),TGF-β1表達明顯升高(t=21.06,P<0.05)。Ⅳ組肺組織中 TGF-β1的表達(IOD 為1.68±0.15)較Ⅱ組TGF-β1表達明顯降低(t=5.90,P<0.05)。Ⅰ組肺組織中 TGF-β1 的表達(IOD 為0.82±0.01)與Ⅲ組相比,TGF-β1表達差異無統計學意義(t=-3.40,P>0.05)(圖1、2)。

圖1 各組大鼠肺組織TGF-β1 表達病理學觀察 HE ×200 A:哮喘組;B:哮喘+煙曲霉孢子吸入組;C:哮喘+生理鹽水吸入組;D:哮喘+煙曲霉孢子吸入+TGF-β1 抑制劑滴鼻組
2.3 肺組織中HE 染色、Masson 染色 肺組織HE染色觀察大鼠氣道壁及平滑肌增厚情況。肺組織Masson染色觀察大鼠氣道上皮下膠原纖維沉積情況。Ⅱ組HE 染色為紅色的支氣管壁厚度[(17.39±2.89)μm2/μm]、支氣管平滑肌厚度[(12.21±2.50)μm2/μm]與Ⅲ組支氣管壁厚度[(8.67±1.48)μm2/μm]、支氣管平滑肌厚度[(5.06±1.78)μm2/μm]相比,明顯增厚(t=7.60、6.58,P值均<0.05)。染色為藍色的膠原纖維Ⅱ組上皮下膠原沉積[Masson trichrome藍染面積/基底膜下 20 μm 區域面積為(42.52±7.34)%]與Ⅲ組上皮下膠原沉積[Masson trichrome藍染面積/基底膜下20μm 區域面積為(16.92±3.11)%]相比,明顯沉積(t=9.14,P<0.05)。
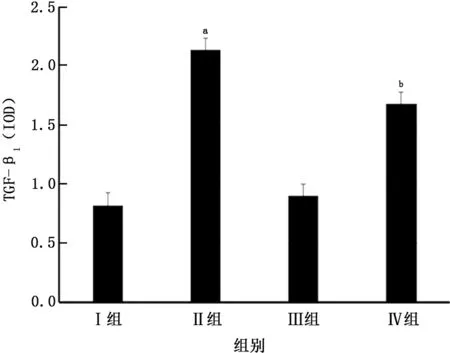
圖2 各組大鼠肺組織TGF-β1 表達形態學分析
圖3 各組大鼠氣道壁、平滑肌增厚病理學觀察 HE ×200 A:哮喘組;B:哮喘+煙曲霉孢子吸入組;C:哮喘+生理鹽水吸入組;D:哮喘+煙曲霉孢子吸入+TGF-β1 抑制劑滴鼻組
Ⅳ組支氣管壁厚度[(9.92±1.32)μm2/μm]、支氣管平滑肌厚度[(5.21±3.01)μm2/μm]與Ⅱ組相比,未見明顯增厚(t=6.64、5.06,P值均<0.05)。Ⅳ組上皮下膠原沉積[Masson trichrome藍染面積/基底膜下20μm 區域面積為(19.03±6.88)%]與Ⅱ組相比,膠原纖維未見明顯沉積(t=6.58,P<0.05)。Ⅰ組大鼠支氣管壁厚度[(7.61±1.18)μm2/μm]、支氣管平滑肌厚度[(4.16±1.59)μm2/μm]與Ⅲ組相比,氣道壁增厚差異無統計學意義(t=-1.59、-1.07,P>0.05),Ⅰ組上皮下膠原沉積[Masson trichrome藍染面積/基底膜下20μm區域面積為(14.15±3.08)%]與Ⅲ組相比,膠原纖維沉積差異無統計學意義(t=-1.42,P>0.05)(圖3~7)。
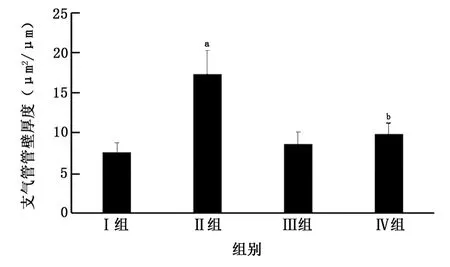
圖4 各組大鼠氣道壁增厚形態學分析
3 討論
煙曲霉菌,在室內環境和糧食粉塵中廣泛存在。由于其體積小(直徑為2~3μm)和疏水性,可能會懸浮在空氣中很長一段時間,因此增加了吸入人肺泡組織中的可能性,但是卻只有在部分易感人群中才會導致一系列疾病[4-5]。研究證實,煙曲霉菌孢子長期吸入與哮喘患者呼吸道癥狀密切相關[6],但是最常見的表現形式是哮喘患者對煙曲霉菌的超敏反應,它是ABPA 發展的第一步,當然只有少部分煙曲霉菌超敏反應的患者發展為ABPA[1]。
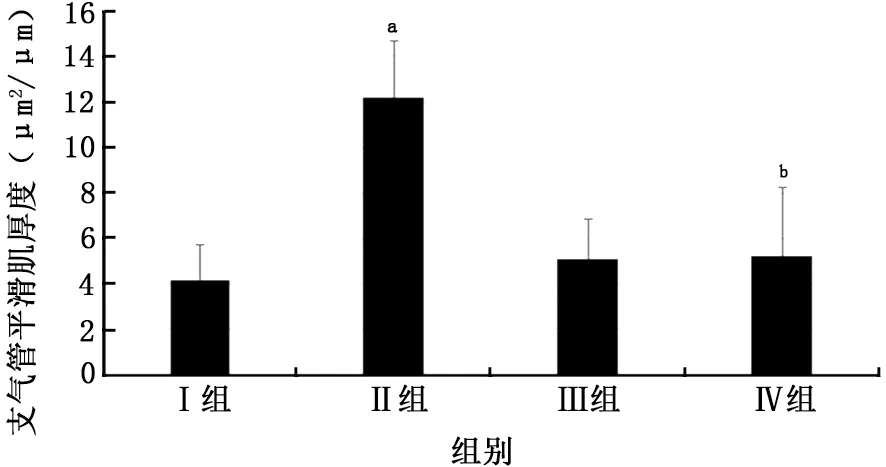
圖5 各組大鼠氣道平滑肌增厚形態學分析
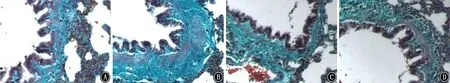
圖6 各組大鼠氣道上皮下膠原纖維沉積病理學觀察 HE ×200 A:哮喘組;B:哮喘+煙曲霉孢子吸入組;C:哮喘+生理鹽水吸入組;D:哮喘+煙曲霉孢子吸入+TGF-β1 抑制劑滴鼻組
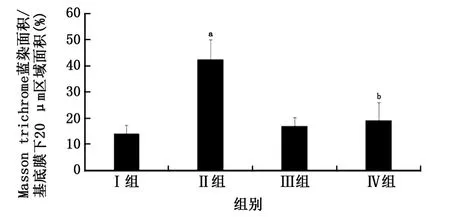
圖7 各組大鼠氣道上皮下膠原纖維沉積形態學分析
我們前期的研究[2,7]發現煙曲霉暴露可以加重哮喘大鼠的Th2型氣道炎癥,促進氣道上皮下纖維化,從而增加氣道反應性。并且煙曲霉暴露對哮喘大鼠的影響不依賴于煙曲霉在氣道的定植。
煙曲霉菌暴露加重哮喘氣道重塑的機制目前尚未闡明。本研究發現,哮喘大鼠給予慢性煙曲霉菌暴露后,無論在BALF中TGF-β1的含量還是肺組織免疫組織化學中TGF-β1的表達均明顯增加,同時,HE染色提示支氣管管壁增厚,支氣管平滑肌增厚,Masson染色顯示支氣管上皮組織下膠原沉積進一步加重(t=7.60、6.58、9.14、7.89、21.06,P值均<0.05)。而在哮喘大鼠慢性煙曲霉暴露后給予 TGF-β1 抑制劑處理,TGF-β1 表達明顯減低,同時支氣管管壁增厚程度、支氣管平滑肌增厚程度及支氣管上皮組織下膠原沉積的程度均明顯減輕(t=6.64、5.06、6.58、2.98、5.90,P值均<0.05)。結果提示吸入慢性煙曲霉暴露,可能通過增加TGF-β1表達的方式,促進氣道管壁增厚、支氣管平滑肌增厚、上皮組織下膠原沉積,表現為肺組織纖維化程度增加,從而加重氣道重塑。
相關研究也進一步證實了這點。多項研究證實[8-10],TGF-β1/Smad信號通路與纖維化程序的啟動相關,而Stumm 等[11]證實了其在哮喘氣道重塑形成的過程中同樣發揮重要的作用。在對慢性哮喘發病機制的研究中,樸紅梅和宋秋紅[3]得出了如下結論:TGF-β 受體抑制劑可能通過競爭抑制TGF-β 與受體的結合,進而抑制其下游因子CTGF m RNA 和膠原α1m RNA 的表達,延緩或改善氣道重塑。同時約1/3到1/2的重度哮喘患者存在對曲霉菌的過敏[12]。哮喘時氣道微環境的改變有利于煙曲霉孢子在呼吸道黏膜的黏附滯留,而煙曲霉菌在肺內的長時間停留,是氣道炎癥和氣道纖維化的原因[13]。而且越來越多的證據表明真菌過敏與重癥哮喘表型有關,即真菌致敏的重癥哮喘。如果不及時治療,氣道纖維化會導致肺功能的逐漸喪失[12],而且現在基于真菌致敏的重癥哮喘的抗真菌治療的相關研究也很少[14]。
總之,本研究利用OVA 致敏激發液激發建立的哮喘大鼠模型,然后給予慢性煙曲霉暴露,并同時給予 TGF-β1 抑制劑處理,結果顯示TGF-β1 抑制劑可以抑制煙曲霉菌暴露所致的氣道重塑。本研究結果提示TGF-β1可能參與了慢性煙曲霉暴露所致哮喘的氣道重塑,其確切的機制有待進一步研究。
利益沖突所有作者均聲明不存在利益沖突

