膿毒癥患兒血RDW水平與PCIS評分及血乳酸的相關性研究*
余 莉,郭 勇,車 頔,吳婕翎,鄧鈺紅
(廣州醫學院附屬廣東省婦女兒童醫院兒童保健科,廣州 511400)
紅細胞分布寬度(red blood cell distribution width,RDW)是臨床常用的檢測項目之一,反映循環血紅細胞體積異質性,常用于貧血的鑒別診斷。近年大量研究顯示,RDW不僅與多種血管心腦疾病,如高血壓、心力衰竭、冠狀動脈粥樣硬化性心臟病、心肌梗死、腦卒中等有關,也與各種原因導致的危重癥患者的死亡結局相關[1-5]。有報道發現重癥監護室(intersive care unit,ICU)患者的不良結果與RDW升高有獨立的聯系,RDW可作為ICU患者死亡風險的一個新型預測標志[6]。然而,有關RDW與兒童膿毒癥嚴重程度及住院預后的研究較少,本研究回顧性分析某院ICU膿毒癥患兒的RDW水平,旨在探討入院時RDW水平與病情嚴重程度和預后的關系,了解RDW在評估兒童膿毒癥病情及轉歸中的價值和意義。
1材料與方法
1.1 研究對象 收集2012年1月~2014年12月入住某院ICU共204例膿毒癥患兒,男性132例,女性72例,男女比例為1.8∶1,平均年齡2.1±2.5歲,其中肺炎81例,腸炎44例,顱內感染58例,皮膚感染3例,腎積膿3例,尿路感染3例,其他12例。膿毒癥診斷根據《2012年國際嚴重膿毒癥與感染性休克管理指南》制定的標準[7]。研究對象滿足以下標準者被排除在外:①新生兒或年齡>18歲;②既往及入院后診斷血液系統疾病,影響RDW水平者,如珠蛋白生成障礙性貧血、再生障礙性貧血、缺鐵性貧血、巨幼細胞性貧血、白血病和葡萄糖-6-磷酸脫氫酶缺乏癥等;③既往或入院后診斷肺動脈高壓、高血壓、惡性腫瘤及營養不良者;④使用已知可引起紅細胞形態和流變學變化(如促紅細胞生成素、環孢素)藥物及近期放化療患者;⑤外傷出血者,近期手術患者;⑥入院前 6個月內有輸血史者。本研究獲倫理委員會批準及患者家長知情同意。
1.2 試劑和儀器 采用Sysmex XE-2100全自動血細胞分析儀檢測RDW,西門子RAPIDPoint 500血氣分析儀檢測血乳酸。實驗中所有配套試劑均采用日本Sysmex公司及西門子公司原裝配套。檢測前常規對設備進行系統性維護及校準,并進行室內質控物檢測,待質控在參考范圍內后再行標本檢測,所有檢驗項目均嚴格按照試劑盒說明及檢測流程進行。
1.3 方法 患者入院后24 h內采集靜脈血2 ml于EDTA-K2抗凝管中,來回輕搖混勻,30 min內送檢,同時用肝素抗凝的注射器抽取動脈血2 ml在床旁西門子RAPIDPoint 500血氣分析儀上迅速檢測血乳酸。
根據出院時患兒是否存活,將患者分為存活組和死亡組,比較兩組小兒重癥評分(pediatric critical jllness score,PCIS評分)、RDW水平和乳酸水平;根據1995年中華醫學會兒科學組制定的PCIS評分標準,分為危重組PCIS 71~80分;極危重組PCIS≤70分,比較兩組RDW水平、乳酸水平及死亡率;按《2012年國際嚴重膿毒癥與感染性休克管理指南》及中華醫學會《兒童膿毒性休克(感染性休克)診治專家共識(2015版)》制定的標準[7-8],根據有無并發心血管功能障礙或急性呼吸窘迫綜合征或更多其他器官功能障礙,將膿毒癥患兒分為嚴重膿毒癥組和非嚴重膿毒癥組,比較兩組患兒的PCIS評分、RDW水平、乳酸水平及死亡率;依據RDW水平將患者分為兩組:RDW≤14.0%組,RDW>14.0%組,比較兩組PCIS評分、死亡率和乳酸水平;并對RDW水平與PCIS評分及乳酸水平進行相關性分析。
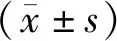
2結果
2.1 不同轉歸組的PCIS評分、RDW水平及乳酸水平比較 見表1。204例膿毒癥患兒中,存活151例,死亡53例,死亡率26.0%。死亡組PCIS評分低于存活組,死亡組RDW及乳酸水平高于存活組,差異均有統計學意義(P<0.05)。

表1 不同預后組的PCIS評分、RDW水平及乳酸水平比較
2.2 不同PCIS評分組的RDW水平、乳酸水平和死亡率比較 見表2。平均PCIS評分75.4±5.0,PCIS評分≤70分35例,PCIS評分71~80分169例。PCIS≤70組RDW、乳酸水平及死亡率均比PCIS 71~80組升高,差異均有統計學意義(P<0.05)。

表2 不同PCIS評分組的RDW、乳酸水平和死亡率比較
2.3 嚴重膿毒癥組與非嚴重膿毒癥組PCIS評分、RDW水平、乳酸水平及死亡率比較 見表3。嚴重膿毒癥94例,非嚴重膿毒癥110例,嚴重膿毒癥組PCIS評分比非嚴重膿毒癥組降低,嚴重膿毒癥組RDW、乳酸水平及死亡率比非嚴重膿毒癥組升高,差異均有統計學意義(P<0.05)。

表3 不同疾病嚴重程度的PCIS評分、RDW水平、乳酸水平及死亡率比較
2.4 不同RDW水平組的PCIS評分、乳酸水平和死亡率比較 見表4。RDW范圍為11.3%~23.3%,平均14.7%± 1.9 %,RDW≤14.0% 84例,RDW>14.0% 120例,RDW>14.0組PCIS評分比RDW≤14.0組降低,RDW>14.0組乳酸水平和死亡率比RDW≤14.0組升高,差異均有統計學意義(P<0.05)。

表4 不同RDW水平組的PCIS評分、乳酸水平和死亡率比較
2.5 RDW水平與PCIS評分及乳酸水平的關系 RDW水平與PCIS評分呈正態分布,兩者呈負相關(r=-0.305 7,P<0.000 1),RDW水平與乳酸水平呈正相關(r=0.195 4,P=0.005 1)。
3討論膿毒癥是因病原體感染所致的一種全身炎癥反應綜合征,是兒科常見的危重癥之一,嚴重的膿毒癥常伴隨著多器官功能障礙,病死率較高。美國(PIRO)概念提倡使用容易測量的生物學指標作為及時評估膿毒癥患者嚴重程度及預測死亡的附加手段[9]。血細胞檢測是膿毒癥患者必查的項目,RDW是其中的指標之一。越來越多的研究更新了我們對RDW的認識。研究發現,RDW也可作為一種新型的疾病預后標記物,RDW升高與膿毒癥預后不良有關[10-11]。本研究以膿毒癥兒童為研究對象,發現死亡組患兒入院24 h內RDW水平高于存活組患兒,兩組相比差異有統計學意義。SADAKA等[12]研究顯示膿毒性休克患者第1天的RDW水平與死亡風險相關,隨RDW水平升高,死亡風險也相應增高,并且通過受試者工作特征曲線分析,發現RDW優于APACHEⅡ和SOFA評分,認為RDW是預測患者住院期間死亡率的強效因子。LORENTE等[13]發現死亡組膿毒癥患者第一周的RDW水平明顯高于存活組患者,膿毒癥患者第一周的RDW水平與膿毒癥嚴重程度相關,且與血漿MDA水平,TNF-α等炎癥因子水平相關。因此認為第一周的RDW水平可以作為膿毒癥患者預后的指標。我們發現與非嚴重膿毒癥組相比嚴重膿毒癥患兒RDW水平更高,乳酸水平及死亡率也更高,兩組相比差異均有統計學意義。
國內常采用PCIS評分評估膿毒癥患兒的預后,PCIS分值越低提示病情越重,死亡危險程度越高[14]。我們將患兒分為危重組(PCIS 71~80分)和極危重組(PCIS≤70分),發現PCIS≤70分組患兒的死亡率更高,并且RDW水平較PCIS 71~80分組有明顯升高。本研究數據顯示RDW水平與PCIS評分呈負相關,隨著PCIS分值降低,RDW水平升高。膿毒癥病理生理改變之一是微循環功能障礙,血乳酸是膿毒癥治療中的重要觀察指標,乳酸≥2 mmol/L稱為高乳酸血癥,乳酸≥4 mmol/L時稱為乳酸中毒,血乳酸水平與膿毒癥的嚴重程度和預后密切相關[15-16]。本研究發現膿毒癥患兒入院24 h內RDW水平與乳酸水平相關,死亡組入院24 h內平均乳酸水平>4 mmol/L,平均RDW水平達16.2%。RDW>14.0%組患兒與RDW≤14.0%組相比,乳酸水平更高,PCIS分值更低,死亡率也更高。提示危重患者的轉歸及預后與入院時的RDW水平密切相關。相對于其他價格昂貴、檢測復雜的檢驗項目,作為血細胞分析檢驗常規參數的RDW 檢測簡單、廉價,易于推廣應用,監測RDW 有助于指導臨床評估膿毒癥患兒預后和危險分層。
RDW預測膿毒癥患兒病情及預后的具體病理生理機制尚不完全清楚,可能與膿毒癥炎癥反應及氧化應激反應有關。大量炎性因子釋放入血,通過影響促紅細胞生成素基因的表達來抑制促紅細胞生成素的生成和釋放,并通過激活紅細胞凋亡和周邊吞噬,影響紅細胞膜糖蛋白與離子通道,從而造成紅細胞形態學改變;氧化應激反應導致紅細胞膜破壞和紅細胞脆性增加,誘導紅細胞與內皮細胞黏附及降低紅細胞的變形能力,從而減少紅細胞生成和縮短紅細胞的壽命,導致 RDW升高[17-18]。膿毒癥患兒RDW升高可能是以上多種機制聯合作用的結果。
本研究的局限性:本研究為單中心回顧性研究,納入樣本量小,在臨床資料的查閱、數據收集等方面可能存在選擇偏倚,且本研究只是分析了入院時的RDW值,可能只能反映患者的即時危重程度,RDW的動態變化是否與感染性休克患者的預后相關,還需要多中心、大樣本的前瞻性研究進一步證實。
本研究膿毒癥患兒中,嚴重膿毒癥患兒及死亡患兒入院24 h內RDW水平明顯升高,入院24 h內RDW水平與PCIS評分及乳酸水平具有相關性,因此我們認為RDW水平與膿毒癥患兒疾病嚴重程度和死亡率相關,RDW適用于評價膿毒癥患兒危重程度和預后。RDW具有經濟、簡便、可反復檢測等優點,可以用于臨床動態觀察和評估患兒病情及轉歸。因此,RDW可望成為膿毒癥患者預后評估的一項新的實用的生物學標志。

