甘草酸對LPS誘導的IEC-6細胞NF-κB通路及炎癥因子表達的影響①
羅 敏 肖婷婷 曾 星 張 嫻
(廣州中醫藥大學第二附屬醫院,廣州 510120)
甘草酸(Glycyrrhizic acid,GA)又名甘草甜素,是豆科植物甘草根部提取物中最主要的活性成分。現代藥理研究表明甘草酸具有抗炎、抗潰瘍、抗過敏、抗氧化、皮質激素樣作用等生物學特性[1]。研究發現甘草酸對脂多糖(Lipopolysaccharide,LPS)誘導的腸上皮細胞IEC-6炎癥模型具有潛在的保護作用,其抗炎機制可能與抑制炎癥因子釋放和干預炎癥信號通路密切相關[2,3]。既往研究表明,甘草酸能夠調節LPS刺激的IEC-6細胞炎癥因子IL-6、TNF-α表達,減輕該細胞的炎癥性損傷,具有一定的抗炎作用[4]。在此,通過構建LPS誘導的IEC-6細胞炎癥模型,進一步觀察甘草酸對LPS誘導活化Toll樣受體4(Toll like receptor 4,TLR4)/NF-κB信號通路的干預作用,以明確甘草酸抑制IEC-6細胞炎癥損傷的細胞因子表達調控的分子機制。
1 材料與方法
1.1實驗材料 大鼠IEC-6細胞購自美國標準生物品收藏中心;甘草酸購自Fluka公司;LPS購自Sigma公司;高糖DMEM培養基、胎牛血清、0.25%胰酶消化液購自Gibco公司;RIPA蛋白提取試劑、兔抗NF-κB p65、p-IκBα、IκBα、環氧合酶2(Cyclooxygenase 2,COX-2)、誘導型一氧化氮合酶(Inducible nitric oxide synthase,iNOS)抗體購自CST公司;TRIZOL購自Invitrogen公司;BCA蛋白定量試劑盒和胞漿胞核試劑盒購自Thermo Scientific公司;逆轉錄試劑盒、熒光定量PCR試劑盒購自德國Roche公司;5×蛋白上樣緩沖液購自碧云天公司;TLR4、MyD88、GAPDH抗體購自Santa公司;LaminB1、α-tubulin、細胞間粘附分子-1(Intercellular adhesion molecular-1,ICAM-1)、CD14、IL-6、IL-10抗體購自Proteintech公司;Western blot所用試劑及分子標準購自美國Bio-Rad公司。
1.2實驗方法
1.2.1細胞培養及處理 將大鼠的IEC-6細胞用含10% FBS、0.1 U/ml胰島素的DMEM于37℃、5%CO2恒溫培養箱培養,待細胞融合度達80%時,用0.25%胰酶消化傳代。實驗設立Control組、LPS組、LPS+GA組、GA組,細胞接種貼壁后,Control組正常培養,GA組和LPS+GA組加入100 μg/ml的藥物作用24 h后,與LPS組一起加入10 μg/ml的LPS作用4 h后收集細胞用于后續實驗。
1.2.2細胞蛋白提取及Western blot法檢測蛋白表達水平 按上述細胞分組處理后收集細胞,棄上清,用4℃的PBS清洗2次。分別按照RIPA和胞漿胞核蛋白提取試劑盒說明書提取總蛋白、胞漿蛋白及胞核蛋白,BCA法蛋白定量變性后進行SDS-PAGE電泳、轉移至PVDF膜、5%脫脂奶粉封閉以及相應一抗4℃孵育過夜,二抗搖床孵育1 h,ECL化學發光顯影,應用成像分析系統進行條帶掃描分析結果。細胞總蛋白以GAPDH為內參,細胞漿蛋白以α-tubulin為內參,核蛋白以LaminB1為內參,應用Image J軟件進行條帶灰度分析,即可得到目的蛋白與對應內參蛋白之間的灰度值之比,并進行組間比較。實驗獨立重復3次。
1.2.3RT-qPCR檢測mRNA表達 Trizol裂解收集細胞,提取總RNA,逆轉錄合成cDNA,然后進行程序擴增,檢測各處理組細胞內TLR4、IL-6、IL-10的mRNA表達水平,引物序列見表1。
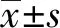
2 結果
2.1GA對LPS誘導的IEC-6細胞中TLR4信號通路相關膜蛋白分子TLR4、CD14、MyD88蛋白表達以及IκBα磷酸化的影響 Western blot結果如圖1所示,與Control組相比,LPS模型組TLR4、CD14、MyD88蛋白表達和p-IκBα磷酸化水平升高,差異具有統計學意義(P<0.05)。與LPS模型組相比,LPS+GA組與GA組能顯著逆轉這些蛋白的表達水平(P<0.05)。
2.2GA對LPS誘導的IEC-6細胞中NF-κB p65核轉位的影響 上述結果顯示GA可以顯著抑制CD14、TLR4蛋白表達及IκBα的磷酸化水平,進一步檢測NF-κB p65在細胞漿及細胞核的表達發現,與Control組相比,IEC-6細胞在LPS刺激下,核內NF-κB p65蛋白分布顯著增高,明顯高于Control組,GA干預后可顯著降低其表達(圖2,P<0.05)。而NF-κB p65總蛋白并沒有明顯變化,差異無統計學意義(圖2,P>0.05)。

表1 Real-time PCR引物序列Tab.1 Primer sequence of Real-time PCR
圖1 GA對LPS誘導的IEC-6細胞中TLR4、CD14、MyD88蛋白表達以及IκBα磷酸化的影響Fig.1 Effect of GA on expression of TLR4,CD14,MyD88 proteins and phosphorylation of IκBα in LPS-induced TLR4 signaling pathways of IEC-6 cellsNote: Compared with Control group,*.P<0.05,**.P<0.005,***.P<0.000 1;compared with LPS model group,#.P<0.05,##.P<0.005,###.P<0.000 1.

圖2 GA對LPS誘導的IEC-6細胞中NF-κB p65核轉位的影響Fig.2 Effects of GA on nuclear translocation of NF-κB p65 induced by LPS in IEC-6Note: Compared with Control group, **.P<0.005;compared with LPS model group, ##.P<0.005,###.P<0.000 1.
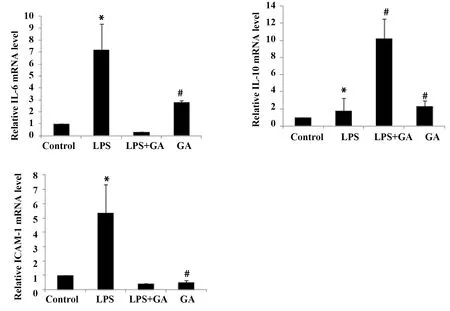
圖3 GA對LPS誘導的IEC-6細胞中ICAM-1、IL-6、IL-10 mRNA表達的影響Fig.3 Effect of GA on mRNA expression of ICAM-1,IL-6 and IL-10 induced by LPS in Note: Compared with Control group,*.P<0.05;compared with LPS model group,#.P<0.05.
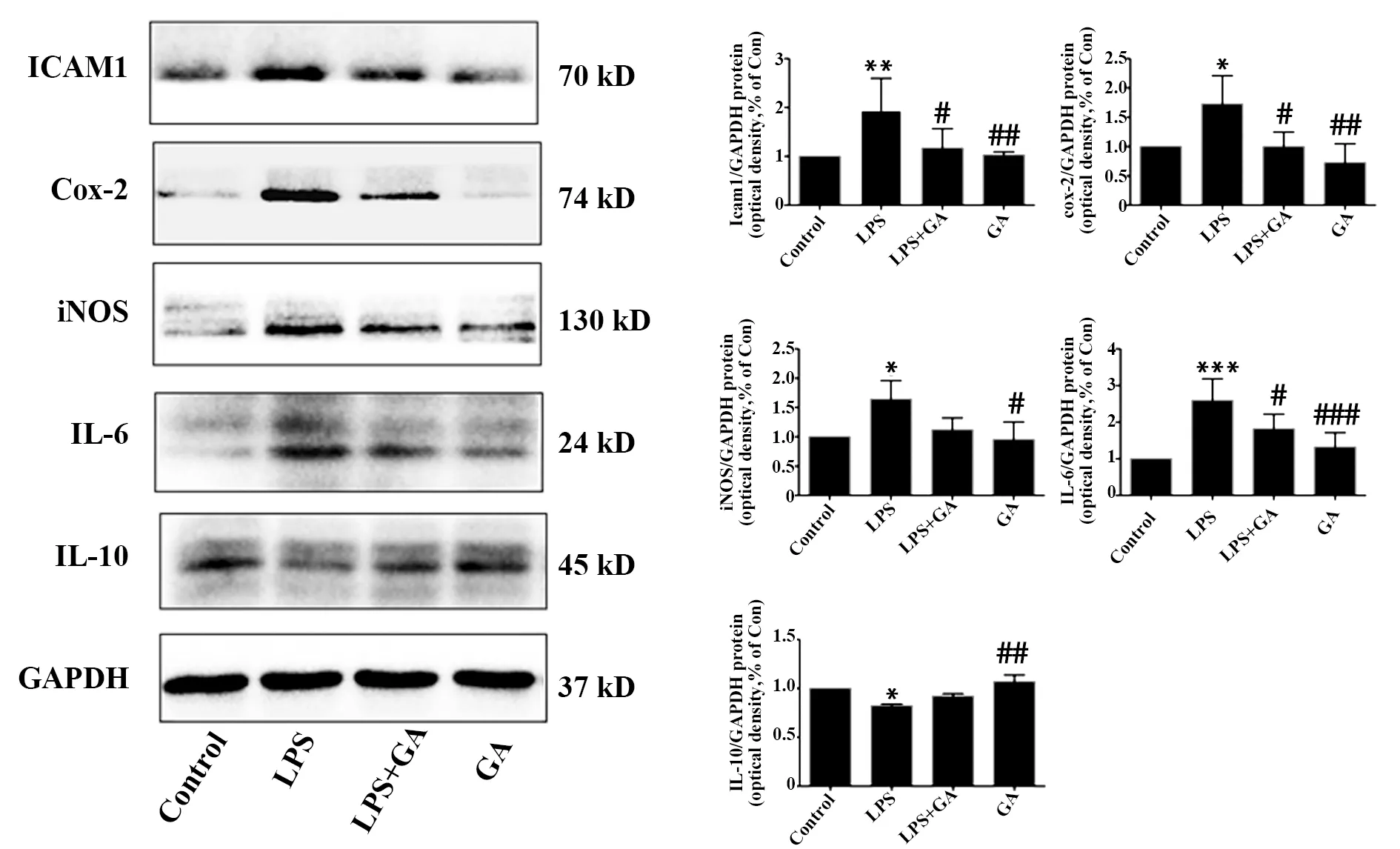
圖4 GA對LPS誘導的ICAM-1、COX-2、iNOS、IL-6和IL-10的影響Fig.4 Effect of GA on expression of ICAM-1,COX-2,iNOS,IL-6 and IL-10 induced by LPSNote: Compared with Control group,*.P<0.05,**.P<0.005,***.P<0.000 1;compared with LPS model group,#.P<0.05,##.P<0.005,###.P<0.000 1.
2.3GA對LPS誘導的IEC-6細胞中ICAM-1、IL-6和IL-10 mRNA表達的影響 RT-qPCR 結果顯示LPS誘導后,IEC-6細胞中ICAM-1、IL-6 mRNA表達水平明顯升高,IL-10 mRNA表達水平降低,并與Control組相比差異有統計學意義(圖3,P<0.05)。與LPS組相比,GA干預組ICAM-1、IL-6 mRNA表達水平顯著下降,IL-10 mRNA水平升高(圖3,P<0.05),差異有統計學意義。
2.4GA對LPS誘導的IEC-6細胞中ICAM-1、COX-2、iNOS、IL-6和IL-10蛋白表達的影響 Western blot結果如圖4所示,相對于Control組,LPS組ICAM-1、COX-2、iNOS、IL-6蛋白表達均明顯上調以及IL-10的蛋白表達量降低(P<0.05),與LPS相比,GA干預能顯著逆轉這些蛋白的表達水平,差異具有統計學意義。表明GA能影響NF-κB信號通路的活化以抑制炎癥基因的表達。
3 討論
LPS又稱為內毒素,是革蘭氏陰性菌的致病因子。正常生理情況下,腸道存在精確的負性調控機制使得腸上皮細胞與腸道高濃度的細菌保持共生狀態,而在病理狀態下,大量腸道內細菌和LPS直接接觸腸黏膜上皮細胞,可引起不同的腸道病理改變和炎癥損傷。CD14是第一個被鑒定為LPS受體的蛋白,通過識別結合LPS/LPB(LPS binding protein)復合物來介導LPS的免疫反應[5]。TLR4是識別LPS的關鍵上游受體,控制著LPS炎癥信號的細胞內轉導。在典型情況下,TLR4活化后CD14將LPS轉移至TLR4/髓樣分化蛋白2(Myeloid differentiation protein 2,MD-2)復合物中[6]。NF-κB是腸道炎癥和免疫反應中的關鍵轉錄因子,通常以二聚體亞基(p65及p50)與其抑制物IκB結合形成三聚體,并以無活性形式存在于細胞漿中[7]。TLR4被激活后的自身二聚化與MyD88結合,誘導IκB激酶即從無活性狀態轉為活性狀態,催化IκBα磷酸化降解,釋放的NF-κB暴露出p50 亞基上的易位信號和p65 亞基上的DNA 結合位點,借助p50由胞質轉入胞核內,借助p65與相應靶基因中的啟動子或增強子κB位點結合,從而誘導IL-6、TNF-α等炎癥因子的表達。
Western blot檢測結果顯示IEC-6細胞在LPS刺激后TLR4、CD14、MyD88 和p-IκBα蛋白表達增高,p65核內分布明顯增多,而甘草酸能阻止LPS誘導IEC-6細胞NF-κB通路的激活,減少p65的核轉位。Wang 等[8]報道用甲氨蝶呤誘導的腸炎性大鼠中,甘草酸可通過降低NF-κB p65 和 p38MAPK表達水平以預防腸炎發生。
ICAM-1屬于免疫球蛋白超家族成員,廣泛參與炎癥和免疫反應[9]。ICAM-1在正常腸組織中呈低水平表達,而在炎癥狀態下,ICAM-1的表達水平迅速上調, NF-κB可以和ICAM-1基因啟動子區的轉錄因子結合位點相互結合促進ICAM-1的表達,這與我們研究結果一致。我們還發現甘草酸預處理能夠顯著降低LPS刺激IEC-6細胞中ICAM-1的水平,正如Wang等[10]報道甘草酸能夠有效抑制單核細胞趨化蛋白-1和ICAM-1的表達,從而在糖尿病小鼠腎臟中發揮抗糖尿病作用。另外,ICAM-1缺陷小鼠在用3%葡聚糖硫酸鈉誘導的急性實驗性結腸炎模型中表現出更低的死亡率,并且炎性細胞浸潤和腸道損傷減少[11],這提示ICAM-1可能在急性腸道炎癥的發展中發揮關鍵作用。所以本實驗從另一個角度證實甘草酸可能是通過抑制ICAM-1的表達而減緩因各種因素造成的腸道炎癥性損傷。iNOS和COX-2是啟動子含NF-κB結合位點的兩種誘生型酶,也是介導炎癥過程的重要酶。在大多數正常狀態下不表達,而在炎癥時高度表達,分別催化一氧化氮(Nitric oxide,NO)、前列腺素E2(PGE2)的大量合成。現有研究表明,真核轉錄因子NF-κB參與調控iNOS和COX-2的表達。Zhao等[12]報道甘草酸通過抑制NF-κB信號通路的激活、抑制腎組織中NO和PGE2的產生以及降低iNOS和COX-2的表達水平,進一步緩解敗血癥誘導的大鼠急性腎損傷,顯著提高急性腎損傷大鼠存活率。此外,Wang等[13]研究顯示甘草甜素能夠顯著減弱小鼠子宮內膜上皮細胞中NF-κB的活化,同時LPS誘導的iNOS和COX-2表達被甘草甜素抑制,故甘草甜素可發展為治療子宮內膜異位癥的潛在藥劑。此外,已有大量研究表明[14-16],甘草酸能夠通過干預多個炎癥信號通路來減少或抑制炎癥因子的釋放,從而減輕LPS所導致的炎癥損傷。本實驗結果也表明,LPS組中iNOS和COX-2的表達水平顯著增加,而甘草酸干預后能夠減弱LPS誘導的IEC-6細胞中iNOS和COX-2的表達。同時本研究結果顯示甘草酸能抑制促炎性細胞因子IL-6分泌,增加抗炎性細胞因子IL-10分泌。
綜上所述,甘草酸能通過抑制LPS誘導的TLR4/NF-κB信號通路的活化以阻斷調控炎癥因子及相關蛋白的合成,從而達到有效抑制LPS所致的腸上皮細胞炎癥損傷。