沉默 annexin A5對喉癌Hep-2細胞增殖和侵襲的影響
周曉芳 劉 楊 侯秀秀 趙智翔 許敏達
喉癌是耳鼻喉科常見的惡性腫瘤之一,在頭、頸部上皮來源的原發惡性腫瘤中排名第2位,其中男性的發生率約為女性的10倍,且發生率呈逐年增高的趨勢[1]。近年來,激光治療在早期喉癌中雖然起到較好的治療效果,但對于患者的5年生存率并無明顯改善。目前對于中、晚期喉癌的治療仍以手術為主聯合放射治療和化學治療的綜合治療,然而手術造成的患者術后呼吸、發聲困難等相關后遺癥,特別是晚期喉癌患者,廣泛的喉部器官切除嚴重影響了患者的生活質量,為了更好的改善喉癌患者的診療和預后,從喉癌的生物學特性深入研究,尋找治療的新靶點,可能成為提高喉癌治療效果及改善患者生存質量的關鍵[2]。
作為膜聯蛋白家族重要成員之一的膜聯蛋白A5(annexin A5,ANEX5),在腫瘤的發生、發展中起到重要作用,通過多種途徑調控腫瘤細胞的生物學活性[3]。Zhao等[4]證實喉癌組織中annexin A5表達較癌旁正常組織明顯上調,且與喉癌的臨床分期、病理學分級及頸部淋巴結轉移等密切相關。筆者前期體外細胞實驗研究發現,有效阻低annexin A5的表達后,喉癌細胞凋亡減弱,因此筆者推斷annexin A5可能促進喉癌細胞的凋亡[5]。本研究采用RNA干擾技術體外沉默annexin A5基因在喉癌細胞中的表達,以進一步探討阻低annexin A5基因前后對喉癌Hep-2細胞增殖和侵襲的影響,為喉癌的基因治療提供可能的依據。
材料與方法
1.材料:人喉癌細胞 Hep-2購自上海生物科學研究院細胞總庫,細胞培養基RPMI-1640購自美國HyClone公司,LipofectamineTM2000 及Trizol購自美國Invitrogen公司,青霉素、鏈霉素、小牛血清購自美國Gibco公司,反轉錄試劑盒、taq酶購自日本TaKaRa公司,annexin A5單克隆抗體、β-actin單克隆抗體、二抗辣根過氧化物酶(horseradish peroxidase),HRP購自美國Epitmics公司,ECL化學發光試劑盒、Fibronectin購自美國Millipore公司,CCK-8 kit、蛋白裂解液、SDS-PAGE凝膠制備試劑盒購自中國碧云天公司,陰性對照siRNA和annexin A5-siRNA購自日本TaKaRa公司,Matrigel購自美國BD公司。
2.用siDirect Version2.0設計annexin A5基因的特異性siRNA序列:通過Pubmed比對及前期實驗證實有效的特異性RNA序列,并由大連寶生物公司合成。特異性siRNA序列為:上游引物:5′-CCAUGAUACUUUAAUCAGAAG-3′,下游引物:5′-UCUGAUUAAAGUAUCAUGGTT-3′;無關siRNA片段的上游引物:5′-AGGUGACUAGCACUGUUAGTT-3′,下游引物:5′-GUAACAGUGCUAGUCACCUTT-3′。
3.細胞培養:Hep-2細胞從液氮中復蘇,低速離心后去除凍存液,將Hep-2細胞培養于含10%小牛血清和1%青鏈霉素的1640培養基中, 5%CO2孵箱、37℃,48~72h傳代或換液。
4.細胞轉染:將對數生長的Hep-2細胞以2 ×105/孔接種到6孔板中,培養24h后參照脂質體(LipofectamineTM2000)說明書進行細胞轉染,siRNA濃度為50ng/L。實驗分成siRNA干擾組(含annexin A5-siRNA干擾片段及脂質體)、空白對照組(僅含脂質體)及陰性對照組(含無關序列siRNA片段和脂質體)3組,轉染液為RPMI-1640基礎培養基。轉染6h后換常規細胞培養基。
5.半定量實時PCR:細胞轉染后48h,用Trizol試劑提取Hep-2細胞的總RNA,檢測合格后反轉錄成cDNA,并用半定量PCR技術擴增膜聯蛋白A5基因,引物序列為:annexin A5(342bp):上游引物:5′-TCTCGGCTTTATGATGCTTATG-3′,下游引物:5′-TCGTGTTCCAAAGATGGTGAT-3′;β-actin(594bp):上游引物:5-GACCCAGATCATGTTTGAGACC-3′,下游引物:5′-ATCTCCTTCTGCATCCTGTCG-3′;將PCR擴增產物進行瓊脂糖凝膠電泳,嗅化乙錠染色,將成像系統采集的圖片通過PDQuest軟件分析比對,β-actin做內參,實驗重復3次。
6.Western blot法檢測:將轉染48h后的Hep-2細胞進行總蛋白提取,BCA蛋白定量后進行蛋白質電泳,根據蛋白質分子量選擇相應的SDS-PAGE凝膠,去30μg總蛋白上樣濃縮膠,80V恒壓電泳至樣品進入分離膠,改120V繼續恒壓電泳,當指示劑遷移至分離膠下游邊緣時停止電泳,200mA恒流轉膜40min后用封閉液封閉1h,4℃孵育annexin A5抗體過夜,用二抗IgG 室溫振蕩孵育1h后,洗滌液洗膜3次,ECL試劑盒法顯色,Bio-Rad成像系統成像,并用該系統對圖像進行分析,β-actin為內參,實驗均重復3次。
7.CCK-8檢測細胞增殖:將對數生長的Hep-2細胞接種于96孔板中,細胞濃度為1×104/孔,細胞鋪滿96孔板50%時進行細胞轉染,轉染siRNA終濃度50nmol/L,總體積為100微升/孔。細胞轉染24、48、72h分別加入CCK8試劑,37℃CO2孵箱中培育1h,酶標儀測定波長450nm的細胞吸光度,分析細胞增長情況。
8.Transwell小室侵襲實驗:50mg/L的Matrigel膠稀釋4倍后包被Transwell小室上室面,小室的下室面用10mg/L的Fibronectin均勻涂抹,37℃孵育1h;將培養板中殘余液體吸出,小室內每孔加入10g/L的BSA無血清培養液50μl,37℃孵育30min,然后將小室置于24孔板中,小室外加入常規1640培養基(含雙抗及10%小牛血清)600μl,將轉染48h的He-2細胞以1×105/200μl的濃度加入到小室內,37℃、CO2孵箱中培養24h后取出小室,并用棉簽仔細擦除微孔膜上層的細胞,將微孔膜下層的細胞用10%結晶紫進行染色,剪下微孔膜并固定載玻片上于在高倍顯微鏡下觀察計算細胞數,每個樣本各個方位隨機計數10個高倍視野(200倍),每組實驗重復3次。

結 果
1.siRNA干擾組能抑制annexin A5 mRNA的表達:如圖1所示,轉染48h后,siRNA干擾組中annexin A5基因mRNA相對表達水平為0.197±0.013,空白對照組為0.712±0.037,陰性對照組為0.674±0.063。結果提示siRNA干擾組annexin A5 mRNA表達較陰性對照組及空白對照組明顯下降(F=134.484,P<0.05),陰性對照組和空白對照組mRNA表達比較,差異無統計學意義(P>0.05)。
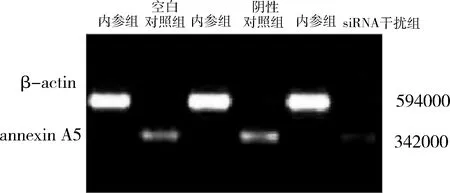
圖1 實時PCR檢測各組annexin A5 mRNA表達結果
2.siRNA干擾組能抑制annexin A5蛋白的表達:如圖2所示,轉染48h后,siRNA干擾組膜聯蛋白 A5蛋白相對表達水平為0.449±0.064;而空白對照組為0.949±0.074;陰性對照組為1.001±0.107。結果提示siRNA干擾組蛋白明顯下降,空白對照組和陰性對照組比較, 差異有統計學意義(F=39.849,P<0.05), 空白對照組和陰性對照組蛋白表達比較,差異無統計學意義(P>0.05)。

圖2 Western blot法檢測各組annexin A5蛋白表達結果
3.siRNA干擾組能抑制Hep-2細胞的增殖:如圖3、表1所示,轉染24h后,siRNA干擾組對比空白對照組和陰性對照組,差異無統計學意義,轉染48、72h后,siRNA干擾組細胞增殖低于空白對照組和陰性對照組,而空白對照組、陰性對照組細胞增殖比較,差異無統計學意義。

圖3 CCK-8法檢測Hep-2細胞增殖曲線
表1 CCK-8檢測細胞A值

分組24h48h72hsiRNA干擾組0.315±0.0020.607±0.0040.695±0.017陰性對照組0.311±0.0050.743±0.0240.942±0.008空白對照組0.315±0.0030.759±0.0180.962±0.008F1.73891.561636.374P0.2170.0000.000
4.siRNA干擾組能抑制Hep-2細胞的侵襲能力:Transwell小室實驗結果如圖4所示:空白對照組、陰性對照組細胞數分別為62.333±6.994和61.433±5.328,而siRNA干擾組為22.467±3.980個,siRNA干據組明顯低于空白對照組及陰性對照組(F=500.546,P<0.05),而空白對照組和陰性對照組細胞數比較,差異無統計學意義(P>0.05),沉默annexin A5基因的表達能夠在體外抑制喉癌Hep-2細胞的侵襲能力。

圖4 各組喉癌Hep-2細胞侵襲情況(結晶紫染色,×200)A.空白對照組;B.陰性對照組;C.siRNA干擾組
討 論
annexins是通過鈣離子調節的多功能蛋白家族,在細胞的信號轉導、鈣離子通道形成、炎性反應、腫瘤的增殖與分化、細胞骨架蛋白間的相互作用以及維持細胞外基質的完整性等方面具有重要作用[6]。annexin A5是膜聯蛋白家族中分布最廣泛、含量最豐富的成員之一,位于人染色體4q26~q28,由319個氨基酸組成,常以Ca2+依賴的形式與膜磷脂結合,參與一系列的細胞生物學過程[7]。近年來對annexin A5蛋白的研究備受關注,研究發現在多種惡性腫瘤中存在異常表達,并通過多種途徑調控腫瘤細胞的增殖和浸潤轉移[8~12]。研究發現,在頭頸部鱗狀上皮來源的惡性腫瘤中膜聯蛋白A5表達明顯上調,且其表達與腫瘤的惡性程度、侵襲轉移等密切相關[13]。
本研究通過化學合成的siRNA對annexin A5基因進行表達沉默。RNA干擾(RNA interference,RNAi)是一種已被證實能有效沉默目的基因表達的常見基因沉默的技術。通過實時PCR及Western blot法分別從mRNA水平和蛋白水平驗證siRNA對annexin A5基因干擾效果。圖1、圖2顯示,PDQuest軟件分析后顯示特異性的siRNA片段能有效干擾annexin A5基因mRNA和蛋白在喉癌細胞中的表達。通過CCK-8試劑盒檢測法及Transwell小室侵襲實驗發現,有效阻低annexin A5基因的表達后,喉癌細胞增殖、侵襲能力均明顯減弱,結果提示annexin A5可能促進腫瘤的增殖和侵襲轉移。
前期研究發現,annexin A5低表達抑制喉癌細胞的凋亡,同時又在喉癌晚期及伴淋巴轉移的癌組織中表達較早期喉癌表達明顯增高[4]。然而,干擾annexin A5在喉癌細胞中的表達后,喉癌細胞凋亡抑制,同時增殖和侵襲能力也減弱,即在同一種腫瘤細胞中,兼具促瘤和抑瘤作用。這可能與annexin A5參與細胞的炎性致癌相關,即annexin A5可能通過介導癌細胞凋亡而促使免疫反應發生,使低致瘤、低轉移的腫瘤細胞通過接觸早期炎性細胞而轉換成高致瘤、轉移性的腫瘤細胞[3]。此外研究發現,在調控腫瘤的侵襲和轉移過程中膜聯蛋白 A5起著重要作用,且在不同腫瘤細胞中annexin A5同時兼具促瘤和抑瘤作用[3,14]。Peng等[15]發現過表達annexin A5能夠增加小鼠肝癌細胞株的體外侵襲和轉移,且其表達水平與小鼠肝臟腫瘤的惡性程度及淋巴轉移密切相關,提示膜聯蛋白A5具有促瘤作用。Wang等[8]研究發現在宮頸癌細胞中annexin A5表達阻低后可能通過影響 E-cadherin和 MMP-9的表達來促進HeLa細胞的遷移和侵襲,提示膜聯蛋白A5具有抑癌作用。Sun等[16]發現在肺癌細胞中annexin A5通過調節多種細胞信號通路影響肺癌的發生、發展。Wu等[17]也發現在胃癌中上調annexin A5的表達能激活多藥耐藥相關蛋白(multidrug resistance-associated protein,MRP),而影響胃癌的預后。通過研究發現在不同腫瘤細胞中干擾annexin A5后對細胞侵襲轉移能力的影響并不一致。因此筆者推測,在喉癌細胞中annexin A5也可能通過影響某些腫瘤相關基因的表達或通過調節多種細胞信號通路來促進喉癌細胞的侵襲能力。
另外,有研究發現annexin A5 的酸性磷脂是其參與細胞內外重要功能的關鍵。annexin A5的酸性磷脂位于一個由4個相同區域構成的高度保守核心內,其中的蛋白核心都被折疊成5α螺旋后反轉纏繞成右手超螺旋,其氨基酸特殊的排列順序從而形成了annexin A5功能多樣性的特點[18]。因此推斷阻低annexin A5在喉癌Hep-2細胞中的表達阻低后,還可能引起部分annexin A5異常的磷酸化或在細胞內表達異位,從而使喉癌Hep-2細胞的生物學活性發生一定改變;或通過annexin A5介導Ca2+流動異常而影響腫瘤細胞的發生和發展[19]。
綜上所述,喉癌的發生、發展是多種因素影響的復雜過程,本研究發現,通過體外改變annexin A5在喉癌Hep-2細胞中的表達,能一定程度影響Hep-2喉癌細胞的增殖與侵襲能力,提示annexin A5可能在喉癌的發生、發展中發揮促癌作用,有望成為喉癌早期診斷和預后判斷的參考指標,但是annexin A5在喉癌中的作用及相關分子機制仍有待于深入研究。

