枸櫞酸抗凝與肝素抗凝在重癥患者持續腎臟替代治療中的應用
張 燕 王英杰 許 濤
山東省淄博市臨淄區人民醫院 255400
持續性腎臟替代治療(CRRT)是近年治療重癥急性腎衰竭、膿毒血癥、急性心力衰竭、多器官功能障礙綜合征(MODS)等危重病癥的重要進展之一。危重病癥患者常伴有不同程度的出血傾向,而肝素抗凝由于藥物本身的代謝特點、影響監測因素的多面性及個體差異等均可引發或加重出血,甚至危及生命。再者,因濾器使用時間問題造成的治療花費提高,均影響著患者的治療效果。因此如何進一步優化CRRT的抗凝技術顯得尤為重要。為此,學者們一直在做不懈的努力,如采用低分子肝素、前列腺素等新型抗凝劑。本研究選取我院重癥醫學科的40例危重癥患者,分別采用枸櫞酸抗凝及肝素抗凝方式進行持續腎臟替代治療,旨在探討枸櫞酸抗凝的有效性和安全性,以提高臨床經驗及治療效果。
1 材料與方法
1.1 材料 選取我院重癥醫學科2017年6月—2018年11月行持續腎臟替代治療的患者40例,將其分為枸櫞酸抗凝組(RCA組)和肝素抗凝組(對照組)。RCA組20例,男13例,女7例,年齡(63.95±7.90)歲,原發病:急性心衰5例、肝膿腫3例、急性胰腺炎4例、尿毒癥5例、一氧化碳毒性效應3例。對照組20例,男10例,女10例,年齡(62.35±10.17)歲,原發病:急性心衰6例、心肺復蘇術后3例、急性胰腺炎3例、感染性休克4例、有機磷中毒2例、尿毒癥1例、多發性損傷1例。兩組患者的一般資料及危重評分比較差異無統計學意義(P>0.05),見表1。
納入標準:符合入住重癥監護室3d內發生AKI或MODS。排除標準:(1)呼吸衰竭且難以糾正PaO2<60mmHg(1mmHg=0.133kPa);(2)難以糾正的持續肝功能異常;(3)低血壓、休克(BP<90/60mmHg);(4)中心靜脈置管血流不暢,CRRT無法順利進行。
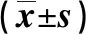
表1 兩組患者一般情況比較
注:*為Fisher確切概率法。
1.2 方法
1.2.1CRRT方法:采用瑞典生產的Prisma血濾機,血濾器為AN69M100丙烯腈血濾器。置換液為本科室根據患者情況配置的血液濾過置換液。行CVVH、CVVHD治療,血流量為100~200ml/min,前稀釋法比例50%~100%,置換液流速1 500~2 500ml/h,超濾量0~600ml/h。
1.2.2 抗凝方法:(1)RCA組:枸櫞酸輸注部位:血濾管通路動脈端,輸注速度為血流速的2.0%~2.5%。葡萄糖氯化鈣泵入速度為枸櫞酸泵速的6.1%,分別根據靜脈血及動脈血監測并調整枸櫞酸及葡萄糖酸鈣泵速。(2)對照組:采用肝素鈉持續泵入抗凝,治療前先用肝素鈉2 500U+生理鹽水1 000ml預沖并浸泡血濾器和血流管路30~50min后,再用生理鹽水1 000ml沖洗,肝素鈉5 000U+生理鹽水49ml配置肝素泵,如應用肝素前APTT35~45s,先負荷20U/kg,后直接泵入8U/(kg·h),根據病情調整負荷及持續泵入量。
1.3 監測指標
1.3.1 濾器使用時間:分別記錄兩組進行血液凈化時濾器使用時間及凝血發生情況。
1.3.2 凝血指標APTT:分別測出兩組血液凈化治療前和血液凈化治療后12h、24h、48h的APTT數值。
1.3.3 鈣離子濃度:分別測出兩組血液凈化治療前和血液凈化治療后12h、24h、48h的鈣離子濃度。
1.3.4RCA組pH和HCO3-值:分別測出RCA組血液凈化治療前和血液凈化治療后12h、24h、48h的pH和HCO3-值。
2 結果
2.1 兩組患者的濾器使用時間比較RCA組患者的濾器使用時間明顯長于對照組,差異有統計學意義(P<0.001)。RCA組患者治療中凝血的發生率為10.29%,低于對照組的22.67%,差異有統計學意義(P=0.048)。詳見表2。

表2 兩組患者的濾器使用時間比較
2.2 兩組患者治療前、后不同時間點的APTT比較 治療前兩組的APTT差異無統計學意義(P=0.630),治療后3個時間點的RCA組APTT均小于對照組,差異有統計學意義(P<0.05),詳見表3。

表3 兩組患者治療前、后不同時間點的APTT比較
2.3 兩組患者治療前、后不同時間點的鈣離子濃度比較 兩組患者治療前、后不同時間點的鈣離子濃度差異均無統計學意義(P>0.05),詳見表4。

表4 兩組患者治療前、后不同時間點的鈣離子濃度比較
2.4RCA組患者治療前、后不同時間點的pH值和HCO3-濃度比較RCA組患者治療前、后不同時間點的pH值、HCO3-濃度差異均有統計學意義(P<0.05),且治療后的pH值、HCO3-濃度均大于治療前,差異均有統計學意義(P<0.05)。見表5。

表5 RCA組患者治療前、后的pH值和HCO3-濃度比較
注: *為與治療前比較,P<0.05;#為與治療后12h比較,P<0.05。
3 討論
CRRT主要是利用對流、彌散、吸附等原理,將機體內的毒素、代謝產物、致病性生物分子、藥物連續性的清除,以及調節體液酸堿平衡及電解質平衡,進而調節和保護重要器官的功能[1]。 治療時由于需要將血液引至體外,且治療時間長,因此抗凝是保證CRRT順利進行的關鍵環節。然而危重癥患者多存在高齡、多器官功能衰竭、凝血功能異常,CRRT的抗凝治療持續時間長、抗凝不充分會造成超濾率下降,濾器凝血,過度的抗凝又會引起出血,CRRT雖有多種抗凝方法,肝素仍為CRRT最常用的抗凝劑[2],但易發生出血、過敏性休克、血小板減少等副反應[3-5]。而枸櫞酸抗凝由于體外抗凝確切,進入體內經過三羧酸循環而代謝,又不影響體內凝血,能有效防止血栓并發癥發生,逐漸成為高危患者血液凈化最理想的抗凝技術,在臨床應用也逐漸廣泛。因此,如何選擇一種抗凝方法能較長時間保持血液體外循環流量又能防止誘發加重出血等并發癥是整個治療的重要環節。
肝素鈉具有帶強負電荷的理化特性,能干擾血凝過程的許多環節,在體內外都有抗凝血作用。其作用機制比較復雜,主要通過與抗凝血酶Ⅲ(AT-Ⅲ)結合,而增強后者對活化的Ⅱa、Ⅸa、Ⅹa、Ⅺa和Ⅻa凝血因子的抑制作用。而枸櫞酸的抗凝機制是枸櫞酸與離子鈣絡合為可溶性復合物枸櫞酸鈣,從而顯著降低血液中的活性離子鈣濃度,進而阻斷了機體凝血的過程。但此種作用是可逆的,只要離子鈣得到足量的補充,體內凝血功能便可以快速恢復正常。通過濾器前動脈端輸入枸櫞酸,使濾器后離子鈣濃度維持在0.25~0.35mmol/L之間,從而有效抑制凝血過程,發揮體外抗凝作用,保證CRRT的順利進行。
本研究CRRT治療中分別應用肝素抗凝及局部枸櫞酸抗凝,均顯示了良好的抗凝效果,通過兩者治療前后凝血指標APTT數值的研究分析顯示RCA組明顯低于肝素組(P<0.05)。RCA組凝血的發生率明顯低于對照組(P<0.05)。均表明枸櫞酸在抗凝方面不會增加出血風險且安全有效。
本研究顯示兩組的濾器使用時間相比較差異有統計學意義(P<0.05),因此RCA組的濾器使用壽命較長,減少了危重患者CRRT治療中因更換濾器所使用的時間,從而更好地使病情得到控制和改善。本研究結果與吳壽坤等[6]的研究結果相近,但本研究中RCA組凝血發生率為10.29%,明顯高于他的研究,可能與本研究中一些患者臟器功能差,為預防發生枸櫞酸蓄積,在枸櫞酸用量上相對保守有關。
應用局部枸櫞酸體外抗凝時,管路中的枸櫞酸可被濾器清除一部分,剩余的部分進入體內后則通過三羧酸循環代謝為碳酸氫根。枸櫞酸的代謝屬于需氧代謝,當患者存在肝功能異常、低氧血癥等情況時,可因代謝能力的下降導致枸櫞酸蓄積,此時應慎用局部枸櫞酸抗凝。外周血中離子鈣濃度下降是反應枸櫞酸蓄積的敏感指標。枸櫞酸蓄積可引起電解質及酸堿失衡,其中低鈣血癥、代謝性酸中毒可導致嚴重后果,而其大量代謝時產生的碳酸氫根又可引起代謝性堿中毒及高鈉血癥。故需要定時監測外周血的pH值、碳酸氫根及離子鈣濃度等指標。本研究中的枸櫞酸治療組的血氣指標證實,pH值及碳酸氫根較治療前升高,但仍在正常范圍內。且RCA組與對照組治療前、后鈣離子濃度無明顯差異(P>0.05)。因此,應用枸櫞酸抗凝能有效維持內環境的穩定,避免了酸堿失衡及電解質紊亂。
綜上,枸櫞酸抗凝技術比肝素抗凝更有優勢,證實了其在危重癥患者CRRT治療中有良好的抗凝效果,局部枸櫞酸抗凝效果優于全身肝素抗凝,且不增加出血危險,延長了濾器使用時間,減少了患者的住院費用。
楊楠等[7]在一項連續性血液凈化抗凝治療的Meta分析結果顯示:與肝素組相比,枸櫞酸鈉組患者感染率、出血率及病死率均降低,兩組比較差異有統計學意義(P<0.01)。然而王黎明等[8]在連續血液凈化治療常用抗凝劑比較的Meta分析顯示:枸櫞酸和肝素抗凝兩種抗凝方法對于患者生存率影響的結果尚無統一的結論。因此枸櫞酸鈉在血液凈化中的應用仍然具有很大的研究價值。

