電性規(guī)則在水解反應(yīng)教學中的應(yīng)用
韓萬中


摘要: 為提升教學效果,以幾個典型的水解反應(yīng)為例,介紹用陰陽配伍為核心的電性規(guī)則解讀水解反應(yīng)的方法,該方法有利于將無機鹽類、酯和鹵代烴的水解整合在一起去把握水解反應(yīng)的內(nèi)涵。電性規(guī)則可以作為一種通用法則,能預(yù)測水解反應(yīng)的產(chǎn)物,也能遷移應(yīng)用到物質(zhì)的氨解、醇解及酸解等反應(yīng)中。
關(guān)鍵詞: 水解反應(yīng); 電性規(guī)則; 陰陽配伍; 化學教學
文章編號: 1005-6629(2019)5-0085-04 ? ? ? ? ? ?中圖分類號: G633.8 ? ? ? ? ? ?文獻標識碼: B
1 ?問題的背景
人教版高中化學必修2教材中涉及二糖、多糖、蛋白質(zhì)的水解,在選修4重點介紹各種鹽類的水解以及應(yīng)用,選修5又出現(xiàn)酯、溴乙烷的水解。另外,選修5還出現(xiàn)了CaC2+2H2O→Ca(OH)2+HCCH↑等反應(yīng)。至此,在學生的頭腦中形成了幾類物質(zhì)在不同情境下能夠發(fā)生水解反應(yīng)的印象。對于這幾種典型的水解反應(yīng)的教學,教師一般都是“單獨處理”,沒有運用一種共性的思想方法將它們統(tǒng)攝在一起,學生對水解知識僅停留在死記硬背和碎片化的層級,這是當前有關(guān)水解反應(yīng)教學的現(xiàn)狀。
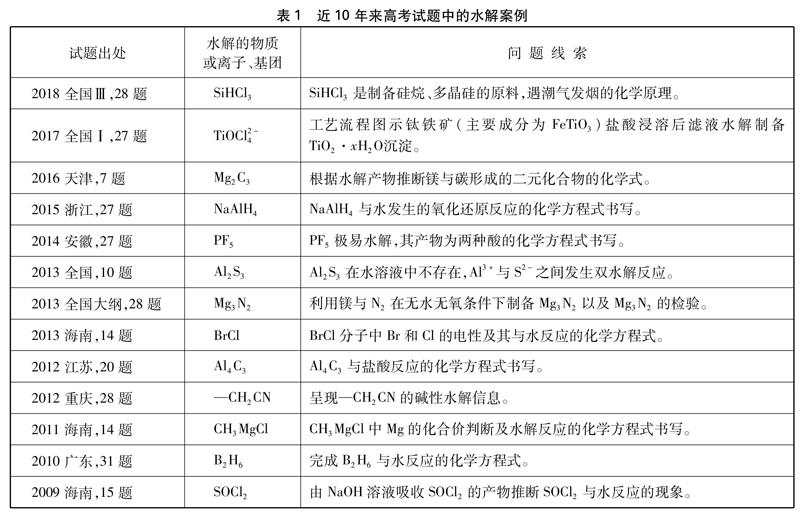
更為現(xiàn)實的問題是在一些模擬甚至高考試題中并不拘泥于教材,而是泛出許多“另類”的水解(見表1),學生感覺很亂、沒有抓手: 這個也叫水解嗎,水解反應(yīng)有規(guī)律嗎?……此時此刻,教師應(yīng)當對水解原理重新定位思考: 既然是水解,那么,物質(zhì)是靠什么力量“解”開的,水起什么作用?
表
人教版對于“鹽類的水解”是這樣定義的: 強酸弱堿鹽和強堿弱酸鹽溶于水時,電離產(chǎn)生的陽離子、陰離子分別與水電離產(chǎn)生的OH-或H+生成弱電解質(zhì)。聯(lián)系義務(wù)階段學過的復(fù)分解反應(yīng)中酸、堿或鹽“交換離子”的已有知識,教師只需將鹽類的水解的定義從離子的電性角度出發(fā),就能啟發(fā)學生悟出帶電粒子間的陰陽配伍是鹽類水解反應(yīng)的共性和靈魂;也可以發(fā)現(xiàn)有機物的水解等與熟悉的鹽類水解原理都是相通的。這有利于提高學生的知識遷移和變通能力,更有利于提升學生模型認知的素養(yǎng)水平。
2 ?問題的分析
觀察以下5個水解反應(yīng):
水是最常見的溶劑,本身也是一種電解質(zhì),可發(fā)生極微弱的電離: H2OH++OH-;或者說,由于成鍵原子的電負性不同,成鍵電子云發(fā)生偏移,使得H2O分子中的OH原子團帶部分負電荷,H原子帶部分正電荷,H2O分子可以異裂為正負兩個基團參與反應(yīng)。
對于反應(yīng)①和②,CH3COONa、 NH4Cl均為離子化合物,其電離出的陰、陽離子分別與水分子電離出的H+、OH-兩部分結(jié)合;對于反應(yīng)③,溴乙烷為共價化合物,分子中由于溴的電負性大于碳,所以C原子上的電子云密度較低,Br的電子云密度較高,在水溶液中存在水解平衡,CH3CH2Br+HOH ? ?δ+ ? ?δ- ? ?δ+ ? ?δ- ? ?△CH3CH2OH+HBr, NaOH的存在使水解平衡向右移動;反應(yīng)④存在水解與酯化的平衡狀態(tài): CH3CO ? ? ?δ+Oδ-CH2CH3+Hδ+OHδ-
H+△CH3COOH+HOCH2CH3 ?;反應(yīng)⑤中CaC2是離子化合物,電子式為Ca2+[∶CC∶]2-,其中的C2-2和Ca2+分別與水的正、負兩個基團結(jié)合成兩種新的物質(zhì)。
上述5個反應(yīng)中,①②是鹽的水解,③④是有機物的水解,⑤則是二元化合物的水解,無論是哪一個它們都遵循電性規(guī)則,也就是說帶相反電性的粒子“喜歡”結(jié)合在一起,通俗地說,這是自然界中一條最實在、最樸素的道理: 陰陽配伍。
其實,一些物質(zhì)水解機理是較復(fù)雜的,陰陽配伍只能看作一種“結(jié)果”。比如溴乙烷的水解,由于α碳原子上電子云密度較低,容易接受親核試劑帶有孤電子對的OH-進攻,α碳原子便與OH-中氧上的一對電子形成一個微弱的鍵(以虛線表示),與此同時,C—Br鍵被削弱,負電荷分散于親核試劑與離去基團上,這時體系能量最高,達到過渡態(tài)。當OH-與α碳原子進一步接近,最終形成一個穩(wěn)定的C—O鍵時,C—Br鍵便徹底斷裂,Br原子帶著一對共用電子對離開分子。這是溴乙烷水解的主要歷程[1],如圖1所示。非常明顯,親核反應(yīng)恰恰也是“遵守”電性規(guī)則的。
對比上述反應(yīng)機理,用電性規(guī)則解釋水解反應(yīng),有利于中學生的理解和接受,比較符合他們的認知水平。電性規(guī)則同氧化還原反應(yīng)原理、離子反應(yīng)原理、平衡移動原理、平衡常數(shù)思想、守恒思想、結(jié)構(gòu)決定性質(zhì)思想、條件控制思想一樣都是我們中學化學堅持的基本觀念[2]。
3 ?問題的落實
電性規(guī)則能預(yù)測水解反應(yīng)的產(chǎn)物,可以幫助學生克服死記硬背化學方程式的現(xiàn)象,提高學生分析化學反應(yīng)的能力。
理解以陰陽配伍為核心的電性規(guī)則并不困難,但形成自覺運用和思考相關(guān)化學反應(yīng)的意識和能力不是一蹴而就的,而是一個從物質(zhì)結(jié)構(gòu)出發(fā)拓展應(yīng)用并不斷強化認識和內(nèi)化的過程。
在高三總復(fù)習時,教師可從課本素材和學習的時間維度幫助學生建立電性規(guī)則。在義務(wù)教育階段出現(xiàn)的復(fù)分解反應(yīng),運用陰陽配伍原理理解,簡單易懂,可視為化學電性意識培養(yǎng)的起點;高一階段最早接觸到的金屬鈉是由金屬陽離子和自由電子構(gòu)成的金屬晶體,所以鈉和水反應(yīng)的“原動力”可視為陰陽配伍: 2Na++2Hδ+—Oδ-H2NaOH+H2↑;Na2O2與水的反應(yīng),分為兩步: Na2O2+2H2O2NaOH+H2O2, H2O2H2O+12O2↑,在第一步中Na2O2中的Na+和H2O電離出的OH-結(jié)合,O2-2與H2O電離出的H+結(jié)合形成H2O2, Na2O2投入水中不再產(chǎn)生氣泡后,再加入少量MnO2又有O2生成,證明H2O2的存在,從而說明了上述分析的合理性;氯氣和水反應(yīng),由于電子的高速運動,Cl2中也存在瞬時偶極Clδ-Clδ+,遂發(fā)生Clδ+Clδ-+Hδ+OHδ- ? ?HCl+HClO;進入高二,鹽類的水解、酯和鹵素原子的水解,前文已述;在原電池中,負極失去電子電勢升高,鹽橋中的陰離子向負極定向移動,正極得到電子,電勢降低,鹽橋中的陽離子向正極定向移動,也是電性規(guī)則的一種體現(xiàn),電解原理也同樣離不開電性規(guī)則的“控制”,常說的“陰極吸引陽離子、陽極吸引陰離子”就是這個道理。
4 ?問題的補充
電性規(guī)則只是一種規(guī)則,但不是問題的全部。有的物質(zhì)表面看起來符合電性規(guī)則,但基于物質(zhì)的微觀結(jié)構(gòu),可能并不支持水解反應(yīng)的進行。所以,教師在教學過程中不能將一個原理,或者一個規(guī)則絕對化、教條化。比如,軍事上常用的煙霧劑SiCl4正是由于其發(fā)生水解反應(yīng)生成HCl和H4SiO4的緣故,但與Si位于同一主族的C的化合物CCl4,既不溶于水,常溫下也不和水反應(yīng)。從熱力學計算表明,標準狀態(tài)下CCl4(l)+2H2O(l)CO2(g)+4HCl(aq) ?ΔrGθm=-377kJ·mol-1,似乎CCl4水解將會更徹底;但實際上,從動力學的觀點來看CCl4的水解是禁止的,這是因為C原子屬于第二周期,價電子層沒有d軌道。Si處于第三周期,在SiCl4中盡管Si的化合價已飽和了,但它由于有空的3d軌道可接納H2O中O原子上的孤電子對(最高配位數(shù)可達到6),同時“失去”HCl,反應(yīng)歷程如圖2所示[3]。
5 ?思維的進階
若把水看成是含H+、 OH-的物質(zhì),則含質(zhì)子的溶劑,如H—OC2H5、 H—NH2,以及含羥基的溶劑,如HO—NO2等,均能發(fā)生類似于水解的反應(yīng),分別稱作醇解、氨解和酸解等[4]。
例如,光氣在常溫下為無色氣體,化學性質(zhì)不穩(wěn)定,能發(fā)生如下反應(yīng):
在不同的溶劑中的反應(yīng),有許多共同性,也有許多特殊性,從非水溶液體系中可以制得許多在水溶液中很難得到或根本得不到的化合物。
參考文獻:
[1]汪小蘭. 有機化學(第四版)[M]. 北京: 高等教育出版社, 2005: 102.
[2]吳文中, 何淼, 陳越峰. 解讀“廣義水解”增強學生“電性效應(yīng)”的運用能力[J]. 化學教學, 2016, (2): 74~78.
[3][4]嚴宣申. 化學原理選講[M]. 北京: 北京大學出版社, 2012: 203.

