miR-21在非小細胞肺癌組織細胞中的表達變化及其在細胞增殖、凋亡中的作用
金文靜,顧文超,袁亞平,馮慧麗,王冬冬
(1 上海健康醫學院附屬浦東新區人民醫院,上海201200;2 上海市浦東醫院 復旦大學附屬浦東醫院)
非小細胞肺癌(NSCLC)是肺癌的常見類型,包括鱗癌、腺癌和大細胞肺癌。臨床上肺癌的治療多采用以手術為主,以放化療、生物治療、中藥治療等為輔的綜合治療,但其5年生存率仍較低[1,2]。微小核糖核酸(microRNA)是一類相對分子質量較小的非編碼RNA,因其不能編碼蛋白,曾被認為是基因組中的“廢料”或“垃圾”。近年研究發現,microRNA可調控多種基因的表達與功能,從而參與細胞的多種生物學過程[3]。microRNA-21(miR-21)定位于人類染色體17q23.2上,在多種惡性腫瘤的發生發展中具有促進作用,被認為是一種促癌基因[4,5]。目前,有關miR-21在NSCLC發病中的作用尚不明確,研究結果也存在一定差異。因此,本研究采用熒光定量PCR法檢測了miR-21在肺癌組織細胞中的表達變化,并觀察了抑制miR-21表達后肺癌細胞、增殖凋亡等生物學特性的變化,旨在探討其在NSCLC發病中的作用,為肺癌的診斷與治療提供新的標志物和靶點。
1 材料與方法
1.1 材料
1.1.1 組織標本和細胞 收集上海浦東新區人民醫院2017年1月1日~2018年12月31日收治56例NSCLC患者,選取其手術后存檔的病理組織標本。患者術前均未行放療、化療及生物治療等抗腫瘤治療,術中留取肺癌組織及癌旁組織(距離癌組織≥5 cm),術后均經病理學檢查確診。56例NSCLC患者中,男37例、女19例,年齡38~72歲,病理類型為鱗癌40例、腺癌16例,TNM分期Ⅰ~Ⅱ期38例、Ⅲ~Ⅳ期18例,組織分化程度為高分化20例、中分化25例、低分化11例,發生淋巴結轉移19例。本研究經醫院醫學倫理委員會批準,患者均簽署知情同意書。人NSCLC細胞A549、人正常肺上皮細胞BEAS-2B均購自中國醫學科學院上海細胞庫。
1.1.2 主要試劑和儀器 RPMI1640培養基購于美國Hyclone公司,胰蛋白酶購于上海生物工程有限公司,胎牛血清(FBS)購于杭州四季青生物有限公司;mRNA提取試劑盒購于美國Invitrogen公司,TRIzol Reagent、UItraSYBR Mixture均購于北京康為世紀生物科技公司,Rever Tra Ace qPCR RT Kit購于立陶宛MBI Fermentas公司,miRNA 1st Strand cDNA Synthesis Kit購于南京諾唯贊生物科技有限公司;引物序列:miR-21上游引物為5′-TAGCTTATCAGACTGATGTTGA-3′、下游引物為5′-CAGTGCAGGGTCCGAGGTAT-3′,內參照U6上游引物為5′-CAGCACATATACTAAAATTGGAACG-3′、下游引物為5′-ACGAATTTGCGTGTCATCC-3′,均由上海吉瑪公司設計并合成;LipofectamineTM2000購于美國Invitrogen公司,抑表達miR-21的反義序列(miR-21 inhibitors:5′-AAGGCAAGCUGACCCUGAAGU-3′)、無義序列(miR-21-NC:5′-GUCAACAUCAUCAGUCUGAUAAG-CUA-3′)由上海生工生物有限公司設計并合成;MTT檢測試劑盒購于美國Millipore 公司,流式細胞儀購于美國Becton Dickinson公司。
1.2 實驗方法
1.2.1 組織標本處理 取凍存的組織標本約50 mg,粉碎后按mRNA提取試劑盒說明書提取組織總mRNA。采用分光儀測定mRNA濃度,按照濃度稀釋配比后使用逆轉錄試劑盒逆轉錄。
1.2.2 細胞培養 將A549、BEAS-2B細胞接種于含10% FBS、谷氨酰胺2 mmol/L、青霉素/鏈霉素各100 U/mL的RPMI1640培養基中,置于37 ℃、5% CO2、100%濕度的細胞培養箱中培養。當細胞融合度≥90%時,用胰蛋白酶消化細胞,以1 000 r/min離心10 min后,去除酶消化液;用PBS重懸細胞后,再次離心后加細胞生長液。將細胞接種于細胞培養板中,置于37 ℃、5% CO2、100%濕度的細胞培養箱中繼續培養。
1.2.3 組織和細胞中miR-21檢測 采用熒光定量PCR法。收集培養24 h的A549、BEAS-2B細胞以及處理后的NSCLC組織和癌旁組織,以熒光定量PCR法檢測miR-21表達。用miRNA 1st Strand cDNA Synthesis Kit試劑盒合成cDNA,按照UltraSYBR Mixture PCR反應體系進行擴增。反應條件:95 ℃ 2 min,94 ℃ 20 s,53 ℃ 20 s,72 ℃ 30 s,共進行40個循環。以U6為內參照,采用2-ΔΔCt法計算miR-21相對表達量。
1.2.4 肺癌細胞分組與轉染 取對數生長期的A549細胞,用PBS調整細胞密度為4×104/mL,以1 mL/孔接種于24孔細胞培養板;細胞呈對數生長期后,將細胞分為抑制組、無義組和對照組。抑制組、無義組分別按照LipofectamineTM2000試劑盒說明書轉染miR-21 inhibitors、miR-21-NC,對照組不予轉染。將細胞繼續培養6 h 后,更換為含10% FBS的RPMI1640培養基,置于37 ℃、5% CO2、100%濕度細胞培養箱中繼續培養24 h。
1.2.5 細胞增殖情況觀察 采用MTT法。收集各組對數生長期細胞,用胰蛋白酶消化;完全培養基重懸后,以1.5×103/孔接種于96孔板,每組設6個復孔,共接種5張;置于37 ℃、5% CO2培養箱中培養5 d,從接種后第2天至培養終止前4 h,每孔加入濃度為5 g/L的MTT 10 μL,繼續培養4 h。去除培養液,每孔加二甲基亞砜100 μL終止反應,檢測波長為490 nm時的光密度(OD)。細胞增殖率=(OD實驗孔-OD對照孔)/OD對照孔×100%。
1.2.6 細胞凋亡情況觀察 采用流式細胞儀。取各組對數生長期細胞,加胰蛋白酶消化,用PBS調整細胞密度為2×106/mL。吸取細胞懸液1 mL置于離心管中,4 ℃下以1 000 r/min離心10 min,去除上清;加入預冷的PBS 1 mL 重懸細胞,離心后吸棄上清,PBS洗1次;加入Binding Buffer 200 μL 重懸細胞,加入PI和Annexin-V后充分混勻,避光室溫靜置20 min;加300 μL緩沖液,上流式細胞儀檢測凋亡細胞,計算細胞凋亡率。
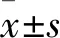
2 結果
2.1 NSCLC和癌旁組織中miR-21表達比較 NSCLC組織中miR-21表達量為2.98±0.99,高于癌旁組織中的1.04±0.32(P<0.01)。
2.2 A549、BEAS-2B細胞中miR-21表達比較 A549細胞中miR-21表達量為3.41±1.03,高于BEAS-2B細胞中的0.94±0.29(P<0.01)。
2.3 不同臨床病理特征NSCLC組織中miR-21表達比較 見表1。
2.4 各組A549細胞增殖率比較 抑制組、無義組、對照組細胞增殖率分別為74.32%±5.67%、95.81%±3.45%、96.43%±3.83%,抑制組細胞增殖率低于無義組和對照組(P均<0.05),無義組和對照組間細胞增殖率比較差異無統計學意義(P﹥0.05)。
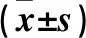
表1 不同臨床病理特征NSCLC組織中miR-21表達比較
2.5 各組A549細胞凋亡率比較 抑制組、無義組、對照組細胞增殖率分別為32.18%±5.21%、4.56%±2.19%、4.26±1.98%,抑制組細胞凋亡率高于無義組和對照組(P均<0.05),無義組和對照組間細胞凋亡率比較差異無統計學意義(P﹥0.05)。
3 討論
肺癌的發生與發展受多因子、多因素、多階段的控制,其中癌基因的激活和抑癌基因的失活或丟失是其發生的重要原因[6]。局部和遠處的轉移是NSCLC治療中的常見臨床問題,也是導致患者預后不良的最主要原因[7~9]。手術切除是目前NSCLC最主要的治療方法,針對多種目的基因進行靶向治療也能提高其治療效果[10]。但是,由于NSCLC的早期臨床癥狀多不明顯,確診時多已處于晚期,往往錯失手術治療的最佳時機。因此,尋找新的腫瘤標志物以及治療靶點,對于早期診治NSCLC具有重要意義。
microRNA是一類長度約為22個核苷酸的內源性非編碼單鏈小RNA,由細胞內源產生的發夾結構轉錄本加工而成。其主要與靶基因3′非編碼區(UTR)結合,通過在翻譯水平抑制或斷裂靶標mRNAs而調節基因的表達與功能,在細胞的增殖、分化、凋亡等生理過程中發揮重要作用,其表達異常參也與了腫瘤、動脈粥樣硬化等病理過程[11,12]。miR-21是microRNA家族重要的組成成員之一,由72個核苷酸莖環結構前體剪切加工而成。研究發現,其基因高度保守,位于蛋白質基因間隔,具備自主轉錄單位。與大多數microRNA不同,miR-21具有自己相對獨立的啟動子,其表達不受重疊蛋白編碼基因啟動子的調控,因此其在基因表達調節中可能起重要作用。miR-21廣泛表達于T細胞、B細胞、巨噬細胞、單核細胞及樹突狀細胞等免疫細胞,也可少量表達于造血細胞[13]。近年來,隨著對miR-21研究的深入,發現其在結腸癌、肝癌、胰腺癌、肺癌等多種惡性腫瘤組織中表達上調。本研究采用熒光定量PCR法檢測發現,NSCLC組織中miR-21的表達量高于癌旁組織,人NSCLC細胞A549中miR-21的表達量高于人正常肺上皮細胞BEAS-2B。這與以往研究[14,15]結果一致,提示miR-21可能在NSCLC的發病過程中具有促癌作用。本研究還發現,NSCLC組織中miR-21表達與患者的性別、年齡、病理類型及分化程度關系不大,差異均無統計學意義;而與TNM分期及淋巴結轉移有關,且TNM分期越低、有淋巴結轉移患者NSCLC組織中miR-21表達更高。因此,miR-21可作為診斷肺癌的腫瘤標志物和治療靶點進行深入研究。
為進一步明確miR-21在NSCLC發生發展中的作用,我們通過設計基因干擾序列以降低miR-21表達。結果發現,與無義組和對照組比較,抑制組細胞增殖率降低、細胞凋亡率升高;無義組和對照組之間細胞增殖率、細胞凋亡率差異無統計學意義。因此,miR-21在NSCLC的發生中發揮重要作用,同時也為臨床治療NSCLC提供了可靠的分子靶點。研究發現,miR-21表達受多種細胞內外信號分子的調控,如全反式維甲酸、粒細胞巨噬細胞集落刺激因子、脂多糖、白細胞介素4等可上調其表達;此外,在某些特定的細胞類型中,DNA甲基化修飾亦參與miR-21的表達調控。有研究顯示,卵巢癌OVCAR3細胞經DNA甲基化酶抑制劑處理后,細胞高表達miR-21[16]。因此,免疫監控失調以及各種炎性感染在NSCLC的發生中具有重要作用,應在提高患者免疫力的同時減少感染的發生。microRNA與靶基因3′UTR位點的結合無需完全配對,因此一個microRNA可調控多個靶基因。miR-21作為一種促癌microRNA,可通過調節下游多個抑癌基因以促進肺癌的發生與發展。另外,研究還發現,miR-21可通過靶向調控PTEN、PI3K、PDCD4、BTG2、FasL、TIMP3等多種基因表達,促進細胞增殖以誘發腫瘤;通過靶向調控PTEN、TIMP1和TIMP3等基因表達,促進新生血管形成、提高細胞的侵襲遷移能力,從而導致腫瘤的生長與轉移[17,18]。
綜上所述,在NSCLC組織和細胞中miR-21高表達,降低其表達可以抑制細胞增殖、促進細胞凋亡。miR-21在NSCLC的發病中具有重要作用,有望作為早期診斷肺癌及臨床治療的重要分子靶點。

