微波預處理-超聲波輔助提取紫山藥多糖及抑制α-葡萄糖苷酶活性研究
王彥平,陳月英,賈彥杰,曹婭,宿時,婁芳慧
(河南農(nóng)業(yè)職業(yè)學院食品工程學院,河南 鄭州 451450)
紫山藥多糖是紫山藥細胞壁的結構成分,具有抗氧化[1]、免疫調(diào)節(jié)[2]、抗衰老[3-4]、降糖[5]、耐缺氧[6]等多種生物活性。目前研究紫山藥多糖的提取方法主要集中在熱水浸提法[7]、超聲波提取法[8]、微波提取法[9]和生物酶法提取[10]等,其中熱水浸提法耗時長、溫度高、得率低、純度低,超聲波法提取時間短、得率高,但長時間作用會破壞多糖活性[11],微波法雖提取時間大為減少,但提取溫度難以控制,亦會破壞多糖活性。微波預處理-超聲波輔助提取法首先采用微波對經(jīng)水浸潤的物料粉進行0.5 min~3 min 微波預處理,利用微波的熱效應使生物細胞壁和細胞膜迅速破裂,然后進行20 min~60 min 超聲波提取,利用超聲波空化作用、機械作用和熱效應進一步破壞生物細胞壁結構,加快多糖釋放速度[12]。因此微波預處理-超聲波輔助提取法結合微波提取法和超聲波提取法的優(yōu)點,既能快速提取物料中的功能成分,也能避免微波或超聲波作用時間過長使多糖活性遭到破壞,是一種極具開發(fā)價值的提取技術,目前微波-超聲波輔助提取紫山藥多糖的方法尚未見報道。
目前糖尿病已經(jīng)成為嚴重威脅人類健康的疾病之一。Ⅱ型糖尿病的主要癥狀之一是餐后高血糖,α-葡萄糖苷酶抑制劑作為臨床上常用的口服降糖藥物能夠抑制小腸內(nèi)蔗糖、麥芽糖的水解從而降低餐后血糖[13]。而合成的α-葡萄糖苷酶抑制劑具有一定的毒副作用,因此從植物中篩選安全有效的天然α-葡萄糖苷酶抑制劑成為當下研究的熱點方向。
本文采用微波預處理-超聲波輔助提取紫山藥多糖,對其提取工藝進行優(yōu)化,并采用Sevag 法脫蛋白和醇沉后得紫山藥粗多糖,并對紫山藥多糖對α-葡萄糖苷酶的抑制能力進行研究,旨在為我國紫山藥活性物質(zhì)的綜合利用和規(guī)模化生產(chǎn)提供技術支撐和理論依據(jù)。
1 材料與方法
1.1 材料
紫山藥:產(chǎn)自廣西南寧。洗凈、瀝干、去皮、切片,于60 ℃烘干24 h,料理機粉碎后過50 目篩。干燥器中保存,備用。
阿卡波糖:合肥博美生物科技有限責任公司;4-硝基苯-α-D-吡楠葡萄糖苷(pNPG):Sigma-Aldrich 公司;α-葡萄糖苷酶(50 U/mg):上海源葉生物科技有限公司;乙醚、三氯甲烷、正丁醇、苯酚、濃硫酸、無水乙醇、葡萄糖、磷酸二氫鉀、磷酸氫二鉀、碳酸鈉等均為分析純:國藥集團化學試劑有限公司。
1.2 儀器
UV1901PCS 雙光束紫外可見光分光光度計:上海佑科儀器儀表有限公司;BS224S 分析天平:德國賽多利斯公司;HH-2 數(shù)顯恒溫水浴鍋:上海喬躍電子科技有限公司;D5-R2 離心機:湖南湘儀離心機儀器有限公司;RE2000 旋轉(zhuǎn)蒸發(fā)儀:上海亞榮生化儀器廠;202-3AB 電熱恒溫鼓風干燥箱:上海喬躍電子科技有限公司;SCIENTZ-ⅡDM 微波光波超聲波萃取儀:寧波新芝有限公司。
1.3 溶液配制
磷酸鹽緩沖溶液(phosphatebufferedsolution,PBS):稱取 7.80 g 磷酸二氫鉀(NaH2PO4·2H2O)和 17.90 g磷酸氫二鉀(Na2HPO4·2H2O),分別用蒸餾水溶解定容至250 mL,配制成0.2 mol/L 的母液,再按 NaH2PO4∶Na2HPO4=51∶49 的體積比配制成 pH6.8 的 0.2 mol/L的PBS 溶液。
α-葡萄糖苷酶溶液:取1 mg α-葡萄糖苷酶粉末,用pH 6.8 的PBS 溶液溶解定容至50 mL,配制成濃度為1 U/mL 的α-葡萄糖苷酶溶液。
4-硝基苯-Β-D-吡喃葡萄糖苷(4-Nitrophenyl-β-D- glucopyranoside,pNPG)溶液:稱取 30.13 mg pNPG粉末,用pH 6.8 的PBS 溶液溶解定容至100 mL,配制成濃度為10 mmol/L 的pNPG 溶液。
碳酸鈉溶液:稱取1.06 g 碳酸鈉粉末,用蒸餾水溶解定容至100 mL,配制成0.1 mol/L 的Na2CO3溶液。
阿卡波糖溶液:用pH 6.8 的PBS 溶液配制成不同濃度的阿卡波糖溶液。
紫山藥粗多糖溶液:將最佳工藝條件獲得的紫山藥粗多糖粉末,用pH 6.8 的PBS 溶液配制成不同濃度的多糖溶液。
1.4 試驗方法
1.4.1 葡萄糖標準曲線的繪制
采用苯酚-硫酸法[14],精密稱取一定量105 ℃烘干至恒重的葡萄糖,分別制得濃度為0、6.0、18.0、30.0、42.0、54.0 μg/mL 葡萄糖標準溶液,精確移取 2.0 mL 葡萄糖標準溶液至10 mL 容量瓶中,依次加入0.7 mL6%苯酚溶液和5.0 mL 濃硫酸,置沸水浴中顯色20 min,取出后至冷水中冷卻10 min,冷卻后去除靜置10 min,在488 nm 處測定其吸光度。以葡萄糖濃度(μg/mL)為橫坐標,吸光度為縱坐標繪制標準曲線。
1.4.2 紫山藥粉預處理
將紫山藥粉用乙醚90 ℃回流脫脂2 h,乙醚揮發(fā)完全后,置于恒溫箱60 ℃干燥至恒重。
1.4.3 多糖的提取工藝流程
預處理紫山藥粉與水按一定料液比混合,采用微波預處理后,在60 ℃下進行超聲波提取,將提取液離心(4 000 r/min,15 min)后取上清液。將上清液置于250 mL 具塞三角瓶中,按4∶1(體積比)比例加入Sevag(V三氯甲烷∶V正丁醇=4∶1)試劑[15],搖床震蕩 30 min,置分液漏斗中靜置分層,棄下層膠狀變性蛋白質(zhì)層,取上面水層離心(8 000 r/min,10 min)后取上清液,重復操作3 次。用旋轉(zhuǎn)蒸發(fā)儀低溫減壓將上述上清液濃縮后,加入無水乙醇至終濃度為75%,靜置醇沉18 h[16],離心(4 000 r/min,10 min)后棄上清液,收集得到粗多糖。
多糖得率/%=多糖質(zhì)量(g)/紫山藥粉質(zhì)量(g)×100
1.4.4 紫山藥粗多糖粉末中多糖質(zhì)量分數(shù)測定
紫山藥粗多糖粉末在恒溫箱60 ℃下干燥至恒重,精確稱取紫山藥多糖粉末20 mg,用水定容至250 mL做多糖儲備液。取多糖儲備液2.0 mL,按照1.4.1 中操作測吸光度。
多糖質(zhì)量分數(shù)/%=多糖質(zhì)量(g)/紫山藥多糖粉末質(zhì)量(g)×100
1.4.5 單因素試驗
微波預處理-超聲提取紫山藥多糖混合液,4 000 r/min 離心15 min 后取上清液得多糖粗提液,經(jīng)Sevag 法脫蛋白3 次后提取液,按照1.4.1 的方法測定粗提液的吸光度,并計算粗多糖得率。
1.4.5.1 料液比對粗多糖得率的影響
固定條件為微波功率300 W、微波時間30 s、超聲功率180 W、超聲時間20 min,設計料液比分別為1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)加入蒸餾水,考察不同料液比對粗多糖得率的影響。
1.4.5.2 微波功率對粗多糖得率的影響
固定條件為料液比 1∶30(g/mL)、微波時間 30 s、超聲功率180 W、超聲時間20 min,設計微波功率分別為 150、300、450、600、750 W 時預處理,考察微波功率對粗多糖得率的影響。
1.4.5.3 微波時間對粗多糖得率的影響
固定條件為料液比 1∶30(g/mL)、微波功率 300 W、超聲功率180 W、超聲時間20 min,設計微波時間分別為 10、20、30、40、50 s 預處理,考察微波時間對粗多糖得率的影響。
1.4.5.4 超聲功率對粗多糖得率的影響
固定條件為料液比 1∶30(g/mL)、微波功率 300 W、微波時間30 s、超聲時間20 min,設計超聲波提取功率分別為 90、180、270、360、450 W,考察超聲功率對粗多糖得率的影響。
1.4.5.5 超聲時間對粗多糖得率的影響
固定條件為料液比 1∶30(g/mL)、微波功率 300 W、微波時間30 s、超聲功率180 W,設計超聲波提取時間分別為 10、20、30、40、50 min,考察超聲時間對粗多糖得率的影響。
1.4.6 正交試驗
在單因素試驗基礎上,設計出四因素三水平L9(34)的正交試驗,見表1。
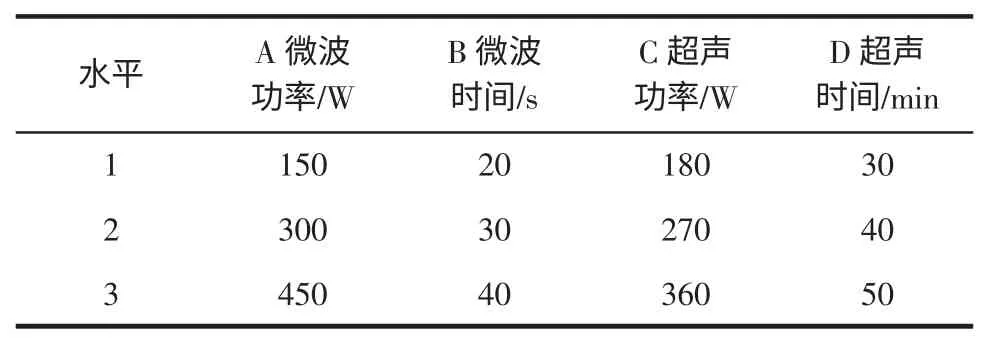
表1 正交試驗因素水平Table 1 Factors and levels of orthogonal experiment
微波預處理-超聲波輔助提取紫山藥多糖混合液,離心后取上清液,經(jīng)Sevag 法脫蛋白3 次后提取液,按照1.4.1 方法測定粗提液的吸光度,并計算紫山藥粗多糖得率,以確定微波預處理-超聲波輔助法提取紫山藥多糖的最佳工藝條件。
1.4.7 紫山藥多糖對α-葡萄糖苷酶的抑制作用
參考文獻[17]測定方法,用移液槍移取不同濃度的阿卡波糖溶液和紫山藥多糖溶液各40 μL 于酶標板中,再向各孔中加入40 μL α-葡萄糖苷酶溶液,混勻后 37 ℃反應 10 min,取出后加入 30 μL pNPG 溶液,混勻后37 ℃反應30 min,取出后加入90 μL 碳酸鈉溶液,終止反應。用酶標儀測定405 nm 處吸光值A,同時設立空白組和背景組,計算抑制率。
抑制率/%=[A空白-(A樣品-A背景)]/A空白×100
式中:A空白為 PBS(40 μL)+α-葡萄糖苷酶(40 μL)+pNPG(30 μL)+碳酸鈉(90 μL)條件下測得的吸光值;A樣品為多糖溶液(40 μL)+ α-葡萄糖苷酶(40 μL)+pNPG(30 μL)+碳酸鈉(90 μL)條件下測得的吸光值;A背景為多糖溶液(40 μL)+PBS(40 μL)+pNPG(30 μL)+碳酸鈉(90 μL)條件下測得的吸光值。
1.5 數(shù)據(jù)處理
采用excel 2007 進行試驗數(shù)據(jù)處理及圖表制作。
2 結果與分析
2.1 紫山藥標準曲線
按照“1.4.1”進行操作,結果顯示葡萄糖標準溶液濃度與吸光度的線性回歸方程為:Y=0.016 4x+0.013 8,R2=0.999,表明在 0~54 μg/mL 范圍內(nèi)葡萄糖的濃度與吸光度呈良好的線性關系。葡萄糖標準曲線見圖1。
2.2 紫山藥多糖提取的單因素試驗
2.2.1 料液比對粗多糖得率的影響
料液比對粗多糖得率的影響見圖2。
由圖2可知,當料液比由 1∶10(g/mL)降低到1∶40(g/mL)時,紫山藥粗多糖得率快速升高,在料液比為 1∶40(g/mL)達到最大值,說明一定范圍內(nèi),料液比越小即水越多,越有利于多糖的溶出;但當水過多時可能會影響超聲波的空化效應和機械振動的效果,多糖得率反而下降[18]。故選擇料液比為1∶40(g/mL)較為適宜。
2.2.2 微波功率對紫山藥粗多糖得率的影響
微波功率對紫山藥粗多糖得率的影響見圖3。
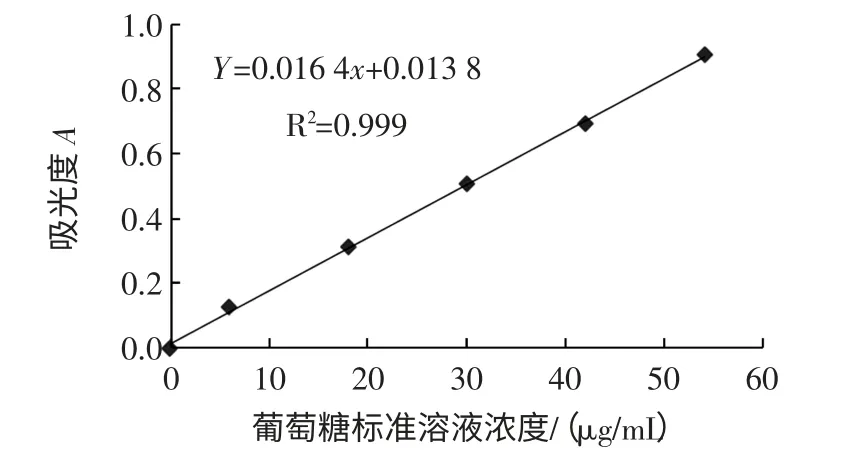
圖1 葡萄糖標準曲線Fig.1 Standard curve of glucose
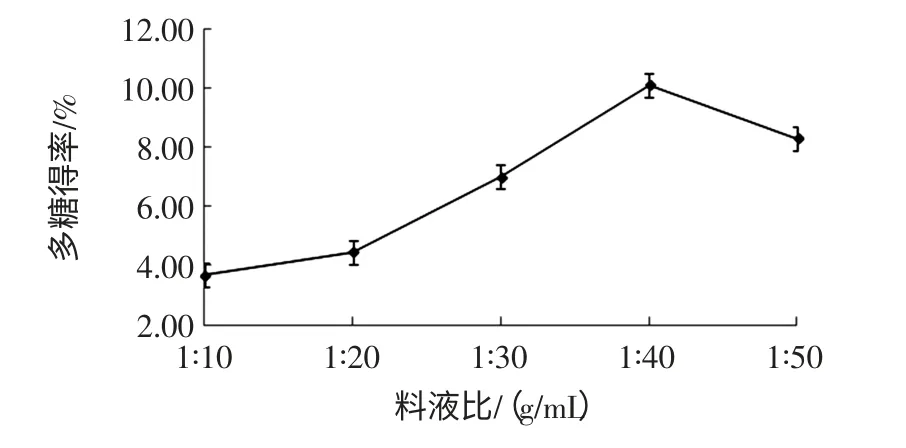
圖2 料液比對粗多糖得率的影響Fig.2 Effect of water-material ratio on polysaccharide yield
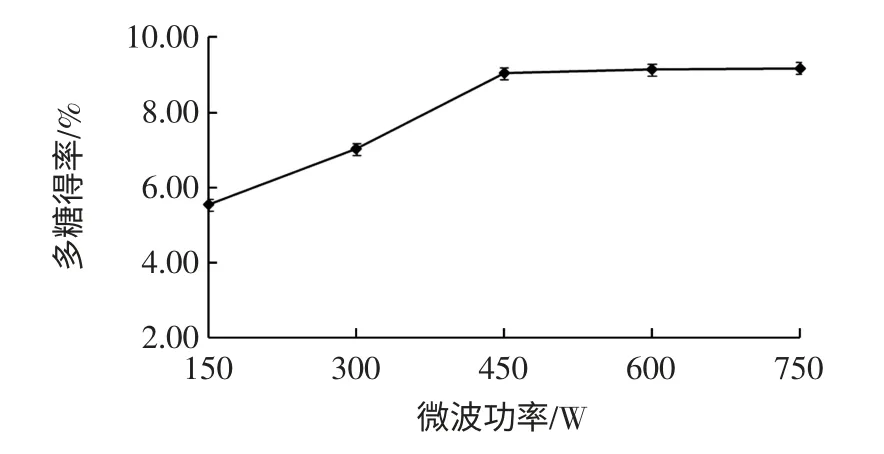
圖3 微波功率對粗多糖得率的影響Fig.3 Effect of microwave power on polysaccharide yield
由圖3可知,隨著微波功率的提高,紫山藥粗多糖得率緩緩上升,當微波功率達到450 W 后,粗多糖得率趨于平穩(wěn)。可能是由于微波可使紫山藥細胞壁遭到破壞,有利于多糖溶出,隨著微波功率的增大,溫度升高,部分多糖發(fā)生水解[19]。微波功率達到450 W 后,粗多糖得率趨于平穩(wěn),考慮能源消耗,選擇微波功率150、300、450 W3 個水平進行優(yōu)化試驗。
2.2.3 微波時間對粗多糖得率的影響
微波時間對粗多糖得率的影響見圖4。
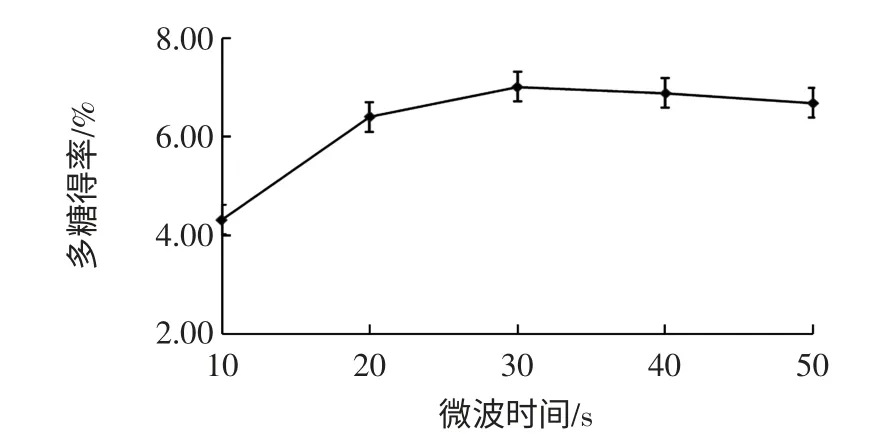
圖4 微波時間對粗多糖得率的影響Fig.4 Effect of microwave time on polysaccharide yield
由圖4可知,隨著微波預處理時間的延長,紫山藥粗多糖得率呈現(xiàn)向上升后下降的趨勢,微波預處理時間達到30 s 時得率最高。可能是由于在一定的范圍內(nèi),隨著微波時間的延長,紫山藥細胞破裂,多糖溶出增多,但過長的微波預處理時間可能會使部分多糖水解。微波預處理時間達到30 s 時得率最高,選擇微波預處理時間20、30、40 s 3 個水平進行優(yōu)化試驗。
2.2.4 超聲功率對粗多糖得率的影響
超聲功率對粗多糖得率的影響見圖5。
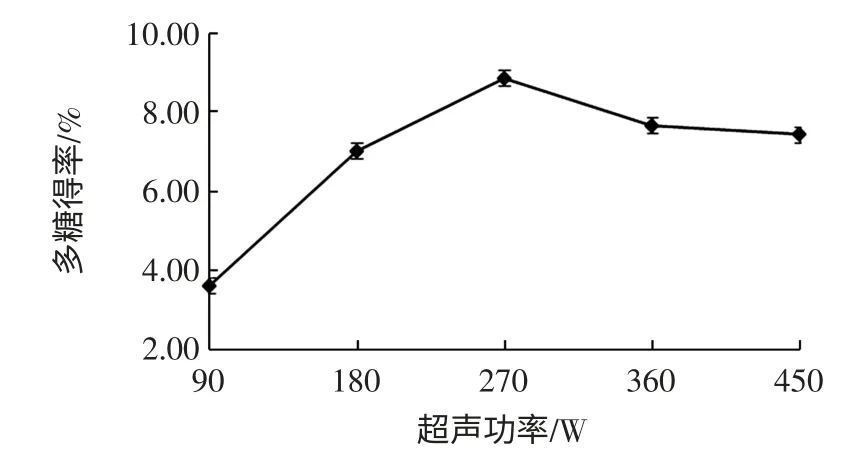
圖5 超聲功率對粗多糖得率的影響Fig.5 Effect of ultrasonic power on polysaccharide yield
由圖5可知,當超聲功率低于270 W 時,隨著超聲功率的增加,紫山藥粗多糖得率逐漸升高,但超聲功率超過270 W 后,粗多糖得率反而下降,可能由于超聲波具有較強的剪切作用,功率過高會導致多糖化學鍵斷裂,進而影響紫山藥粗多糖得率[20]。超聲功率為270 W 時,紫山藥得率最高,選擇超聲波提取功率為180、270、360 W 3 個水平進行優(yōu)化試驗。
2.2.5 超聲時間對粗多糖得率的影響
超聲時間對粗多糖得率的影響見圖6。
由圖6可知,超聲波提取時間低于40 min 時,隨著提取時間的延長,紫山藥粗多糖得率逐漸升高,當達到40 min 后紫山藥粗多糖得率趨于平穩(wěn),可能由于此時細胞壁的破壞趨于完全[20]。超聲時間為50 min 時,紫山藥的得率最高,考慮到能源消耗,選擇超聲波提取時間為30、40、50 min3 個水平進行正交試驗。
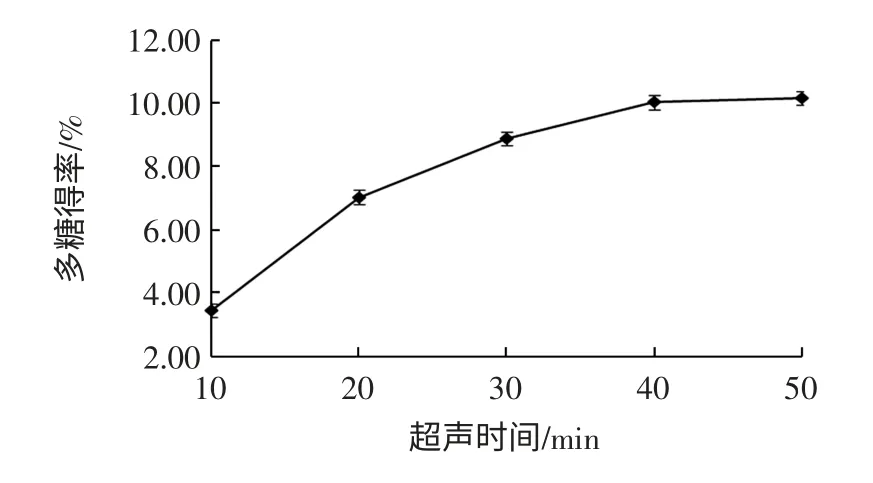
圖6 超聲時間對粗多糖得率的影響Fig.6 Effect of ultrasonic time on polysaccharide yield
2.3 紫山藥多糖提取的正交試驗
紫山藥多糖提取的正交試驗結果見表2。
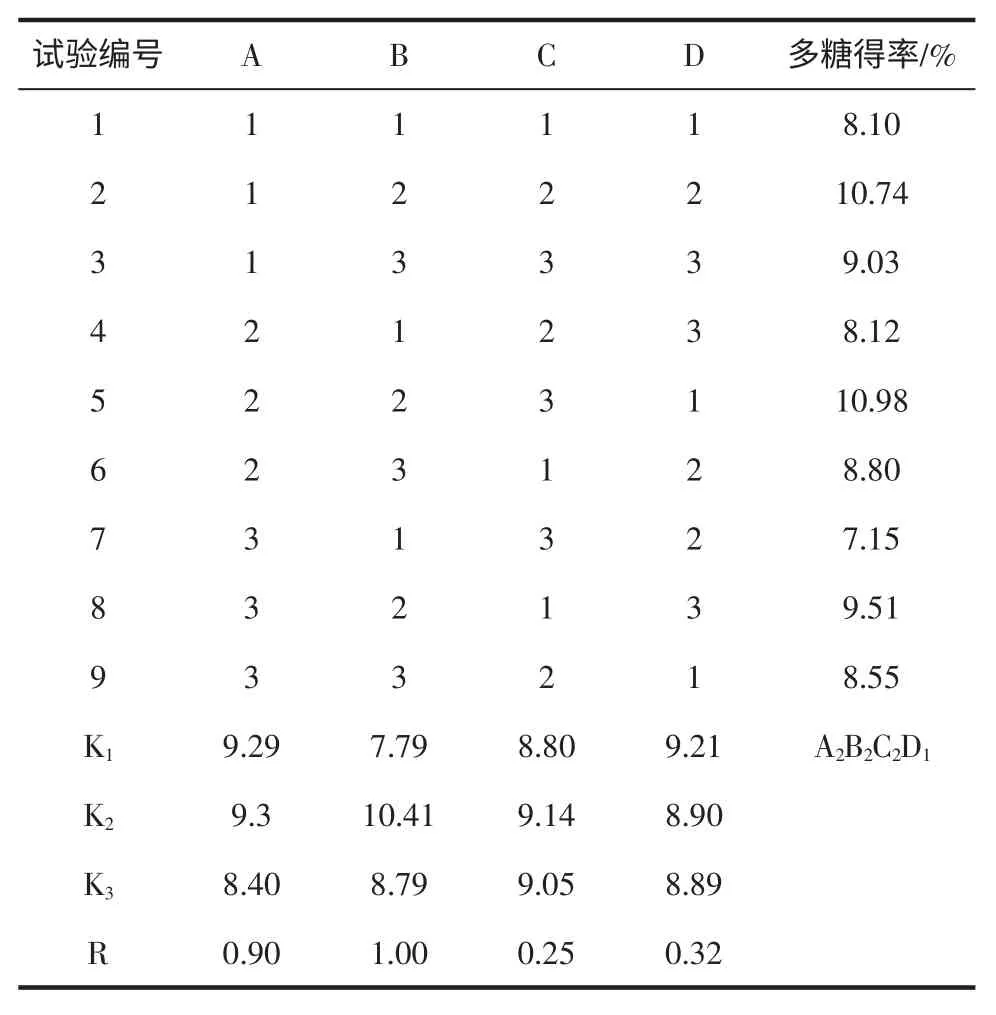
表2 紫山藥粗多糖提取的正交試驗結果Table 2 The results of orthogonal test of extraction of purple yam diosgenin
正交試驗結果分析表明,紫山藥粗多糖微波預處理-超聲波提取方法中各因素重要性的順序為B>A>D>C,即微波時間>微波功率>超聲時間>超聲功率。最佳提取工藝為A2B2C2D1,即微波功率300 W、微波時間30 s、超聲功率270 W、超聲時間30 min。按最佳工藝條件提取紫山藥多糖,平行3 次,紫山藥粗多糖的平均得率為(11.12±1.06)%,高于正交試驗中的最大值。醇沉后的紫山藥多糖粉末的多糖質(zhì)量分數(shù)為45.80%。
2.4 紫山藥多糖對α-葡萄糖苷酶的抑制作用
紫山藥多糖對α-葡萄糖苷酶的抑制作用見圖7。
由圖7可知,隨著阿卡波糖濃度的增加,對α-葡萄糖苷酶的抑制率明顯增強;紫山藥粗多糖對α-葡萄糖苷酶的抑制率與質(zhì)量濃度之間也呈良好的對數(shù)關系。阿卡波糖的曲線方程為:Y=12.323ln(x)+119.89(R2=0.993 4),IC50=0.003 4(mg/mL)。紫山藥多糖的曲線方差為:Y=11.725ln(x)+82.797(R2=0.985 5),IC50=0.061 0(mg/mL)。結果顯示紫山藥粗多糖對α-葡萄糖苷酶具有一定的抑制作用,相同質(zhì)量濃度下,紫山藥多糖對α-葡萄糖苷酶的抑制作用較阿卡波糖弱(p<0.01)。
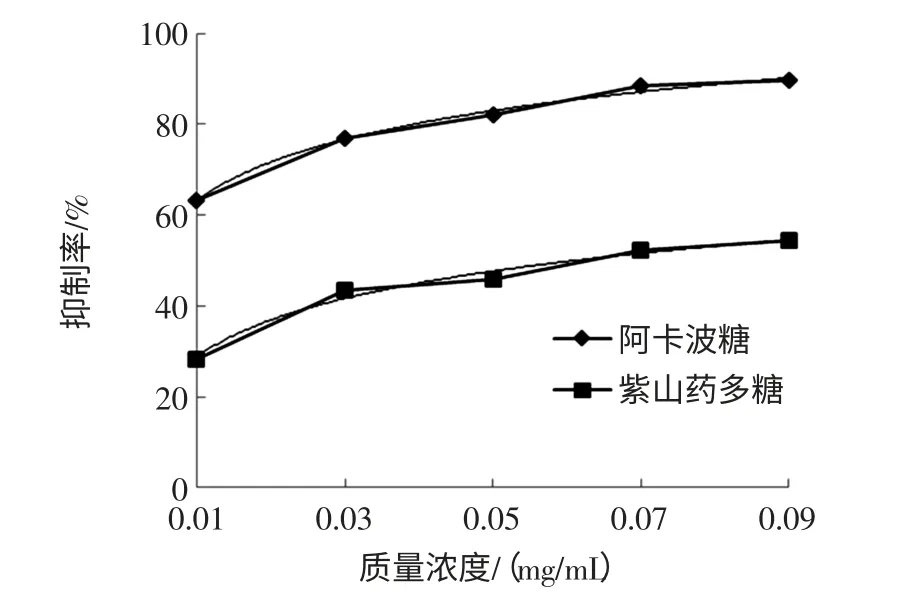
圖7 紫山藥多糖溶液濃度對α-葡萄糖苷酶活性的影響Fig.7 Effect of purple yam polysaccharide solution concentration on α-glucosinase activity
3 討論
本研究用微波預處理-超聲波輔助提取法從紫山藥中提取多糖,其最優(yōu)化工藝條件為為料液比1∶40(g/mL)、微波功率300 W、微波時間30 s、超聲功率270 W、超聲時間30 min。在最佳工藝條件下,紫山藥多糖平均得率為(11.12±1.06)%,多糖得率高于超聲提取法[8]。該工藝方法可縮短提取時間、提高多糖得率、節(jié)省提取劑、降低生產(chǎn)成本、多糖活性良好。
阿卡波糖或米格列醇的類似物對α-葡萄糖苷酶活性的抑制作用已經(jīng)被應用在臨床,用于糖尿病的治療,可有效抑制小腸內(nèi)蔗糖、麥芽糖等水解為葡萄糖,從而降低餐后血糖。目前已從多種常見植物中分離制備出多糖用于抑制α-葡萄糖苷酶的研究[21]。宋曙輝等[5]動物實驗結果表明,紫山藥具有降低大鼠血糖的作用。杭悅宇[2]藥理試驗結果表明,包括紫山藥在內(nèi)的多種山藥水提液具有明顯的降血糖作用。本研究通過α-葡萄糖苷酶活性體外抑制試驗發(fā)現(xiàn),在相同質(zhì)量濃度下,紫山藥多糖對α-葡萄糖苷酶的抑制能力較阿卡波糖弱,但也表現(xiàn)出明顯的抑制活性。紫山藥多糖在試驗濃度下,濃度與α-葡萄糖苷酶清除率呈現(xiàn)良好的量效關系,即濃度越高抑制能力越強。綜上所述,紫山藥多糖具有一定的體外降糖活性,其體內(nèi)外降糖活性及機理還有待進一步研究。

