牡丹花蕾提取物對銅綠假單胞菌的抑菌活性及其機理
周云冬,章漪玲,宗紅,陸信曜,諸葛斌,沈微
1(工業生物技術教育部重點實驗室(江南大學),江蘇 無錫,214122)2(江南大學 生物工程學院,工業微生物研究中心,江蘇 無錫,214122)3(江南大學,中國高校工業微生物資源和信息中心,江蘇 無錫,214122)
近年來,由于食用或飲用被食源性致病菌污染了的食品或飲品引起的疾病頻發,食品安全受到國際社會越來越多的重視,成為公眾所關心的熱點[1]。餐飲食品是導致各類食物中毒和食源性疾病發生的主要來源,其中導致水產品、肉類及涼拌即食食品腐敗變質的是革蘭氏陰性銅綠假單胞菌(Pseudomonasaeruginosa)[2-4]。同時,銅綠假單胞菌也是一種機會致病菌,是引起免疫力低下患者慢性感染的常見病原體[5];常會引起呼吸系統感染,尿路感染,腸道傳染病感染,傷口形成綠色膿液等[6-7]。銅綠假單胞菌已成為危害人類健康的重要污染源之一。
牡丹(PaeoniasuffruticosaAndr.,PSABE)除了其根皮(牡丹皮)是一種重要的中藥外,牡丹花也有重要的食用和藥用價值,具有清熱解毒、活血等功效[8]。目前,國內外研究表明,牡丹花中含有沒食子酸、芍藥苷、山奈酚3,7-二-O-葡萄糖苷、1,2,3,4,6-O-五沒食子酰基葡萄糖等有效成分,具有較強的抗腫瘤、清除自由基,抗氧化等活性[9-11]。然而迄今為止,牡丹花抑菌活性方面的研究報道甚少,關于牡丹花的抑菌機理尚未見報道。因此,本研究以銅綠假單胞菌為試驗菌,探究牡丹花蕾提取物對銅綠假單胞菌的抑菌活性及其抑菌機理,以期為牡丹花蕾提取物應用于水產品及肉類等食品保鮮提供理論依據。
1 材料與方法
1.1 材料與試劑
P.aeruginosaATCC 27853,本研究室保藏。
牡丹花蕾,無錫市中藥店;N-苯基-1-萘胺(NPN)、14%三氟化硼甲醇溶液,Alaladin;KOH、NaCl、無水Na2SO4、甲醇、正己烷、戊二醛、無水乙醇,為國產分析純。
1.2 儀器與設備
DHG-9075A電恒溫鼓風干燥箱,上海精宏實驗設備有限公司;R220E真空旋轉蒸發儀,瑞士步琦工業有限公司;12Plus低溫冷凍干燥機,美國Labconco公司;synergy H4多功能酶標儀,美國伯騰儀器有限公司;Thermos-21R高速冷凍離心機,上海滬粵明科學儀器有限公司;F-7 000熒光分光光度計,日本Hitachi公司;TSQ8000三重四級桿氣質聯用儀,美國賽默飛世爾科技有限公司;SU8220冷場發射掃描電子顯微鏡,日本Hitachi公司。
1.3 方法
1.3.1 牡丹花蕾提取物制備
牡丹花蕾去除表面損傷和微生物污染部分,在60 ℃下烘干至恒重,研磨成細粉。在體積分數70%乙醇、60 ℃、料液比1∶20(g∶mL)的條件下浸提2 h,真空過濾收集濾液,重復2次。40 ℃真空旋轉蒸發濃縮,將濃縮物在4 ℃靜置24 h,上清液使用低溫冷凍干燥機干燥得干粉,置于4 ℃密封儲存。
1.3.2 最低抑制濃度和最低殺死濃度測定
參照微量稀釋法[12],在無菌96孔平底微量培養板中,取100 μL稀釋的牡丹花蕾提取物(終濃度100、50、25、12.5、6.25、3.12、1.56、0.78和0 mg/mL)與菌體濃度為1×108CFU/mL細菌懸浮液混合,37 ℃培養24 h后,于600 nm處檢測光密度。光密度變化值<0.05,認為是抑制菌體生長的最低濃度,并被定義為最低抑制濃度(minimum inhibition concentration, MIC)。從大于最低抑制濃度的孔中吸取100 μL細菌懸浮液均勻涂布于新鮮LB瓊脂平板上,37 ℃傳代培養24 h后,以每個平板菌落數少于5個定義為最低殺死濃度(minimum bactericide concentration, MBC)。
1.3.3 抑菌圈及抑菌活性穩定性研究
將100 mg/mL的牡丹花蕾提取物用濃度為0.1 mol/L NaOH和HCl溶液調成 9個pH值梯度: 2.0、3.0、4.0、5.0、6.0、7. 0、8.0、9.0、10.0;100 mg/mL牡丹花蕾提取物分別在20、40、60、80、100 ℃下30 min,用瓊脂濾紙片擴散法[13]測定抑菌效果。將100 μL菌體濃度為1×108CFU/mL細菌懸浮液均勻涂布于LB瓊脂培養基表面,待表面稍干后將浸漬了10 μL牡丹花蕾提取物(相當于1 mg劑量)的6 mm無菌濾紙圓盤貼于最上層,以無菌生理鹽水作為陰性對照,每個組3個平行,37 ℃培養24 h后,通過測量抑制區直徑(diameter of the inhibition zone, DIZ)評估pH值和溫度對牡丹花蕾提取物抑菌活性的影響。
1.3.4 生長曲線測定
參照WU等[14]方法稍作修改。將培養至對數中期的銅綠假單胞菌轉接到含不同濃度(終濃度分別為1/8MIC,1/4MIC,1/2MIC,MIC和MBC)牡丹花蕾提取物的LB液體培養基中,置于37 ℃條件下培養,每隔2 h測定OD600的光密度。
1.3.5 細胞膜脂肪酸分析
將銅綠假單胞菌培養至對數期中后期,加入牡丹花蕾提取物(終濃度為MIC和MBC),以無菌生理鹽水作為對照;在37 ℃孵育3 h后,4 ℃ 4 000×g離心15 min,收集細胞,用PBS洗滌2次后待用。根據HUANG等[15]的方法進行脂肪酸甲酯化反應,氣相色譜-質譜(GC-MS)鑒定膜脂肪酸。色譜條件:TG-5石英毛細管柱(30 m×0.25 mm,0.25 μm),升溫程序:初始溫度為50 ℃,保持1 min,以10 ℃/min升溫至200 ℃,再以3 ℃/min升溫至250 ℃,最后以10 ℃/min升溫至280 ℃、保持8 min;載氣(He)流速為2.0 mL/min,進樣口溫度為220 ℃;進樣量為1 μL;分流比為5∶1。質譜條件:電子轟擊離子源;電子能量70 eV;離子源溫度230 ℃;四級桿溫度150 ℃;接口溫度280 ℃;質量掃描范圍m/z29~450。
1.3.6 對細胞膜膜蛋白影響
銅綠假單胞菌細胞膜蛋白的熒光光譜測定參照WANG等[16]的方法并稍有修改,在1×108CFU/mL的細胞懸浮液中加入不同濃度的KI(終濃度分別為0、0.5×10-2、1.0×10-2、1.5×10-2、2.0×10-2、2.5×10-2、3.0×10-2mol/L)和牡丹花蕾提取物(終濃度分別為0、1/64MIC、1/32MIC、1/16MIC、1/8MIC、1/4MIC、1/2MIC、MIC、MBC),25 ℃溫育1 h,258、280和296 nm的固定激發波長下記錄細菌樣品的發射光譜。
1.3.7 細胞膜通透性測定
參照NING等[17]方法稍作修改,將不同濃度牡丹花蕾提取物(1/8MIC,1/4MIC,1/2MIC,MIC和MBC)加入菌體濃度為1×108CFU/mL的細胞懸液中,37 ℃溫育1 h。在4 ℃下4 000×g離心15 min收集細胞,用PBS洗滌2次并調節菌體濃度為1×108CFU/mL,加入N-苯基-1-萘胺(NPN),使NPN終濃度為0.1 mol/L,用熒光分光光度計測定隨時間變化的熒光強度,直到強度不再變化。熒光光度計儀器參數設置為:激發光波長350 nm,發射光波長420 nm,縫隙寬度5 mm,電壓500 mV。
1.3.8 掃描電鏡觀察
參考SHI等[18]的方法觀察細胞形態變化。
2 結果與分析
2.1 牡丹花蕾提取物對銅綠假單胞菌的抑菌活性及其穩定性
牡丹花蕾提取物對銅綠假單胞菌的DIZ、MIC及MBC分別為(15.71±0.25)mm,3.13和6.25 mg/mL;提取物對銅綠假單胞菌抑菌活性的pH值和溫度穩定性如圖1所示。由圖1-A可以看出,在常溫下pH 2.0~7. 0,牡丹花蕾提取物具有較好的穩定性,抑菌圈直徑在15.42~16.02 mm,在弱堿(pH 8.0~10.0)條件下抑菌活性稍有下降, pH為10.0時,抑菌圈直徑為自然條件(pH 4.5)的93.04%。由圖1-B可知,牡丹花蕾提取物(自然pH)經較低溫度(20~60 ℃)處理30 min后,抑菌活性較穩定,抑菌圈直徑處于15.73~15.88 mm;當溫度>80 ℃,抑菌圈直徑略有變小,100 ℃時降至最高值的 88.77%。結果表明,牡丹花蕾提取物對pH值和溫度不敏感,具有較好的穩定性。

圖1 牡丹花蕾提取物對銅綠假單胞菌抑菌活性pH(A)和溫度(B)穩定性Fig.1 Stability of antibacterial activity of P. suffruticosa extract under different pH (A) and temperature (B)
2.2 牡丹花蕾提取物對銅綠假單胞菌細胞生長影響
如圖2所示,在LB培養基中加入濃度為1/8MIC和1/4MIC的牡丹花蕾提取物,銅綠假單胞菌細胞的生長基本不受影響。但當添加濃度為MIC的牡丹花蕾提取物,銅綠假單胞菌細胞的生長受到顯著抑制,與對照相比,延滯期延長,且最終的菌體量僅為對照的12%。此外,當添加濃度為MBC時,細胞生長被完全抑制,導致細胞死亡。
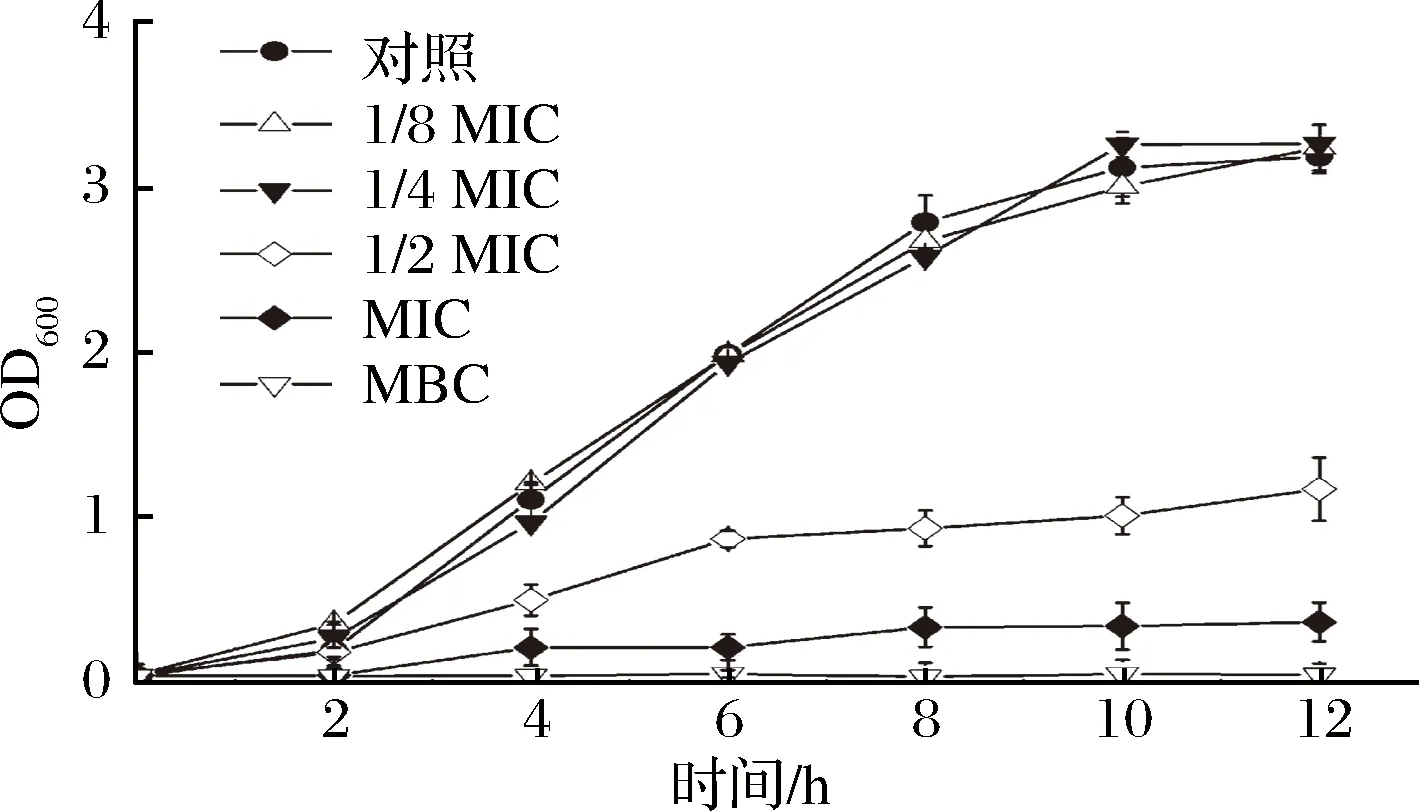
圖2 不同濃度牡丹花蕾提取物下銅綠假單胞菌細胞生長曲線Fig.2 Growth curves of P. aeruginosa under different concentrations of P. suffruticosa Andr. buds extract
2.3 銅綠假單胞菌細胞膜脂肪酸組成和含量變化
不同濃度牡丹花蕾提取物下對銅綠假單胞菌細胞膜脂肪酸組成和含量變化如圖3所示,細胞膜脂肪酸分為飽和脂肪酸(saturated fatty acids, SFAs),單不飽和脂肪酸(monounsaturated fatty acids, MUFAs),多不飽和脂肪酸(polyunsaturated fatty acids, PUFAs)。從圖3-A可以看出,在提取物0、MIC和MBC濃度下飽和脂肪酸的相對含量分別為43.73%、46.38%和47.11%,呈上升趨勢;單不飽和脂肪酸的相對含量分別為56.27%、53.36%和52.38%,呈下降趨勢。

圖3 牡丹花蕾提取物不同濃度下銅綠假單胞菌細胞膜脂肪酸變化Fig.3 The changes of cell membrane fatty acid of P. aeruginosa cells under different concentrations of P. suffruticosa buds extract
即在MIC和MBC濃度下,飽和脂肪酸相對含量分別提高了6.06%和8.19%,而單不飽和脂肪酸相對含量分別降低了5.17%和6.91%。這種變化主要是由于十六烷酸(C16∶0)和十八烷酸(C18∶0)相對含量增加,如圖3-B所示,在MBC濃度下,C16∶0和C18∶0的相對含量分別從33.31%、1.79%增加到36.89%、2.10%;相反的,單不飽和脂肪酸包括(Z)-9-十六碳烯酸(C16:1ω9(c))、順式-10-十七碳烯酸(C17∶1ω10(c))、(Z)-9-十八碳烯酸(C18∶1ω9(c))和順-10-十九碳烯酸(C19∶1ω10(c)),相對含量分別從13.08%、2.70%、36.93%和3.56%下降到11.78%、1.92%、35.89%和2.78%。膜的流體性質與膜脂肪酸的組成和比例有關[19]。通常,低熔點脂肪酸(單不飽和脂肪酸) 增加膜流動性,而高熔點脂肪酸(飽和脂肪酸)降低膜流動性[20]。結果表明飽和脂肪酸相對含量增加,單不飽和脂肪相對含量降低,這種改變導致細胞膜剛性增加,膜流動性降低,細胞形態和功能發生變化,容易引起細胞死亡。另一方面,細胞膜脂肪酸不飽和程度也可在一定程度影響銅綠假單胞菌的群集運動能力[21]。因此,細胞膜脂肪酸組成的改變導致細胞膜脂肪酸不飽和程度下降,這可能在一定程度上影響了銅綠假單胞菌生物膜的形成,降低了細胞膜的流動性,從而影響了群集運動能力,降低了其感染能力。
2.4 銅綠假單胞菌膜蛋白的結構和構象改變
膜蛋白是細胞膜中最重要的組成部分之一,它具有多種細胞功能,包括受體結合、信號傳遞、擴散、膜結合酶活性以及細胞與細胞間的通訊[22]。膜蛋白中含有苯丙氨酸(Phe)、色氨酸(Trp)和酪氨酸(Tyr)等氨基酸,可以在膜蛋白中發出熒光。KI是一種熒光猝滅劑,只猝滅膜蛋白表面殘留的熒光,不能影響位于膜蛋白內部或縫隙中殘基的熒光光譜,因此,可以定性地確定Phe、Tyr和Tyr殘基在蛋白質中的位置[23-24]。圖4-A、圖4-B和圖4-C分別顯示了KI在258、280和296 nm的固定激發波長對Phe、Trp和Tyr殘基的熒光發射光譜的影響,隨著KI的增加,Phe的熒光強度顯著下降,Trp和Tyr殘基的熒光猝滅效果不明顯,表明Phe的殘留主要位于膜外,而Trp和Tyr的殘基主要位于膜內。從圖5可以看出,在不同濃度牡丹花蕾提取物下,Phe、Trp和Tyr殘基的最大發射強度逐漸降低,并伴隨著明顯的紅移,這些結果表明牡丹花蕾提取物與膜蛋白結合,改變了細胞膜膜蛋白的結構和構象,使Phe、Trp和Tyr殘基變得更加親水,導致細胞膜功能障礙和細胞損傷。

圖4 不同濃度KI下銅綠假單胞菌膜蛋白氨基酸殘基苯丙氨酸(A),色氨酸(B)和酪氨酸(C)熒光光譜Fig.4 Fluorescence spectra of amino acid residues Phe(A),Trp(B) and Tyr(C) of P. aeruginosa membrane proteins

圖5 不同濃度牡丹花蕾提取物下銅綠假單胞菌膜蛋白氨基酸殘基苯丙氨酸(A),色氨酸(B)和酪氨酸(C)熒光光譜Fig.5 Fluorescence spectra of amino acid residues Phe(A),Trp(B) and Tyr(C) of P. aeruginosa membrane proteins at the different concentrations of P. suffruticosa buds extract
2.5 銅綠假單胞菌細胞外膜的通透性
革蘭氏陰性菌由內膜和外膜兩層膜包被,完整的外膜是滲透性屏障,不包括疏水性熒光探針,如N-苯基-1-萘胺(NPN),在水環境中發出微弱的熒光,一旦受損,它就可以進入細胞外膜的疏水性環境(膜內部磷脂層),產生明顯的熒光[25-26]。因此,銅綠假單胞菌細胞對NPN的攝取能力反映了牡丹花蕾提取物作用下細胞外膜通透性變化。如圖6顯示,在低濃度1/8MIC,1/4MIC和1/2MIC處理下,NPN熒光吸收值顯著升高,說明細胞外膜通透性明顯增大,當濃度達到1/2MIC,細胞外膜通透性最大。在MBC處理后,NPN熒光吸收值反而下降,這時觀察銅綠假單胞菌細胞懸浮液,形成不均勻的絮狀物。由于NPN要進入細胞外膜的疏水環境中才能發光,但在MBC濃度下,膜結構遭到破壞,細胞裂解,NPN將無法進入疏水性環境,從而導致NPN的熒光吸收值下降。因此,在低濃度下提取物增大細胞膜通透性,當濃度達到MIC,部分細胞膜受損,濃度增大到MBC時細胞破裂,導致細胞死亡。

圖6 不同濃度牡丹花蕾提取物處理銅綠假單胞菌后攝取NPN的熒光吸收值Fig.6 NPN uptake of P. aeruginosa treated with different concentrations of P. suffruticosa buds extract
2.6 銅綠假單胞菌的細胞形態變化
從圖7-A中可以看出,正常銅綠假單胞菌細胞具有規則的細胞形態,呈桿狀分布,結構完整,見完整的細胞壁,大量的銅綠假單胞菌黏附,連接成片,見多聚分泌物,呈膜狀包裹的典型生物膜性狀。

A-對照;B-MIC處理;C-MBC處理圖7 不同濃度牡丹花蕾提取物處理銅綠假單胞菌后掃描電鏡顯微照片Fig.7 SEM photomicrographs of P. aeruginosa treated with different concentrations of P. suffruticosa buds extract
圖7-B顯示,通過濃度MIC牡丹花蕾提取物處理3 h后,細胞形態發生了明顯變化,無明顯細胞壁,細胞變短,絕大部分細胞發生萎縮并出現凹陷,部分細胞出現干癟或空洞,且無可見生物膜;濃度為MBC牡丹花蕾提取物處理3 h后結果如圖7-C所示,細胞形態完全破壞,大部分細胞裂解,出現大量細胞碎片。說明牡丹花蕾提取物抑制銅綠假單胞菌細胞生長,清除生物膜,破壞細胞壁和細胞膜,最終導致細胞死亡。
3 結論
本研究以銅綠假單胞菌為試驗菌,初步探討了牡丹花蕾提取物的抑菌活性及抑菌機理。結果表明,牡丹花蕾提取物對銅綠假單胞菌的最低抑制濃度和最低殺死濃度分別為3.13和6.25 mg/mL,且具有較好的穩定性;牡丹花蕾提取物使銅綠假單胞菌細胞膜飽和脂肪酸相對含量增加,單不飽和脂肪酸相對含量降低,導致膜流動性降低;通過改變膜蛋白結構和構象使細胞膜功能發生障礙和細胞損傷;同時可破壞細胞膜完整性和增加細胞外膜的通透性,最終導致細胞死亡。因此,牡丹花蕾提取物可以作為一種新型的具有應用前景的植物源防腐保鮮劑。

