CXCR4基因沉默對膀胱癌T24細胞增殖和凋亡及遷移能力的影響
陳 爍, 龔銀銀, 顏景穎, 汪慧敏, 冉 云, 張 濤
在我國,膀胱癌的發病率位居惡性腫瘤的第5位,位居男性泌尿生殖系統惡性腫瘤的第1位,且復發率高達50%~70%[1]。因此,探討膀胱癌發生發展的分子機制,尋找可靠的生物學標志物和有效的基因治療靶點,對提高膀胱癌患者的生存率顯得尤為重要[2]。研究認為,CXCR4基因與多種惡性腫瘤的發生發展關系密切[3-4]。本研究擬通過RNA干擾技術下調CXCR4基因的表達水平,觀察CXCR4基因表達下調對膀胱癌T24細胞增殖、凋亡、遷移功能方面的影響。
1 材料與方法
1.1 材料 人膀胱癌T24細胞株(中國典型培養物保藏中心);兔抗人CXCR4抗體(美國R&D公司);轉染脂質體Lipofectamin 2000(美國Invitrogen公司);RPMI 1640細胞培養液及胰蛋白酶(美國Gibco公司);10%的胎牛血清(杭州四季青公司);噻唑藍(MTT)(美國Sigma公司);Transwell小室(美國Costar公司);Lenti-CXCR4-siRNA慢病毒液由中山大學附屬第一醫院胃腸外科王天寶教授饋贈。
1.2方法
1.2.1細胞培養及轉染分組 在無菌條件下,將人膀胱移行細胞癌T24細胞株置于含有10%胎牛血清、1%雙抗(鏈霉素+青霉素)的RPMI 1640培養液中培養,于37 ℃、體積分數為0.05的CO2培養箱中培養。轉染前1天,把處于對數生長期的T24細胞以每孔5×105個的密度接種在6孔板中;次日,當T24細胞濃度達50%~70%時進行轉染實驗。將T24細胞分為3組:(1)干擾組,應用陽離子脂質載體Lipofectamine 2000將小干擾RNA(small interfering RNA,siRNA)轉染入T24細胞,轉染5 h后,更換含血清及抗生素的培養液再繼續培養;(2)陰性對照組,將轉染siRNA空載體作為陰性對照組;(3)空白對照組,不進行任何處理。
1.2.2Western-blot檢則 取80 μg蛋白質樣品進行聚丙烯酰胺凝膠電泳,轉膜,室溫下封閉1 h,加入用0.05%的Tween 20 TBS緩沖液稀釋的CXCR4蛋白抗體(1∶1 000稀釋),4 ℃孵育過夜,再用TBS緩沖液漂洗3次,加入用辣根過氧化物酶標記的二抗(1∶1 000)中,37 ℃下溫育1 h,采用增強化學發光系統顯色和拍照。采用相關軟件分析各條帶光密度值。實驗重復3次,取均數作為該蛋白質的表達含量。
1.2.3檢測細胞的死亡率 取對數生長期細胞,調整濃度為1×105mL-1,接種于24孔培養板中,分別于轉染24,48及72 h后收取細胞,3 200 r/min離心3 min,以適量體積重懸,用0.04%臺盼藍溶液與等體積細胞懸液混勻3 min,計數活細胞和死細胞。
細胞死亡率(%)=死細胞總數/(活細胞總數+死細胞總數)×100%
1.2.4細胞增殖檢測 (1)細胞增殖實驗:將密度為2×105mL-1的T24細胞移到96孔板中培養,每孔加入100 μL的RPMI 1640培養基(含10% FBS),于37 ℃水浴孵育5 min或室溫放置25 min。每孔加入10 μL的CCK-8溶液,在細胞培養箱內繼續孵育2 h。分別于CCK-8溶液加入后的0,24,48和72 h測定不同處理的T24細胞的光密度值,并進行統計學分析。(2)細胞凋亡檢測:將T24細胞以每孔1×105mL-1的密度種植于6孔板中,加入無血清DMEM培養基,于37 ℃、體積分數為0.05的CO2培養箱中孵育24 h,收集細胞,1 000 r/min下離心5 min,PBS清洗2次,Binding Buffer清洗1次,1 000 r/min下離心5 min。Binding Buffer 500 μL重懸細胞,避光加入5 μL Annexin V,室溫避光作用15 min。加入5 μL 7-氨基放線菌素D(7-amino-actinomycin D,7-AAD),1 h內用流式細胞儀檢測。
1.2.5Transwell小室侵襲實驗 取100 μL T24細胞懸液加入到Transwell小室,下室加入500 μL的10% FBS培養基,再放入37 ℃培養箱內繼續培養。連續培養48 h,觀察細胞遷移情況。將Transwell小室取出,用棉棒將上室內的明膠基質擦去,用PBS清洗3遍,4%多聚甲醛室溫下固定30 min,再用PBS溶液清洗干凈后,用0.1%結晶紫染色30 min,用PBS液清洗,吹干。顯微鏡隨機挑選10個視野進行細胞計數,取平均值。
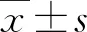
2 結 果
2.1siRNA干擾對T24細胞中CXCR4蛋白表達的影響 轉染72 h后,Western-blot檢測結果顯示,3組細胞均不同程度表達CXCR4,干擾組明顯低于空白對照組和陰性對照組(P<0.01,圖1)。

A:Western-blot檢測3組CXCR4蛋白的電泳圖譜,1,2,3分別為空白對照組、陰性對照組及干擾組;B:3組T24細胞CXCR4蛋白的相對表達量,與其他兩組比較,☆☆:P<0.01.圖1 siRNA干擾對T24細胞中CXCR4蛋白表達的影響Fig 1 Expression of CXCR4 on T24 cells after siRNA interference
2.2siRNA 干擾對T24細胞死亡的影響 轉染siRNA后24,48和72 h后,干擾組的T24細胞死亡率高于空白對照組(P<0.05),而空白對照組與陰性對照組比較,差別則無統計學意義(表1)。
表1CXCR4基因沉默后不同時間T24細胞死亡率的變化
Tab 1Rate of cell death on T24 cell at different times after silencing of CXCR4 gene

分 組t轉染/h244872空白對照組2.312±0.6513.205±0.4574.431±0.983陰性對照組2.293±0.4824.212±0.4845.589±0.616干擾組4.805±0.711#15.568±0.913#40.146±2.152☆
n=3. 表中數據為%. 與空白對照組比較,☆:P<0.05.
2.3siRNA干擾后對T24細胞增殖的影響 轉染siRNA 24,48和72 h后,陰性對照組、空白對照組和干擾組的膀胱癌細胞系增殖速率分別為[(0.99±0.4),(0.98±0.4),(0.65±0.2);(2.36±0.4),(2.28±0.4),(1.32±0.3);(3.59±0.2),(3.39±0.3),(1.83±0.4)],3組在各個時間點的差別均具有統計學意義(P<0.05,圖2)。

3組細胞在各個時間點比較,☆:P<0.05,☆☆:P<0.001.圖2 轉染siRNA后抑制膀胱癌T24細胞系的增殖Fig 2 The proliferation of T24 bladder cancer cells after siRNA transfection
2.4siRNA干擾后對T24細胞凋亡的影響 干擾組的凋亡率為(63.66±5.7)%,與空白對照組和陰性對照組比較[(18.4±2.6)%,(20.2±3.1)%],差別均有統計學意義(P<0.01,圖3)。

A:空白對照組; B:陰性對照組; C:干擾組.圖3 雙染法流式細胞術分析各組細胞的凋亡率Fig 3 Apoptosis rate of different groups
2.5siRNA干擾后對膀胱癌T24細胞遷移侵襲能力的影響 Transwell遷移實驗顯示,每高倍鏡視野下,干擾組的細胞數目顯著低于陰性對照組和空白對照組(圖4A~C)。T24細胞空白對照組(234.6±23.4)個、陰性對照組(210.7±20.9)個,明顯高于干擾組的(84.9±17.5)個,差別具有統計學意義(P<0.05,圖4D)。

A:空白對照組;B:陰性對照組;C:干擾組;D:統計柱狀圖. 與其他兩組比較,☆☆:P<0.01.圖4 Transwell實驗分析siRNA對T24腫瘤細胞侵襲的影響Fig 4 Cell invasion of siRNA on T24 bladder cancer cell
3 討 論
膀胱癌的發生發展是多因素、多階段的綜合過程。趨化因子家族因其為刺激新血管形成提供關鍵信號,以及促成細胞成熟和調節細胞分化和凋亡的特殊功能,目前已成為膀胱癌基因新的研究熱點[5]。趨化因子CXCL12是趨化因子CXC家族中的一員,又名基質細胞衍生因子-1(stromal cell derived factor-1, SDF-1),是一種造血過程和骨髓移植術后骨髓基質細胞產生的細胞因子,是T細胞和單核細胞的趨化因子,在肺、肝、骨髓和淋巴結等器官中高表達[6]。國內外研究發現,腫瘤組織的基質中含有大量CXCL12,并且在部分腫瘤細胞株中可以檢測到CXCL12的表達[7]。CXCR4是目前唯一已知的CXCL12受體,介導CXCL12的趨化作用。當前普遍認為,CXCR4的表達是惡性腫瘤的一個重要特征,可作為判斷預后的重要指標之一[8]。進一步的研究發現,CXCL12/CXCR4對胚胎發育和腫瘤轉移具有重要作用[9-11]。Guembarovski等發現,CXCL12/CXCR4系統在乳腺癌的轉移過程中具有明顯作用,表達CXCR4的腫瘤細胞可以在CXCL12的趨化影響下向周圍或遠端組織侵襲并形成轉移灶[12]。此外,CXCR4在骨肉瘤和肺癌中表達升高[13-14]。Akashi等采用免疫組織化學法檢測前列腺癌組織,結果發現,CXCR4蛋白表達升高與腫瘤的轉移正相關[15]。筆者在前期的研究中也發現,CXCL12能夠促進骨肉瘤細胞遷移和侵襲,抑制其受體CXCR4表達后,可逆轉CXCL12對骨肉瘤遷移和侵襲的促進作用,表明CXCR4基因對骨肉瘤的侵襲和遷移起重要調節作用[16]。
近年來,國內外學者發現,CXCR4基因也可能在膀胱癌的發生發展和轉移中起重要作用。葉明寶等檢測了118例膀胱癌組織和癌旁組織標本的SDF-1/CXCR4、PD-L1/PD-1以及細胞凋亡相關分子、細胞侵襲相關分子的表達量,結果發現,SDF-1/CXCR4與負性共刺激分子PD-L1、促增殖分子、促侵襲分子的高表達密切相關,SDF-1/CXCR4能夠促進膀胱癌細胞的免疫逃逸、增殖以及侵襲[17]。此外,鄭湘予等發現,CXCR4 siRNA能抑制人膀胱癌T24細胞株裸鼠皮下移植瘤的形成[18],但未檢測CXCR4基因沉默后對人膀胱癌T24細胞增殖、凋亡和遷移能力的影響。杜岳峰等構建人端粒酶逆轉錄酶(human telomerase reverse transcriptase,hTERT)啟動子調控的CXCR4短發夾RNA逆轉錄病毒表達載體,并研究其對hTERT陽性膀胱癌細胞中CXCR4表達的抑制效應以及對細胞侵襲、增殖的影響,但只限于hTERT陽性膀胱癌細胞[19]。
本研究發現,轉染siRNA后,T24細胞中的CXCR4蛋白表達明顯下調,同時還促進T24細胞的凋亡,抑制T24細胞的增殖,并顯著降低T24細胞的遷移能力,表明下調CXCR4基因可能抑制膀胱癌細胞的增殖及轉移,沉默CXCR4基因可能是新的膀胱癌治療靶點。

