胃饑餓素對衣霉素誘導成骨細胞內質網應激的影響
劉煥娜 張硯華 徐麗麗 朱曉琳 李華建 王春芝 楊乃龍*
1.青島大學醫學院附屬醫院內分泌科,山東 青島 266000 2.青島李滄區中心醫院內二科,山東 青島 266041 3.青島市市立醫院老年內科,山東 青島 266071 4.海陽市人民醫院神經外科,山東 煙臺 265100 5.海陽市人民醫院內分泌科,山東 煙臺 265100
內質網是負責細胞內蛋白質合成、折疊、成熟和加工的重要細胞器。當細胞遭遇衰老、基因突變、營養缺失、病原體感染時[1],將會導致內質網中蛋白質的錯誤折疊或未折疊,這將會引起內質網管腔中蛋白質的累積,從而引發內質網應激(endoplasmic reticulum stress,ERS)[2],過度的ERS會誘導細胞凋亡。而成骨細胞內的ERS是發生骨質疏松的主要機制之一[3],但具體機制不清。
Ghrelin是主要分泌于胃底部泌酸粘膜區的一種胃腸道激素,其主要作用是促進食欲和生長激素的分泌,是生長激素促分泌受體(GHSR)的天然配體[4]。GHSR表達于不同組織,如大腦[5]、腎臟[6]和前列腺[7],同時也表達于成骨細胞,直接促進成骨細胞的增殖和分化[8]。動物實驗和體外實驗均以證明,ghrelin對骨形成具有保護作用[9]。在臨床中發現,胃大部切除術后可迅速引起骨量減少,而不依賴于鈣吸收不足等缺陷。說明ghrelin對體內的骨重建起到重要的作用[10]。本研究通過衣霉素誘導成骨細胞內質網應激模型,利用ghrelin預處理成骨細胞后,觀察ghrelin對成骨細胞內質網應激的影響。
1 材料和方法
1.1 實驗材料
小鼠前體成骨細胞MC 3T3-E1購于中科院上海細胞庫;α-MEM培養基、胎牛血清購自美國GIBCO公司;胰蛋白酶、青鏈霉素混合液、二甲基亞砜(DMSO)、CCK-8試劑盒購自北京索萊寶公司;活性氧(ROS)測試盒購自南京建成生物工程研究所;引物由上海生工公司設計并合成;胃饑餓素由南京肽業生物科技有限公司合成;衣霉素購自美國Cayman Chemical公司;Trizol購自美國Sigam公司;反轉錄試劑盒、RT-PCR試劑盒購自日本Takara公司。
1.2 實驗方法
1.2.1細胞培養:將MC3T3-E1細胞培養于含有10%胎牛血清、1%雙抗的α-MEM培養基中,置于5% CO2、37 ℃條件的培養箱中培養,每2 d 換液1次,待細胞密度長至70%~80%時進行細胞傳代。
1.2.2細胞活性檢測:采用CCK-8法。取對數生長期狀態良好的細胞以5000/孔的密度接種于96孔板中,每孔100 μL,待培養箱中培養24 h 貼壁后,更換含不同濃度衣霉素的完全培養基,根據衣霉素的濃度分為5組,即0μg/mL組、0.5μg/mL 組、1μg/mL組、1.5μg/mL組。每組4個復孔,另設調零孔。繼續培養24 h后,每孔加入10 μL的CCK-8試劑,孵育4 h后用酶標儀測定450 nm波長處的吸光度(A值)。選取最敏感濃度1.5μg/mL的衣霉素濃度做后續的實驗。為驗證ghrelin對內質網應激的影響,用不同濃度的ghrelin(0、10-11、10-9、10-7mol/L)預處理細胞4 h 后再加入1.5μg/mL的衣霉素干預24 h,每組4個復孔,另設零孔。培養結束后,采用上述方法檢測每孔吸光度。實驗重復3次。ghrelin的合成序列見圖1。
1.2.3胞內活性氧(ROS)測定:根據ROS檢測試劑盒說明書進行檢測。簡言之,將生長狀態良好的細胞以5000/孔的密度接種于96孔板中,孵育24 h貼壁后,分組方法同前,每組4個復孔。用無血清的培養液將熒光探針DCFH-DA稀釋至10 μmol/L,去除細胞培養液,每孔加入50 μL的稀釋的DCFH-DA,于培養箱中避光孵育45 min,用PBS洗滌細胞3次,以充分去除未進入細胞的DCFH-DA。用熒光酶標儀在488 nm激發波長、525 nm發射波長處檢測熒光強度。實驗重復3次。
1.2.4實時定量PCR檢測:采用實時定量PCR 2-△△CT法。細胞以密度為105/孔接種于6孔板中,孵育24 h貼壁后,分組方法同上。每組設定3個平行孔。培養結束后,使用Trizol試劑常規提取細胞總RNA,測定其純度、濃度并反轉錄為cDNA。總反應體系為25 μL,包括dd水8.5 μL、正反引物各1 μL、cDNA 2 μL、TB Green Premix Ex TaqII 12.5 μL。反應條件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 60 s,40個循環。各基因引物序列及引物擴增片段長度見表1。

圖1 酰化ghrelin的合成序列Fig.1 The synthetic sequence of acylated ghrelin

名稱引物序列片段長度(bp)GRP78F:5′-GCCAACTGTAACAATCAA-3′R:5′-GCTGTCACTCGGAGAATA-3′165CHOPF:5′- GCTGGAAGCCTGGTATG-3′R:5′- CTTTGGGATGTGCGTGT-3′183Caspase-12F:5′-AAGGTAGGCAAGACTGGTTCC-3′R:5′-AATAGTGGGCATCTGGGTCA-3′147β-actionF:5′-CCTTCCGTGTTCCTACCC-3′R:5′-CCCAAGATGCCCTTCAGT-3′130
1.3 統計學處理
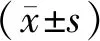
2 結果
2.1 衣霉素干預對細胞增殖活性的影響
與對照組相比,1.0 μg/mL和1.5 μg/mL的衣霉素干預24 h可明顯降低成骨細胞的增殖活力和生存率(P<0.05),而0.5 μg/mL衣霉素干預24 h后對細胞增殖無明顯影響(P>0.05)。見表2。根據以上結果,本實驗決定用效果最明顯的1.5 μg/mL的衣霉素進行后續的實驗。
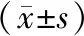
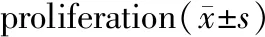

組別A570存活率(%)對照組0.989±0.036100Tm(0.5 μg/mL)0.905±0.01177.12Tm(1.0 μg/mL)0.619±0.028?61.75?Tm(1.5 μg/mL)0.444±0.043??44.36??
注:Tm:衣霉素;G:ghrelin;與對照組相比,*P<0.05,**P<0.01。
2.2 衣霉素干預對胞內ROS的影響
用不同濃度的衣霉素干預24 h后,胞內ROS的含量隨著衣霉素濃度的增加而增加,與對照組相比明顯升高(P<0.05),而1.5 μg/mL的衣霉素干預細胞24 h后胞內ROS的含量將近是空白對照組的2倍(P<0.001)。見圖2。
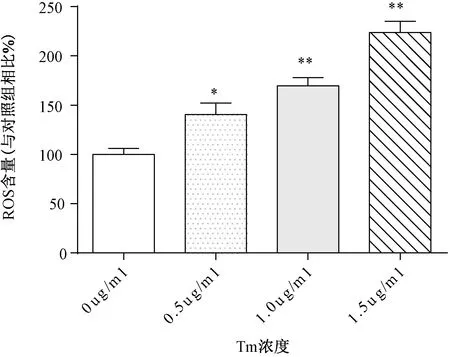
圖2 不同濃度的衣霉素對胞內ROS含量的影響注:與0μg/mL的衣霉素相比,*P<0.05,**P<0.01。Fig.2 Effects of different concentrations of tunicamycin on intracellular ROS content
2.3 衣霉素干預成骨細胞對BIP、CHOP、caspase-12表達的影響
與對照組相比,用不同濃度的衣霉素干預成骨細胞24 h后CHOP、BIP、caspase-12 mRNA的表達水平呈濃度依賴性增加。于CHOP mRNA的表達,不同濃度的衣霉素均有統計學意義(P<0.05)。于BIP和caspase-12 mRNA的表達,1.0μg/mL和1.5μg/mL的衣霉素干預24 h后有統計學意義(P<0.05),而0.5μg/mL的衣霉素干預24 h后無統計學意義(P>0.05)。見表3。
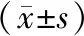

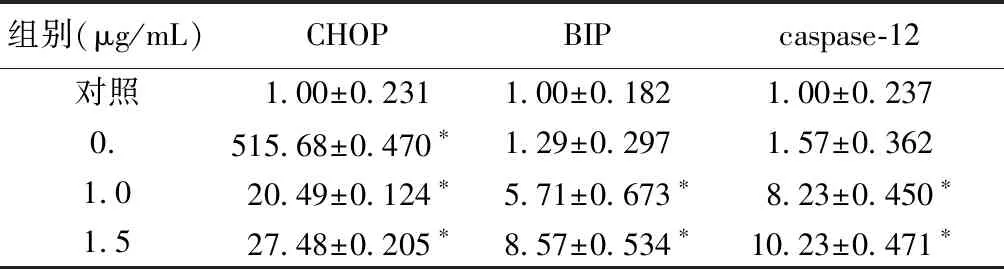
組別(μg/mL)CHOPBIPcaspase-12對照1.00±0.2311.00±0.1821.00±0.2370.515.68±0.470?1.29±0.2971.57±0.3621.020.49±0.124?5.71±0.673?8.23±0.450?1.527.48±0.205?8.57±0.534?10.23±0.471?
注:與對照組比較,*P<0.05。
2.4 ghrelin預處理對衣霉素干預成骨細胞增殖的影響
與單純1.5 μg/mL的衣霉素相比,用不同濃度的ghrelin預處理4 h后再加入衣霉素干預24 h可以使細胞增殖活力和存活率提高。10-9mmol/L和10-7mmol/L的ghrelin組細胞增殖活力和存活率明顯提高(P<0.05),而10-11mmol/L的ghrelin組差異無統計學意義(P>0.05)。與對照組比,單純加入不同濃度的ghrelin干預4 h后,細胞增殖活力和生存率無統計學意義(P>0.05),見表4。

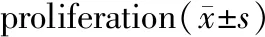
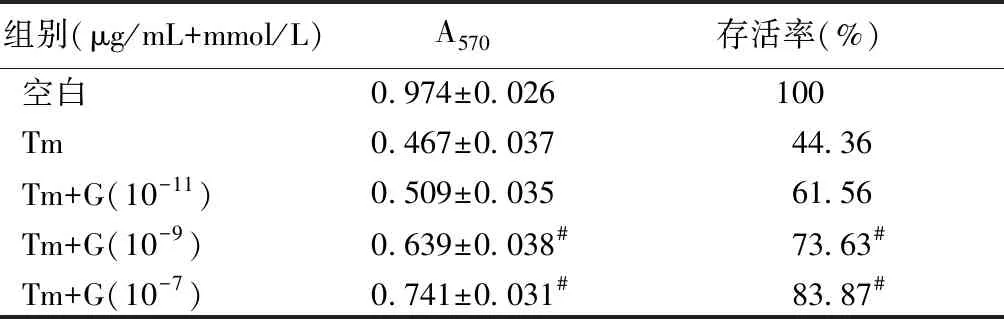
組別(μg/mL+mmol/L)A570存活率(%)空白0.974±0.026100Tm0.467±0.03744.36Tm+G(10-11)0.509±0.03561.56Tm+G(10-9)0.639±0.038#73.63#Tm+G(10-7)0.741±0.031#83.87#
注:與單純1.5 μg/mL衣霉素相比,#P<0.05
2.5 ghrelin預處理對衣霉素干預成骨細胞胞內ROS的影響
與單純1.5 μg/mL的衣霉素相比,用不同濃度的ghrelin預處理成骨細胞4 h后再加入衣霉素干預細胞24 h后,胞內ROS的含量隨著ghrelin濃度的增加而減少。用10-11mmol/L的ghrelin預處理后,差異有統計學意義(P<0.05),而10-9mmol/L和10-7mmol/L組的ghrelin預處理后差異有明顯的統計學意義(P<0.001)。與對照組相比,單純ghrelin干預成骨細胞4 h,胞內ROS的含量差異無統計學意義(P>0.05),見圖3。
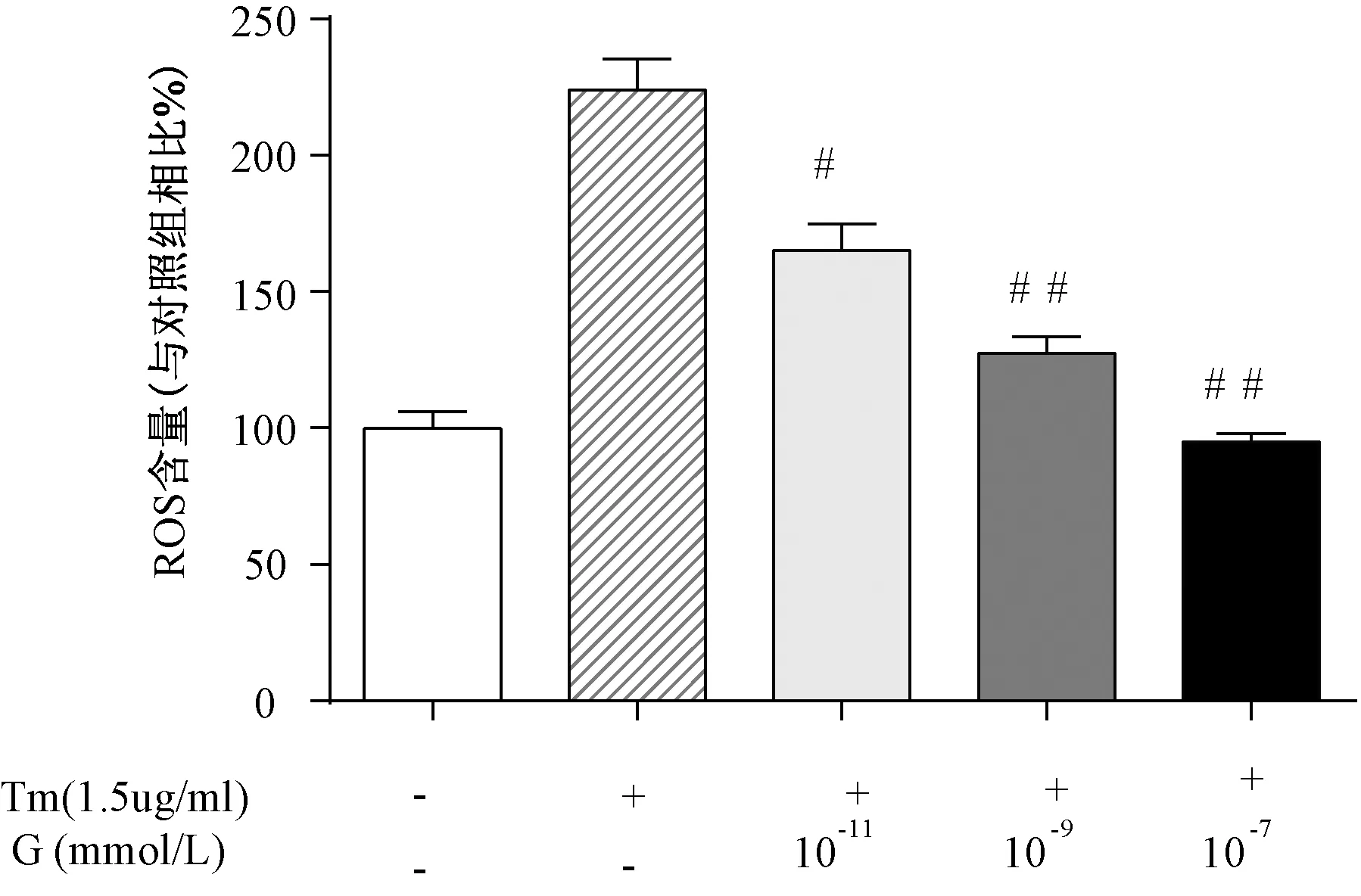
圖3 不同濃度的ghrelin預處理對衣霉素干預細胞后胞內ROS含量的影響注:與單純1.5 μg/mL衣霉素相比,#P<0.05,##P<0.01。Fig.3 Effects of pretreatment with different concentrations of ghrelin on intracellular ROS content after tunicamycin intervention
2.6 Ghrelin預處理對衣霉素干預成骨細胞CHOP、BIP、caspase-12 mRNA表達的影響
與單純1.5 μg/mL的衣霉素相比,不同濃度的ghrelin預處理后均可降低由衣霉素引起的CHOP、BIP、caspase-12 mRNA表達的增高,對于CHOP mRNA的表達,在10-11mmol/L ghrelin干預4 h后無統計學意義(P>0.05),呈現與單純衣霉素干預組相反的趨勢(均P<0.05)。見表5。
表5不同濃度的ghrelin預處理對衣霉素干預細胞后對CHOP、BIP、caspase-12 mRNA表達的影響
Table5Effects of pretreatment with different concentrations of ghrelin on the expression of CHOP, BIP, and caspase-12 mRNA in the cells
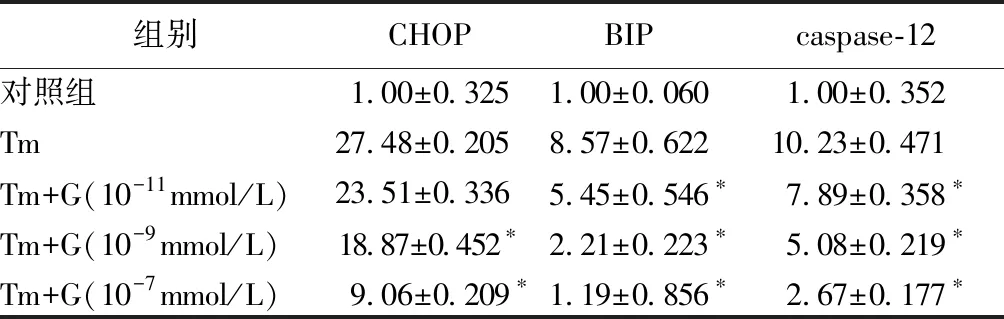
組別CHOPBIPcaspase-12對照組1.00±0.3251.00±0.0601.00±0.352Tm27.48±0.2058.57±0.62210.23±0.471Tm+G(10-11mmol/L)23.51±0.3365.45±0.546?7.89±0.358?Tm+G(10-9mmol/L)18.87±0.452?2.21±0.223?5.08±0.219?Tm+G(10-7mmol/L)9.06±0.209?1.19±0.856?2.67±0.177?
注:Tm:1.5 μg/mL衣霉素;G:ghrelin;與單純1.5 μg/mL衣霉素相比,*P<0.05。
3 討論
ghrelin是1999年由日本科學家Kojima發現的含有28個氨基酸的多肽激素,主要分泌于胃底部泌酸粘膜區的X/A細胞,另在垂體、下丘腦、肺、腎臟、睪丸、卵巢中少量分泌[11-12]。ghrelin最初發現是作為內源性生長激素促泌受體(GHSR)的天然配體,其主要作用是促進食欲和生長激素的分泌。因GHSR廣泛表達于多種組織中,其生物作用非常廣泛,可促進胃蠕動和胃酸的分泌[13],與味覺[14]、壓力和焦慮[15]、葡萄糖的代謝[16]、心臟的輸出[17]和骨形成[8]有關。近年來隨著對ghrelin的深入研究,越來越多的證據證明ghrelin和骨質疏松之間存在著密切的關系。Nouh等[18]以絕經前、圍絕經期和絕經后婦女為研究對象,對其進行骨礦物質密度(BMD)和ghrelin水平的測定。發現與絕經前組相比,圍絕經期和絕經后組的平均血漿ghrelin水平和BMD顯著下降,且ghrelin與BMD之間存在顯著的正相關,證明ghrelin可以影響BMD,但具體機制不清。有學者認為ghrelin有可能是骨骼的潛在促進因子[19-20]。Yu等[21]觀察到,對30位病態肥胖患者進行胃旁路手術,20位肥胖患者進行假手術。2年后手術組比假手術組脊柱和髖部BMD均明顯下降,且兩組中血鈣、維生素D和甲狀旁腺素(PTH)水平保持穩定,BMD下降原因具體機制不清,因胃旁路手術后阻斷胃底部血運,致ghrelin分泌減少。所以考慮是因ghrelin水平降低所導致的。但至今研究甚少,需進一步研究證明。
內質網是細胞內負責蛋白質合成、折疊、運輸的重要細胞器,當細胞內未折疊或錯誤折疊蛋白質的量超過內質網處理能力后即會發生內質網應激。活性氧(ROS)是生物代謝的衍生物,可破壞并氧化蛋白質、脂質和DNA,導致細胞功能改變,促進骨質的流失引起骨質疏松[22]。據報道,ROS是導致內質網中錯誤蛋白折疊的主要原因[23]。觀察性研究發現,骨質疏松患者和去卵巢成年大鼠的ROS和BMD值之間呈負相關[24]。適度的內質網應激可以保護細胞的功能,而過度的內質網應激則促進細胞的凋亡。在內質網中存在三種跨膜蛋白,分別是蛋白激酶激酶RNA樣內質網激酶(protein kinase RNA-like endoplasmic retieulum kinas, PERK),IRE1(inositol requiring kinase 1)、活化轉錄因子6(activating transcription factor 6,ATF6)。正常情況下,三種跨膜蛋白和分子伴侶免疫球蛋白結合蛋白/葡萄糖調節蛋白78(immunoglobulin binding protein,BIP/glucose-regulated protein 78,GRP78)結合,使其失去活性[25]。當適度的內質網應激時,BIP從三種跨膜蛋白中解離并活化PERK、IRE1、ATF6,啟動內質網應激的保護作用[26]。當持續或過度的內質網應激時,細胞已不能恢復功能,則通過CHOP途徑、caspase-12途徑、JNK途徑誘導細胞凋亡[27]。內質網應激與許多疾病有關。包括癌癥[28]、神經性疾病[29]、糖尿病[30]、心臟病[31]、肝臟疾病[32]和骨質疏松癥[3]。而成骨細胞中內質網應激是發生骨質疏松的重要機制之一[3,33],但在成骨細胞中有關ghrelin和內質網應激的關系研究甚少。
本研究是探究ghrelin是否可以抑制成骨細胞內質網應激來預防骨質疏松的發生。以MC3T3-E1為研究對象,通過1.5 μg/mL的衣霉素干預成骨細胞建立內質網應激模型,測定成骨細胞的增殖活力,胞內ROS的含量、內質網應激標志性基因的表達含量能反映內質網應激的發生。然后用不同濃度的ghrelin預處理細胞4 h后,用同樣方法檢測上述指標。結果發現,ghrelin預處理后細胞的存活率升高,胞內ROS的含量和內質網應激相關標志性基因表達量降低,說明ghrelin可以改善成骨細胞的內質網應激。已經提出一種ghrelin改善細胞中內質網應激的機制,即ghrelin增加細胞內抗氧化活性[34],我們的數據顯示ghrelin可以降低衣霉素誘導后胞內ROS的含量,表明ghrelin可以上調細胞內抗氧化酶或ghrelin即具有抗氧化活性。一項研究[35]發現,ghrelin可以改善由內質網應激誘導的大鼠心肌損傷和凋亡,其可能通過激活AMP依賴的蛋白激酶(AMP-activated protein kinase,AMPK),AMPK作為燃料傳感器,調節細胞和全身的的能量平衡。也有研究[36]認為,ghrelin的保護作用是由刺激GHSR所介導的,但具體下游機制還未確定。但有待于觀察ghrelin是否通過AMPK改善成骨細胞中的內質網應激。現已證明ghrelin可以改善心肌細胞中的內質網應激,防止動脈粥樣硬化的發生[17]和缺血再灌注損傷[37]。ghrelin還可改善由高水平的亞硫酸鹽誘導的內質網應激[38]。在成骨細胞中,已證明ghrelin可以改善氧化應激帶來的細胞的凋亡[39]。雖現對ghrelin對成骨細胞內質網應激的研究甚少,但不能否定其價值。尤其對于骨質疏松的治療,不僅可以促進成骨細胞的增殖和分化,同時抑制細胞的凋亡,為骨質疏松的治療提供新的方案,但需要更多的試驗進行驗證。

