鯽和虹鱒IgM重鏈恒定區的融合表達及抗血清的制備
曹志偉,陳紅英
(西北農林科技大學生命科學學院,陜西 楊凌 712100)
免疫球蛋白(Igs)由B淋巴細胞產生,在脊椎動物的適應性免疫反應中起重要作用。Ig分子由兩條重鏈(IgH)和兩條輕鏈(IgL)通過二硫鍵連接在一起,抗原結合位點位于IgH和IgL鏈的可變區。雖然魚類的免疫系統比較原始,但是,硬骨魚體內產生的Ig包括IgM[1]、IgD[2-4]和IgT/IgZ[5,6]。在機體內發揮功能的免疫球蛋白主要是IgM[7],哺乳動物體內的IgM分子主要是以五聚體形式存在,而硬骨魚的IgM分子主要為四聚體[8]。IgD在體液免疫中發揮重要作用[9,10],IgT 在粘膜免疫應答中產生[11-13]。
抗體具有高特異性和高親和力,特異性的抗體已經成為哺乳動物和脊椎動物免疫治療及免疫學和診斷學的重要工具[14]。迄今已開發出多種針對魚IgM的單克隆和多克隆抗體,如鯉Cyprinus carpio[15]、日本牙鲆Paralichthysolivaceus[16]和虹鱒Oncorhynchus mykiss[17],用作這些魚類的免疫學研究工具。這些抗體可以檢測特定魚的IgM,但是,單獨開發用于檢測每個物種免疫應答的抗體昂貴且耗時。為了降低成本和時間,本研究克隆和融合表達了鯽和虹鱒IgM的重鏈基因保守序列,用純化的融合蛋白制備兔抗血清,獲得了能同時用于特異性檢測鯽和虹鱒IgM的多克隆抗體。
1 材料與方法
1.1 材料
鯽購自陜西臨潼區任留良友育種繁育場,虹鱒購自四川雅安貴特種水產經營部;SanPrep柱式質粒DNA小量抽提試劑盒、SanPrep柱式DNA膠回收試劑盒、SanPrep柱式PCR產物純化試劑盒、弗氏完全佐劑、弗氏不完全佐劑、IPTG(異丙基硫代-β-D-半乳糖苷)、透析袋(直徑 27mm)、EL-TME顯色試劑盒(EL-TMB Chromogenic Reagent kit)和抗生素購自生工生物工程(上海)股份有限公司;BamHⅠ、XhoⅠ和T4 DNA連接酶購自NEB公司;DL2000 DNAmarker購自 Vazyme;2×Pfu MasterMix,化學發光試劑盒和HRP標記的Goat Anti-Mouse IgG購自康為世紀;大腸桿菌Top10(Escherichia coli Top10)、大腸桿菌 BL21(DE3)和質粒 pTriEx-1.1 皆由本實驗室保存;2~3月齡新西蘭大白兔購自西安交通大學實驗動物中心;其他化學試劑為分析純。
1.2 引物設計
在 NCBI(https://www.ncbi.nlm.nih.gov/)下載鯽和虹鱒的IgM重鏈基因序列,它們的GenBank序列號分別為GU563725和S63348,利用生物信息學分析基因的保守結構域,選定鯽IgM重鏈中的116~217位氨基酸序列和虹鱒 IgM重鏈中的135~235位氨基酸序列,優化氨基酸的密碼子。將選定的鯽和虹鱒IgM重鏈保守區序列用Linker(Gly4-Ser)2連接,設計特異的引物(表 1),按照圖1中的策略通過重疊PCR合成基因序列,將合成的基因命名為JY-HZ-IgM。
1.3 重組質粒pTriEx-JY-HZ-IgM的構建
用BamHⅠ和XhoⅠ雙酶切處理質粒pTriEx-1.1和合成的JY-HZ-IgM基因片段,將雙酶切產物切膠回收后置于20℃連接1h。連接產物pTriEx-JY-HZ-IgM轉化到Top10大腸桿菌感受態細胞,涂布于LB(含有氨芐霉素)的平板上,37℃過夜培養后,挑取單菌落進行菌落PCR檢測,檢測正確的菌落擴大培養后提取質粒進行雙酶切鑒定和測序驗證。

表1 引物的名稱和序列Tab.1 Name and sequences of the primers

圖1 JY-HZ-IgM片段合成策略Fig.1 Strategy for the JY-HZ-IgM fragment synthesis
1.4 融合蛋白JY-HZ-IgM的表達及可溶性分析
將重組質粒pTriEx-JY-HZ-IgM轉化到BL21(DE3)感受態細胞中,然后將菌液涂在含有Amp的平板上,倒置,37℃過夜培養。挑取單菌落轉接到5mL液體培養基中,37℃,250r/min搖菌。當菌液的OD600達0.7時,加入終濃度為0.2mM的IPTG誘導6h。吸取1mL培養好的菌液到1.5mL離心管中,8000r/min離心5min,棄上清收集菌體,將5mL的菌體全部收集。離心管中加入1mL的20mMTris-HCl緩沖液清洗菌體,8000r/min離心5min,棄上清收集菌體,清洗3次。清洗完的菌體沉淀中加入1mL20 mMTris-HCl(pH 7.9)緩沖液,放置在超聲波細胞粉碎機中破碎,然后8000r/min離心10min。收集上清和沉淀,沉淀用1mL的20mMTris-HCl緩沖液重懸,分別取樣進行SDS-PAGE檢測。
1.5 融合蛋白JY-HZ-IgM的純化
包含pTriEx-JY-HZ-IgM質粒的大腸桿菌BL21(DE3),按照 1∶100 的比例轉接到 100mL 新鮮培養基中,37℃,250r/min過夜培養。過夜培養菌液轉移到50mL離心管中8000r/min離心15min,棄上清。菌體用20mMTris-HCl緩沖液清洗3次,加入20mL的Tris-HCl緩沖液重懸,然后用超聲波細胞粉碎機破碎細胞,8000r/min離心30min,棄上清,收集沉淀。加入20mL8M尿素溶液,4℃放置12h充分溶解。然后按照His標簽蛋白純化試劑盒純化蛋白,把純化的蛋白溶液裝入透析袋中,在4℃下依次放置在4M、2M、1M和0M尿素溶液中透析,最后把透析過的蛋白液進行SDS-PAGE檢測。
1.6 融合蛋白JY-HZ-IgM抗血清的制備
新購買的兔子在實驗前先讓其適應環境兩周,每天按時喂養。選擇A、B兩只兔子采用皮下六點免疫。首次免疫每只兔子注射200μg融合蛋白JY-HZ-IgM,蛋白與弗氏完全佐劑等體積混合,充分乳化。第2~4次每次注射融合蛋白JY-HZ-IgM 100μg,蛋白與弗氏不完全佐劑等體積混合,每次免疫間隔2周,一共免疫4次。免疫結束后一周心臟采血,37℃放置 1h,4℃靜置過夜,1500r/min離心5min,收集血清,分裝,-20℃保存備用。
1.7 兔抗JY-HZ-IgM血清效價的檢測
以融合蛋白JY-HZ-IgM作為抗原,采用間接ELISA測定抗血清的效價。用包被液將抗原JY-HZ-IgM稀釋到2μg/mL,然后把稀釋好的抗原加到酶標板上,每孔50 μL,4℃過夜孵育。每孔加入200μLPBST放在搖床上清洗5min,重復清洗3次。每孔加入200μL封閉液,37℃放置2h。加入200μLPBST放在搖床上清洗5min,重復清洗3次。把抗血清按照1∶500、1∶2000、1∶8000、1∶32000、1 ∶128000、1∶512000、1∶2048000 和 1∶8192000 比例稀釋,陰性血清1∶500稀釋,然后按照順序加入到酶標板中,37℃孵育2 h。加入200μL PBST放在搖床上清洗5min,重復清洗4次。加入100 μLHRP標記的羊抗兔 IgG(1∶10000 稀釋),37℃孵育 1 h。加入 200 μLPBST放在搖床上清洗5min,重復清洗4次。每孔加入100μL顯色液,避光反應10 min,加入50 μL終止反應液。把酶標板放到多功能微孔板檢測儀檢測OD450。若實驗組OD450等于或大于陰性對照2.1倍,即可判定為陽性,陽性血清最大稀釋倍數即為血清抗體的效價。
1.8 抗血清Western blot檢測
心臟采血分離的血清作為一抗,分別與融合蛋白JY-HZ-IgM、鯽血清和虹鱒血清做Western blot分析,檢測抗血清的結合效果。首先把融合蛋白JY-HZ-IgM、鯽血清和虹鱒血清通過SDS-PAGE分離。經轉膜,封閉后加入心臟采血分離的血清作為一抗。洗膜,加入HRP標記的羊抗兔IgG作為二抗,洗膜。加入ECL顯色液,避光反應3min,最后放在化學發光成像系統(ChemiDocXRS+)中檢測。
2 結果與分析
2.1 JY-HZ-IgM序列合成
分別選取鯽和虹鱒IgM重鏈保守區一個保守的結構域設計引物,通過重疊PCR的方法克隆目的基因。將合成的片段JY-HZ-IgM用1%的瓊脂糖電泳凝膠檢測,預期片段大小為710 bp,檢測結果(圖2A)與預期相符,表明成功合成了JY-HZ-IgM片段。
2.2 重組質粒pTriEx-JY-HZ-IgM檢測
平板上單菌落PCR檢測結果表明(圖2B),擴增片段大小和預期相符(預期為710 bp)。提取質粒后進一步通過雙酶切檢測,酶切結果大小與預期相符(圖2C),最后送到北京擎科生物技術有限公司測序。測序結果正確,表明成功構建了pTriEx-JY-HZIgM質粒。

圖2 重組質粒的構建及鑒定Fig.2 Construction and identification of recombinant plasmid
2.3 融合蛋白JY-HZ-IgM的表達檢測
將構建的重組質粒pTriEx-JY-HZ-IgM轉化到大腸桿菌BL21(DE3)中,融合蛋白JY-HZ-IgM表達的可溶性分析結果見圖3。由圖3可知,表達的融合蛋白在上清中含量很少,大部分都在沉淀中以包涵體形式存在。包涵體沉淀用8M尿素溶解后,用His標簽蛋白純化試劑盒純化獲得融合蛋白JY-HZ-IgM(圖4),透析去除尿素后用分光光度計檢測可溶性的融合蛋白濃度為450μg/mL,純度在90%以上,達到后續實驗要求。
2.4 融合蛋白JY-HZ-IgM抗血清效價的測定

圖3 SDS-PAGE檢測融合蛋白JY-HZ-IgM表達Fig.3 SDS-PAGE detection of the fusion protein JY-HZIgM expression

圖4 純化的JY-HZ-IgM蛋白檢測Fig.4 Detection of purified JY-HZ-IgM protein
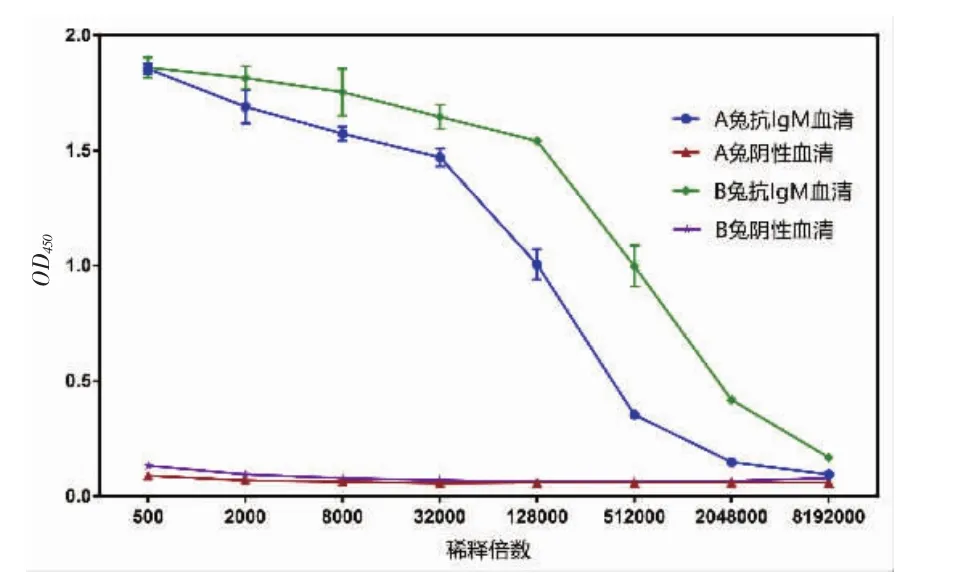
圖5 抗血清效價檢測Fig.5 Detection of antiserumtiter
融合蛋白JY-HZ-IgM抗血清效價的間接ELISA檢測結果見圖5。由圖5可知,A兔和B兔抗血清的效價都很好,B兔抗血清的效價略高于A兔。其中A兔制備的抗血清稀釋2048000倍時OD450仍大于免疫前陰性血清的2.1倍,判定為陽性。B兔制備的抗血清稀釋8192000倍時OD450仍大于陰性血清的2.1倍,判定為陽性,表明制作的兔抗JY-HZ-IgM血清效價高于1∶2048000。
2.5 Western blot檢測抗血清的特異性
Western blot檢測制備的兔抗JY-HZ-IgM血清與JY-HZ-IgM蛋白特異性結合的結果見圖6。由圖6可知:蛋白條帶與預期大小(25.3kDa)相符,制備的抗血清可以和JY-HZ-IgM特異結合(圖6,泳道1)。制備的抗血清與天然鯽血清、虹鱒血清進行Western blot檢測,鯽的IgM單條重鏈約70kDa,天然(非還原)狀態下與輕鏈結合,以四聚體的狀態存在。還原和非還原狀態的Western blot檢測也表明,制備的抗血清可以識別還原和非還原狀態的鯽IgM(圖6,泳道2和3)。虹鱒IgM重鏈的理論大小為64.9 kDa,還原和非還原條件下Western blot檢測結果與預期相符(圖6,泳道4和5)。以上結果表明,制備的兔抗JY-HZ-IgM血清不僅能夠與融合蛋白JY-HZ-IgM特異性結合,還可以識別天然的鯽和虹鱒的IgM,因此制備的兔抗JY-HZ-IgM血清可以用來檢測鯽和虹鱒血清中的IgM。

圖6 用抗血清檢測鯽和虹鱒IgMFig.6 Detection of IgM of crucian carp and rainbow trout by antisera
3 討論
我國的水產養殖歷史悠久,近年來水產品的產量持續穩定增長,其中鯽和虹鱒的養殖占有重要地位。但是,隨著密度增大,水質不斷惡化,養殖中細菌病和病毒病頻發。硬骨魚類的IgM是體內含量最多的免疫球蛋白,在體液免疫反應中發揮核心作用[18],在粘膜組織中具有較高的mRNA和蛋白水平。在寄生蟲、病毒或者細菌刺激魚體時,研究魚體內的免疫球蛋白M的變化規律有助于改進疾病的預防和治療措施。因此,研究魚類免疫球蛋白[19]及抗IgM的抗體的制備,可為魚類的免疫學研究提供檢測材料。
為了檢測鯽和虹鱒感染病毒后血清中IgM的變化量,本研究從NCBI獲取鯽和虹鱒IgM的重鏈序列,利用生物信息學分析序列的保守結構域,人工合成鯽和虹鱒IgM的重鏈保守序列JY-HZ-IgM。把合成的JY-HZ-IgM片段克隆到pTriEx-1.1載體上進行原核表達,結果融合蛋白JY-HZ-IgM大部分以包涵體的形式存在。尿素使蛋白變性后用His標簽蛋白純化試劑盒純化蛋白,透析復性得到可溶的融合蛋白JY-HZ-IgM,濃度達到450μg/mL。本研究以純化的融合蛋白JY-HZ-IgM作為抗原制備了兔抗JY-HZ-IgM血清,利用間接ELISA測定了抗血清的效價,陽性血清稀釋2048000倍時OD450仍為陰性血清的2.1倍。為了檢測制備的抗血清的結合特異性,分別與融合蛋白JY-HZ-IgM、天然鯽血清和虹鱒血清進行了Western blot檢測。據報道,硬骨魚的IgM重鏈為60~81kDa[20,21],本實驗中Western blot檢測的鯽和虹鱒IgM的大小相符,表明制備的抗血清可以與JY-HZ-IgM、天然鯽和虹鱒血清中的IgM特異性結合。因此,本實驗中制備的兔抗JY-HZ-IgM血清可以用于檢測鯽和虹鱒的IgM在不同條件下表達量。
綜上所述,本研究成功合成了JY-HZ-IgM基因片段,表達、純化了鯽和虹鱒IgM重鏈的保守蛋白,制備了高效價的抗JY-HZ-IgM的兔抗血清,為進一步研究鯽和虹鱒IgM在不同條件下的表達規律和機制奠定了基礎。

