焙烤類谷物食品糖基化產物的定性、定量評價方法
樊 蕊
(北京大學公共衛生學院營養與食品衛生學系,北京 100191)
美拉德反應是一種廣泛存在于食品加工儲藏等過程中的非酶糖基化反應,也稱為“非酶褐變”或“羰氨反應”。非酶糖基化反應是還原糖如葡萄糖、果糖等與蛋白質游離氨基之間發生的可逆反應[1],生成Schiff堿,Schiff 堿經過分子重排形成結構相對穩定Amadori 產物。Amadori 產物再經過一系列化學反應,包括多重脫水、裂解及活性二羰基中間產物的氧化修飾,形成多樣、穩定的加合物,即晚期糖基化終產物(Advanced glycation end-products, AGEs)[2]。AGEs 有多個生成來源和機制,如葡萄糖的自氧化、脂類物質的過氧化和多元醇通路等途徑,它不僅與食品的色香味及營養、安全等方面有關,更與人體健康密切相關[2]。
AGEs可以改善食品色澤和風味,日常食品中存在大量的AGEs物質,是體內AGEs的主要外部來源[1]。含有AGEs 的食品包括咖啡、可樂和巧克力等飲料產品、麥芽制品、濃縮乳和經熱加工的乳制品以及肉類制品以及面包等烘焙食品等。膳食中 AGEs 的含量取決于食品中的營養成分(蛋白質、脂肪、碳水化合物等)、加工方式(如煎、炸、烤)和儲存條件[3]。
飲食中攝入的AGEs大部分會進入肝臟和其他組織,其中約有1/3隨尿液排出[4]。研究表明,內源性AGEs 具有體內積聚性,已被證實AGEs 與糖尿病[5,6]、阿茲海默病[7,8]、動脈粥樣硬化[9]、尿毒癥[6]和衰老[6]等多種慢性疾病的發病有關,因此 AGEs 成為近年來研究關注的熱點,對食品中 AGEs 含量的研究也變得尤為重要。
AGEs具有廣泛性、不可逆性、結構異質性、吸收光譜獨特等獨特的理化特性。目前,用來檢測AGEs的方法主要有熒光光譜法、紫外分光光度法、液氣相色譜質譜法[10]。 Rada-Mendoza 等[11]研究了18 種以水果為基料的嬰兒食品,發現所有樣品中都含糠醛,平均含量為1.35 mg/100 g。Chia[13]利用高效液相色譜的方法測定棕櫚油中的糠醛含量,得出棕櫚油中的糠醛含量在(7.54~20.6) mg/kg,同時證明糠醛的形成與棕櫚油的生產工藝存在一定的關系[12]。有學者分析了玉米、小麥等不同主料的沖調谷物中游離和總熒光性AGEs含量,其平均含量分別為(163±157) AU/mg和(1 258±622) AU/mg。Zielinski[14]通過測定熒光性AGEs、糠氨酸、褐變指數,表征了不同種類蛋糕的美拉德反應的進程。
研究表明,由于AGEs形成機制廣泛,是多種分子差異、異質物質的總稱,AGEs 的檢測尚缺乏靈敏、高效的方法。本研究針對谷物食品中不同來源的糖基化產物,以期從色度、吸光度、熒光值以及終產物的含量測定建立簡便、綜合的評價體系。
1 材料與儀器
1.1 材料
某品牌粗糧消化餅干(酥性餅干,其配料為:小麥粉、雞蛋、起酥油、麩皮等);某品牌天然酵母面包(配料:小麥粉、飲用水、白砂糖、食用油脂制品、雞蛋、乳粉、酵母等);某品牌燕麥谷物早餐(配料:谷物粉、白砂糖、棕櫚油等)。
1.2 試劑
NaH2PO4、Na2HPO4、硝基四氮唑藍( NBT) 、鹽酸羥胺、乙酸鈉、冰乙酸、正己烷均為分析純,甲醇、甲酸、乙腈均為色譜純。乙二醛、5-羥甲基糠醛(98% HPLC)、糠醛(98% HPLC)、鏈霉蛋白酶E(4 000 000 PU/g)。
1.3 儀器
DSHZ-300多用途水浴恒溫振蕩器;UV-1800紫外-可見分光光度計;Agilent1100高效液相色譜儀;熒光分光光度計-970CRT;TDL-5-A型臺式離心機;DC-P3全自動色差計。
2 實驗方法
2.1 原料預處理
脫脂:將面包、餅干以及谷物早餐室溫通風干燥后,粉碎機粉碎。脫脂方法參照文獻略作修改[15]。稱取10 g樣品,加入 50 mL 正己烷,劇烈震蕩后在 10 000 g/min下離心 15 min,棄去上清液,重復此步驟三次以徹底脫脂。將脫脂后的粉末樣品置于通風櫥中,自然揮干殘留的正己烷。
結合態糖基化產物的分離:根據是否與蛋白質或多肽結合,AGEs 可分為游離態和結合態,兩種形態的 AGEs檢測略有差異。結合態 AGEs 的檢測程序相對復雜,去除脂肪成分后,通常選取鹽酸水解法或酶解法進一步水解蛋白質。文獻報道,鹽酸水解法易引起其他反應的發生,產生雜質,影響后續實驗中 AGEs 的測定[16]。故采用酶解法釋放、分離結合態糖基化產物。根據Roncero-Ramos方法稍作修改[17],將揮發除盡正己烷的樣品1 g,溶于30 mL鏈霉蛋白酶E的溶液中進行酶解,酶解完成后,將酶解液離心,收集上清液過0.45 μm微孔濾膜,待測。為了考察不同酶解條件對結合態糖基化產物的分離的效果,探究了不同酶液濃度(10、20、40、80、160、320、640 μg/mL)、酶解時間(6、12、18、24、36、48 h)對酶解后樣品糖基化產物含量的影響。
2.2 褐變程度的評價——色度測定
色度測定用L*值表示亮度,范圍在0~100之間,L*值越高表明樣品表面越白。a*>0表示紅值、a*<0表示綠值,b*>0表示黃值、b*<0表示藍值。為了能夠深入的研究樣品的美拉德反應的程度,Delgado-Andrade等[18]報道了利用褐色指數(YI)來表示褐變的程度,其公式為:YI=142.86b*/L*
2.3 糖基化反應進程的評價
吸光度的測定:在美拉德反應的初級階段,還原糖的羰基和游離氨基發生反應,生成的物質在可見光范圍內無吸收,因此,將反應初期生成的小分子物質在280 nm下監測其吸光值[19]。隨著美拉德反應的進行,反應中期階段產生的產物可以在360 nm下監測其吸光值,而在反應的末期,由于聚合反應生成大分子物質(類黑精),其在可見光420 nm下可以監測到[20]。因此,美拉德反應的進程可以分別通過測定于280、360、420 nm下的吸光值來分析。
熒光性AGEs 的測定:利用AGEs 具有熒光性的特性,根據文獻所述糖基化反應終產物的測定方法[13],通過熒光光度計進行測定。樣品用PBS 稀釋一定倍數后直接進行熒光值測定,激發波長350 nm,發射波長440 nm,熒光強度以AU/mg 表示。
戊糖素的測定:戊糖素是Amadori 重排產物經過脫氫、重排、交聯等一系列反應,最終生成一種具有熒光性的糖基化終末產物之一。戊糖素具有熒光特性,取各組反應樣液0.2 mL于試管中,用PBS 緩沖液( 0.2 mol /L,pH 8.0) 稀釋至無色后,在在激發波長335 nm、發射波長382 nm處測定其熒光強度,以熒光強度AU/mg 表示[21]。
2.4 中期、末期糖基化反應產物的測定
乙二醛(GO) 的測定:GO 為非酶糖基化反應的初中期產物,是一種簡單的二羰基化合物,利用醛基成肟反應生成的乙二醛二肟的生成量變化反映出GO 的含量變化[21]。測定方法為取各組反應樣液0.5 mL 于50 mL 容量瓶中,加入乙酸鈉溶液(15 g/L)1 mL、鹽酸羥胺溶液(2 g/L)2 mL,于50 ℃恒溫水浴中加熱20 min,冷卻后定容,在233 nm 處測其紫外吸光值。
5-羥甲基糠醛(5-HMF)和糠醛(HMF)測定:5-HMF和HMF是美拉德反應產物。5-HMF 是美拉德反應中期Amadori 重排產物經烯醇化后脫水形成的醛類化合物,為中期產物生成的另一種途徑。采用液相色譜儀測定5-羥甲基糠醛和糠醛的含量。分別用蒸餾水配制一系列質量濃度(10、20、40、50、60 μg/mL)的5-HMF和HMF的標準液,經過0.45 μm的水系微孔濾膜過濾后進樣,繪制5-HMF和HMF的標準曲線。
色譜條件:反向色譜柱Agilent Zorbax XDB-C18(150 mm×4.6 mm i.d., 5 μm);測定5-HMF流動相為甲醇 ∶水=90 ∶10,流速0.6 mL/min;測定HMF流動相為乙腈 ∶水(0.1%甲酸)=2 ∶98,流速 1 mL/min。 進樣量20 μL,檢測波長280 nm,柱溫35 ℃。
2.5 數據分析
所有實驗均進行3次重復,數據以平均值±標準差表達。利用SPSS 數據處理軟件進行分析,P<0.05差異顯著。
3 結果與分析
3.1 酶解參數對谷物食品結合態AGEs分離效果的影響
3.1.1 酶濃度對結合態AGEs分離效果的影響
根據是否與蛋白質或多肽結合,AGEs 還可分為游離態和結合態,兩種形態的 AGEs檢測略有差異。對樣品去除脂肪成分后,通過蛋白酶進行水解,將結合態 AGEs 進行釋放進行檢測。
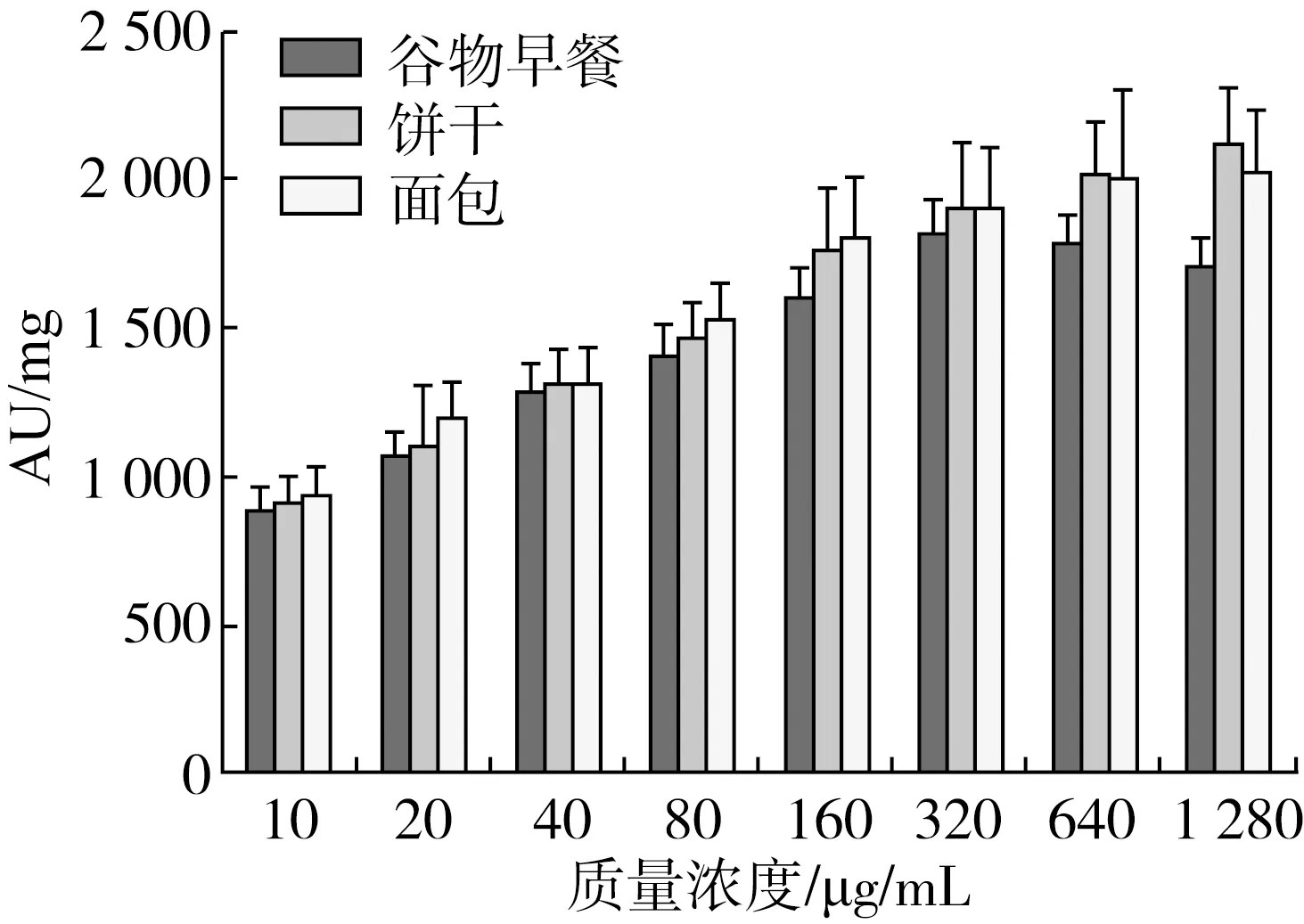
圖1 不同酶濃度對谷物食品熒光性AGEs 含量的影響
由圖1可知,隨著酶濃度的增加,谷物食品(谷物早餐、餅干和面包)中熒光性AGEs 含量隨之增加。其中,當酶濃度為320 μg/mL,谷物早餐中熒光性AGEs 含量最大,為1 810 AU/mg;當酶濃度為640 μg/mL后,繼續增加酶濃度,餅干和面包中的熒光性AGEs 含量增加緩慢(P>0.05),因此,谷物早餐的酶解濃度為320 μg/mL,餅干和面包的酶解濃度均為640 μg/mL。AGEs 是多種分子結構不同物質的總稱。具有交聯及產生熒光的特性。但羧甲基賴氨酸、羧乙基賴氨酸和吡咯素等AGEs 無熒光性,因此熒光性只能反映部分AGEs 的含量[22]。因此,需要對糖基化反應產物進行全面的表征,應采取不同的測定方法。
由表1可知,不同酶濃度處理的谷物食品,L*值均在10~30之間,隨著酶濃度的升高,L*降低,即谷物食品的亮度值更接近黑色方向,表明谷物食品發生了明顯的褐變反應。而a*值、b*值和YI值隨之增加,表明糖基化產物的增加,可見,當酶濃度為320~640 μg/mL時,結合態的AGEs釋放較為充分。
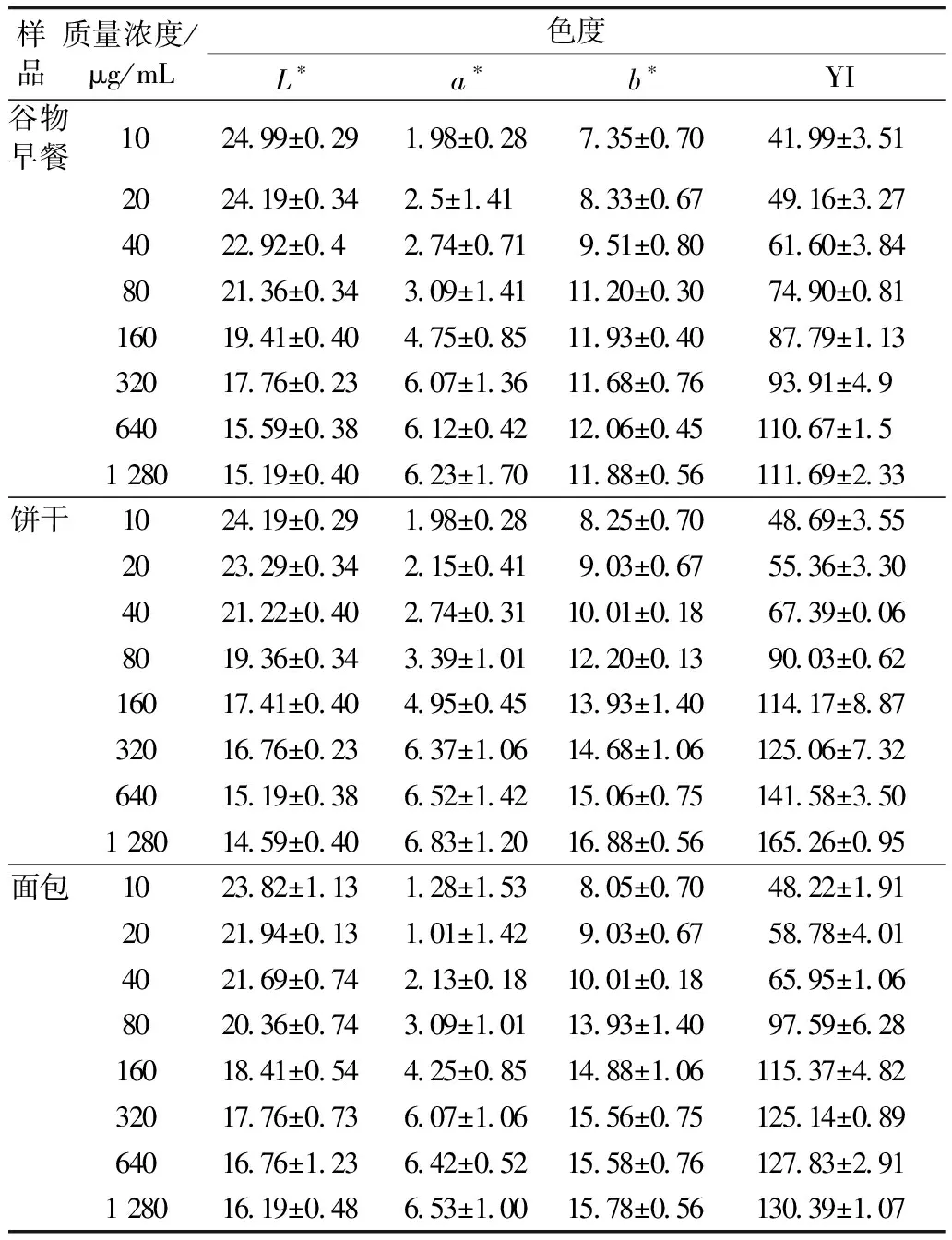
表1 不同酶濃度對谷物食品色度的影響
3.1.2 酶解時間對結合態AGEs分離效果的影響
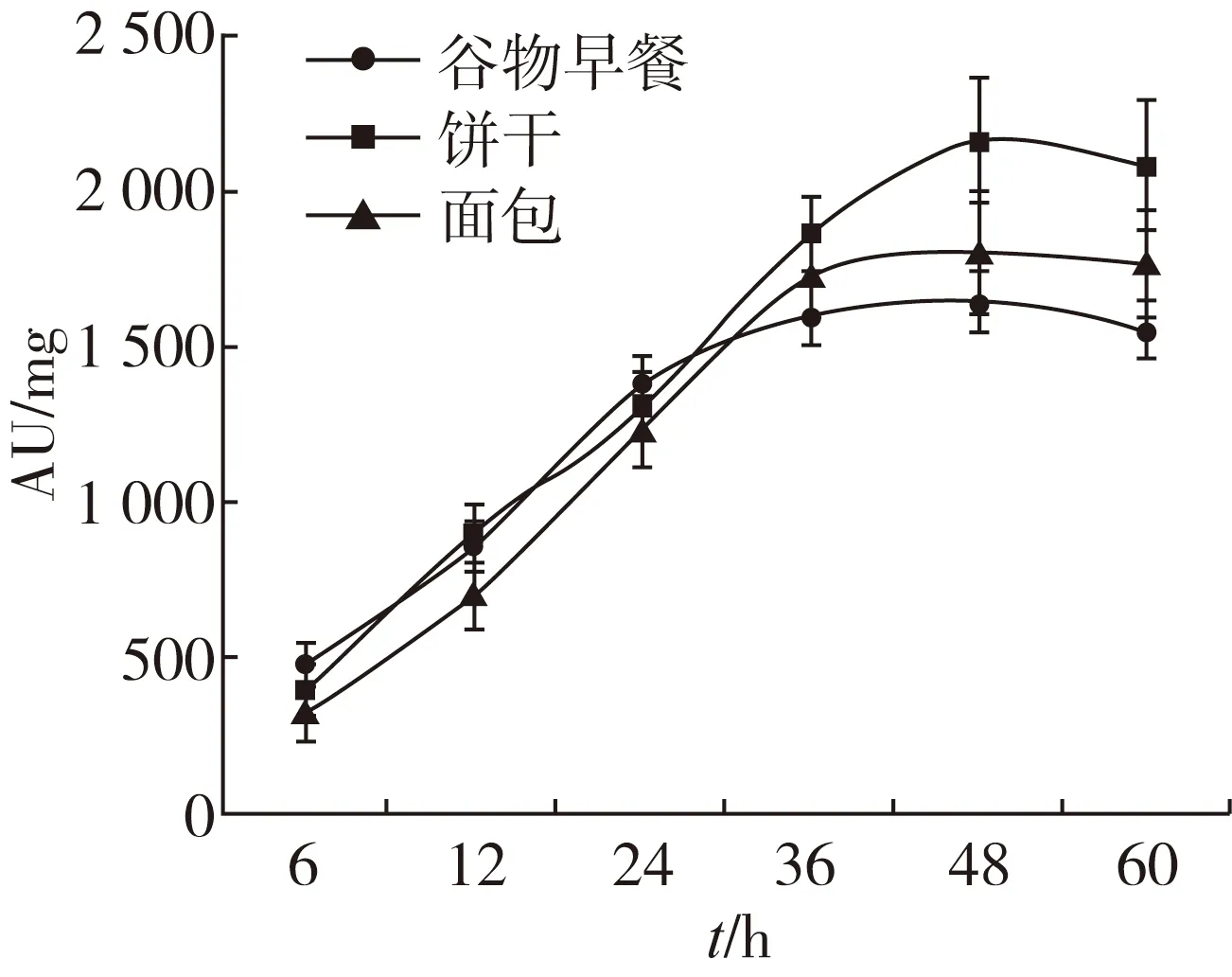
圖2 不同酶解時間對谷物食品熒光性AGEs 含量的影響
由圖2可知,隨著酶解時間的增加,谷物食品(谷物早餐、餅干和面包)中熒光性AGEs 含量隨之增加,當酶解時間達到36 h,谷物早餐、餅干和面包中熒光性AGEs含量趨于穩定,分別為1 600、1 860和1 726 AU/mg,由此可見,谷物食品的酶解時間為36 h,酶解較為充分。
由表2可知,隨著酶解時間的增加,L*降低,而a*值、b*值和YI值隨之增加,表明通過酶解反應的進行,結合態AGEs釋放的愈加充分,從而反映出谷物食品褐變程度加劇。可見,最佳的酶解時間為36 h。
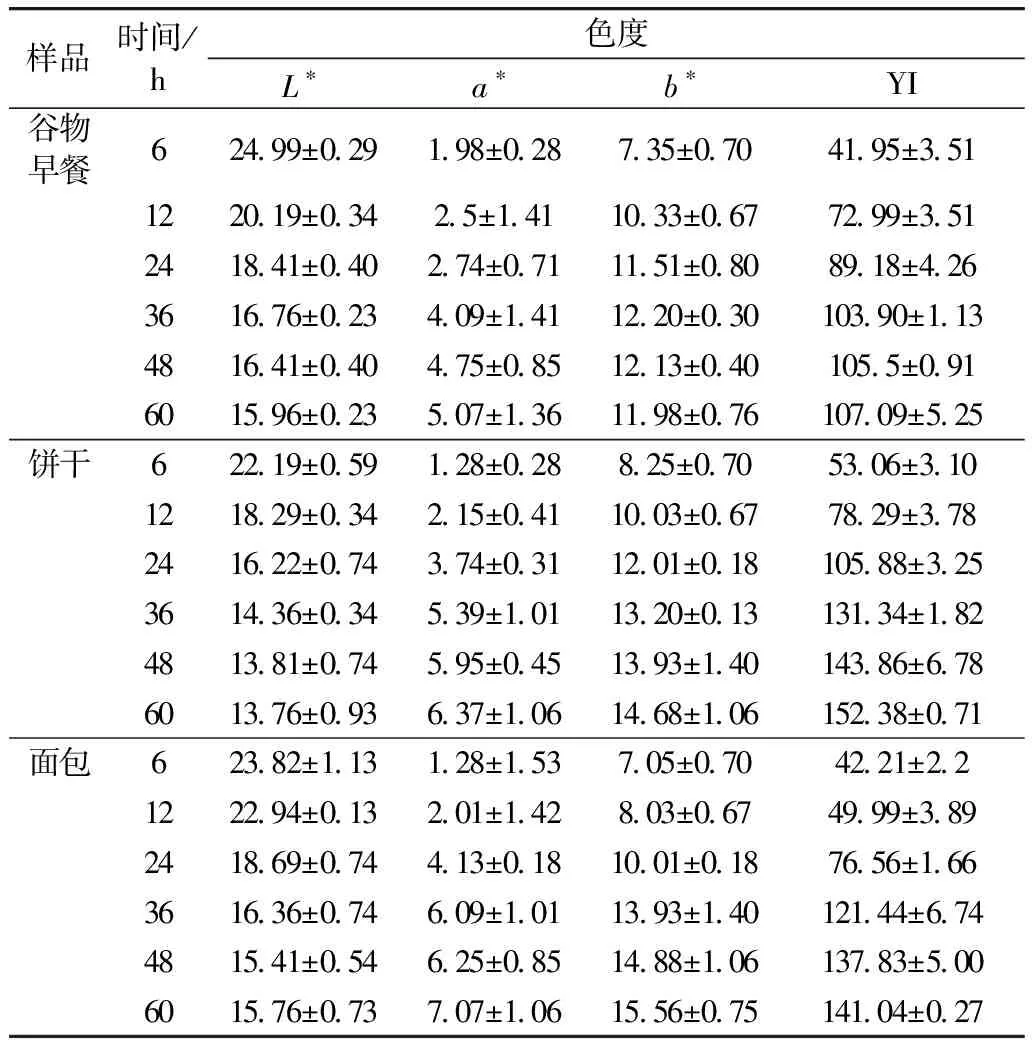
表2 不同酶解時間對谷物食品色度的影響
3.2 谷物食品糖基化產物的含量測定
3.2.1 美拉德反應產物的測定
5-HMF是由還原糖在酸性環境下,經過Amadori反映后形成的環狀化合物。HMF是糖的降解產物或者Amadori反應的產物。利用HPLC建立了5-HMF、HMF的測定方法。其樣品測定譜圖如圖3所示。該測定方法,5-HMF和HMF標準溶液均在10~60.0 μg/mL質量濃度范圍內呈良好線性,相關系數(r)均大于0.99。添加水平為50、100 μg/kg時,平均回收率為90.6%~93.3%。
3.2.2 糖基化反應產物的測定
由表3可知,早餐谷物、面包和餅干色度依次增加,表明餅干的褐變程度強于面包和谷物早餐。李曉琳[23]通過實驗發現,與面包芯相比,面包皮更偏向黑色、紅色、黃色方向,這表明面包皮褐變程度最高,面包皮的美拉德反應程度高于面包芯。面包面團在焙烤的過程中,表面溫度高達 230~250 ℃,導致面團表面水分蒸發,面包表面發生美拉德反應,生成 AGEs[23]。餅干的褐變程度高于面包,主要是由于其加工工藝以及添加物有關,有報道指出,餅干、面包、谷物早餐中添加的其他成分(水果、NaCl或膳食纖維),其添加種類和數量的差異顯著影響其美拉德反應的程度[24-26]。據文獻報道,測定280、360、420 nm處的吸光值分別表示美拉德反應早期,中期和末期產物的含量[18]。由表3可知,早餐谷物中美拉德反應初期產物積累較多,其含量顯著高于餅干和面包中含量(P<0.05),而面包和餅干其積累的美拉德中期和末期反應產物顯著高于早餐谷物中(P<0.05),此結果與熒光性AGEs和戊糖素的積累量相似。


圖3 5-HMF和HMF含量測定的HPLC圖

表3 谷物食品糖基化反應進程及其產物含量
由表4可看出,糖基化反應初中期產物(丙二醛、5-HMF)主要反映在早餐谷物和面包中。而中后期產物5-HMF、HMF主要積累在面包和餅干,其含量顯著高于早餐谷物(P<0.05),食品的顏色變化主要發生在美拉德反應的后期,蛋白質和糖類反應生成的黃色或棕色與美拉德反應的中間或末期產物有關[27]。這是因為糠醛很活潑,容易與其他物質發生反應。在美拉德反應的末期階段,會發生一系列反應包括:環化、脫水、重排,異構化和聚合,最終形成含氮的棕色聚合物或共聚物,類黑精[28],此現象也反映在420 nm吸光值以及色度(表3)。
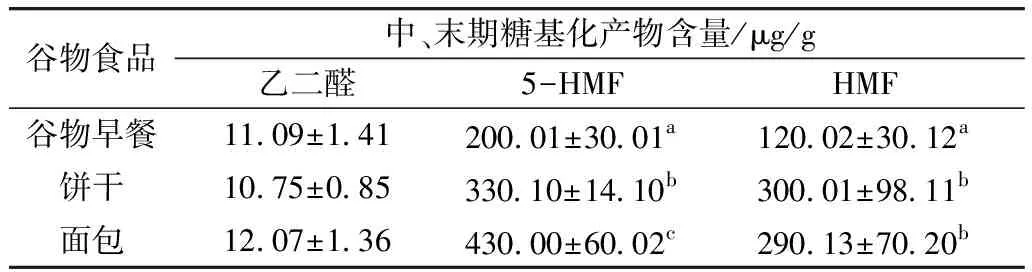
表4 谷物食品中、末期糖基化產物含量
4 結論
本研究優化了不同酶濃度和酶解時間對谷物早餐、餅干和面包的前處理方法,通過色度和吸光度的測定,表征谷物食品褐變程度,以此反映美拉德反應產物的含量,通過熒光強度的測定,表征了熒光性AGEs產物的含量,通過建立5-HMF和HMF的測定方法,表征了糖基化不同反應時期的產物的含量。通過以上定性和定量方法的建立,焙烤類谷物食品中熒光性晚期糖基化終產物(AGEs)含量依次為:餅干(1 890 AU/mg)、面包(1 886 AU/mg)、谷物早餐(1 678 AU/mg)。餅干中戊糖素、5-HMF和HMF含量分別為1 450 AU/mg、300.1 μg/g和300.01 μg/g,面包中戊糖素、5-HMF和HMF含量分別為:1 278 AU/mg、430 μg/g和290.13 μg/g,而早餐谷物中初期(A208)、中期糖基化產物(A360)吸光值顯著高于餅干和面包(P<0.05),因此,初期糖基化反應產物在早餐谷物中含量豐富,中期和末期糖基化反應產物在面包和餅干中含量豐富。 本研究建立了系統測定糖基化產物的檢測體系,該體系可以簡便、全面、綜合的表征不同反應途徑和反應程度的糖基化產物的含量。

