淡紫擬青霉TD16促進雨生紅球藻生長和油脂合成的研究
董慶霖,王 瑤,邢向英,崔江坤,王雪晴
(河北工業大學化工學院,天津 300130)
雨生紅球藻是一種高附加值的單細胞綠藻,在脅迫狀態下能夠大量合成蝦青素和油脂[1]。雨生紅球藻油脂的脂肪酸組成主要為棕櫚酸、油酸和亞麻酸等,可作為生物柴油的理想原料[2-3]。為提高雨生紅球藻用于生物柴油生產的經濟性和可持續性[4],通常采用油脂和蝦青素聯產工藝[5-6],但此工藝需要在脅迫條件下誘導油脂和蝦青素合成,降低了雨生紅球藻的生長速率,故油脂平均比合成速率依然較低。因此,如何同時提高生物量和油脂的平均合成速率,是雨生紅球藻用于生產生物柴油過程中所必須解決的關鍵問題。
自然界中微藻通常與其他微生物共生,兩者間的相互作用可影響藻細胞的生長及組成[7],許多微生物對微藻生長和油脂積累具有促進[8-15]或抑制作用[16-17]。目前,微藻-真菌混合培養的研究大多集中于絲狀真菌促進藻細胞沉降從而降低采收成本[18],而絲狀真菌對微藻生長和油脂合成的研究相對較少。
淡紫擬青霉TD16(以下簡稱TD16)是從藍藻培養液中分離的一種絲狀真菌[19],TD16可促進植物種子萌發以及葉片根系生長[20]。由于微藻和植物都是光合生物,因此本實驗將雨生紅球藻與TD16混合培養以研究TD16對雨生紅球藻細胞生長和油脂合成的影響。
1 材料與方法
1.1 實驗材料
1.1.1 藻種及培養基
雨生紅球藻,購自中國科學院武漢水生生物研究所,于BBM培養基中培養;淡紫擬青霉TD16,由本實驗室分離并保存于中國科學院微生物研究所菌物標本館,于PDA培養基中培養。
BBM液體培養基:硝酸鈉250 mg/L,磷酸二氫鉀175 mg/L,硫酸鎂75 mg/L,磷酸氫二鉀75 mg/L,乙二胺四乙酸二鈉50 mg/L,氫氧化鉀31 mg/L,氯化鈉25 mg/L,氯化鈣25 mg/L,硼酸11.4 mg/L,硫酸鋅8.82 mg/L,硫酸鐵4.98 mg/L,鉬酸鈉1.79 mg/L,硫酸銅1.57 mg/L,硝酸鈷0.49 mg/L。
PDA培養基:馬鈴薯200 g/L,無水葡萄糖20 g/L,瓊脂20 g/L。
1.1.2 儀器與設備
LG16-B臺式高速離心機,723N可見分光光度計,GXZ-300D光照培養箱,X-521無菌工作臺,TDA-8002恒溫水浴鍋,DH-101-0S電熱恒溫鼓風干燥機,HZQ-QG全溫振蕩器,XSZ-H光學顯微鏡,YX280加壓滅菌鍋,LRH-150S恒溫恒濕培養箱,Multi N/C 3100有機碳分析儀,JP-020超聲波清洗機。
1.2 實驗方法
1.2.1 無菌雨生紅球藻藻種的制備
將納他霉素、慶大霉素按10 mg/L和100 mg/L加至雨生紅球藻培養液中,于25℃、光照強度60 μmol/(m2·s)下靜置培養14 d。將培養結束后的藻液稀釋105個/mL,取100 μL涂布至BBM平板上,重復多次得到無菌藻落,將無菌藻落接種至BBM液體培養基中培養,用于后面的單獨培養和混合培養。
1.2.2 雨生紅球藻細胞密度及胞外有機碳質量濃度的測定
取10 mL濃度為0.34×107個/mL的雨生紅球藻無菌藻液,將其接種至100 mL BBM液體培養基中,于25℃、光照強度60 μmol/(m2·s)下靜置培養。隔天取1 mL無菌藻液,用光學顯微鏡和血球計數板測定藻細胞個數。另取5 mL藻液于8 000 r/min離心5 min,上清通過0.2 μm濾膜過濾除菌,用有機碳分析儀測定胞外有機碳(Extracellular organic carbon,EOC)的質量濃度。測定條件為:載氣為超純氧氣,壓力0.3 MPa,溫度1 100℃。
1.2.3 TD16在雨生紅球藻EOC中的生長
將TD16接種于PDA固體培養基,28℃下培養5 d,用20 mL無菌水沖洗斜面,過濾菌絲,得到TD16孢子懸浮液。將培養14 d的雨生紅球藻無菌藻液離心,上清通過0.2 μm濾膜過濾除菌,與等體積BBM液體培養基混合,對照組為BBM液體培養基,接種100 μL TD16孢子懸浮液,28℃、110 r/min搖床培養。用有機碳分析儀測定EOC質量濃度的變化,TD16的生長情況由OD580表示。
1.2.4 雨生紅球藻單獨培養及與TD16混合培養
用血球計數板將培養5 d即生長到對數期的雨生紅球藻藻細胞濃度調整至1×107個/mL、TD16孢子懸浮液濃度調整至1.36×107個/mL。取10 mL藻液分別與2、1、0.5 mL TD16孢子懸浮液按5∶ 1、10∶ 1、20∶ 1體積比接種至100 mL BBM液體培養基,用BBM液體培養基將接種量補齊至12 mL。對照組加10 mL藻液與2 mL BBM液體培養基,于25℃、光照強度60 μmol/(m2·s)下靜置培養,每日手搖3次,每組設3個平行。
1.2.5 生物量、平均生長速率、平均比生長速率和倍增時間的測定
生物量即細胞干重的測定參考Cho等[21]的方法并加以改動。向混合培養液中加入質量分數為2%的十二烷基硫酸鈉超聲并低速離心,使藻細胞與菌絲分離,烘干稱得藻細胞干重。平均比生長速率(μ)、平均生長速率(r)和倍增時間(DT)[22]由下式計算。
(1)
(2)
(3)
式中:X0和Xn分別為微藻細胞在培養時間t0和tn時的藻細胞干重,g/L。
1.2.6 雨生紅球藻油脂含量及脂肪酸組成分析
取25 mg烘干研磨后的藻粉懸浮于5 mL氯仿-甲醇(體積比2∶ 1)提取液中,在100 Hz下超聲提取10 min,然后8 000 r/min離心10 min,重復提取分離3次,合并氯仿相,揮干溶劑,烘干稱重,計算油脂含量。油脂平均合成速率(r1)、平均比合成速率(q)[22]由下式計算。
(4)
(5)
式中:X0、G0和Xn、Gn分別為雨生紅球藻在培養時間t0和tn時的生物量和油脂含量。
將2 mL 1%硫酸-甲醇溶液加入烘干至恒重的油脂中,80℃水浴鍋中加熱60 min,取出冷卻至室溫,加入5 mL去離子水和2 mL正己烷,8 000 r/min離心10 min,收集上清液。沉淀加入1 mL正己烷繼續提取,離心將2次上清液合并,氮氣吹干。用0.5 mL正己烷重新溶解,經0.2 μm濾膜過濾,用氣相色譜儀分析脂肪酸組成。色譜條件:DB-23(安捷倫)毛細管柱;起始溫度為80℃,采用程序升溫以12℃/min升至140℃,再以4℃/min升至240℃,保持20 min;進樣口溫度250℃;檢測器溫度280℃;載氣流量80 mL/min;進樣量1 μL。
1.2.7 硝態氮質量濃度測定[23]
將硝酸鈉標準品烘干至恒重,配制成質量濃度為0、50、100、150、200、250、300 mg/L的標準溶液,分別取0.1 mL 于試管中,加入0.4 mL 5%的水楊酸-濃硫酸溶液,于室溫下顯色25 min后向其中加入9.5 mL 8%的氫氧化鈉溶液,搖勻,冷卻至室溫,測定410 nm下的吸光度,以硝酸鈉質量濃度(X)為橫坐標,吸光度(Y)為縱坐標,繪制標準曲線,經擬合得回歸方程Y=0.096 62X-0.010 26。
將雨生紅球藻培養液離心,取0.1 mL上清液于試管中,按上述方法測定410 nm下的吸光度,通過硝酸鈉標準曲線回歸方程求出硝態氮質量濃度。
1.2.8 葉綠素a質量濃度的測定
參照Wellburn[24]的方法。取2 mL雨生紅球藻培養液,離心棄上清,將微藻細胞懸浮于90%的甲醇溶液中,于50℃水浴30 min,8 000 r/min離心10 min,收集上清液。以90%甲醇為對照,測定上清液于652 nm和665 nm處的吸光度(A),通過式(6)得出葉綠素a的質量濃度(Chla)。
Chla=16.82×A665-9.28×A652
(6)
1.2.9 蝦青素質量濃度和含量的測定
蝦青素質量濃度的測定參考文獻[25]。取5 mL樣品,于5 000 r/min下離心10 min,棄上清,將藻細胞懸浮于含有5 g/100 mL KOH的3 mL甲醇中,于70℃水浴加熱5 min,離心去上清(除葉綠素)。用5 mL二甲基亞砜提取至藻細胞無色,測定提取物在490 nm處的吸光度(OD490),用下式計算蝦青素的質量濃度(C)。所有步驟均在黑暗中進行。蝦青素含量=蝦青素質量濃度/生物量。
C=(4.5×OD490×Va)/Vb
(7)
式中:Va為二甲基亞砜的體積;Vb為雨生紅球藻樣品的體積。
2 結果與討論
2.1 雨生紅球藻EOC的變化及TD16代謝EOC進行生長的情況
藻細胞在光合自養過程中會分泌EOC[16]。雨生紅球藻細胞密度和EOC質量濃度的變化如圖1所示,TD16利用雨生紅球藻EOC生長和EOC質量濃度變化如圖2所示。
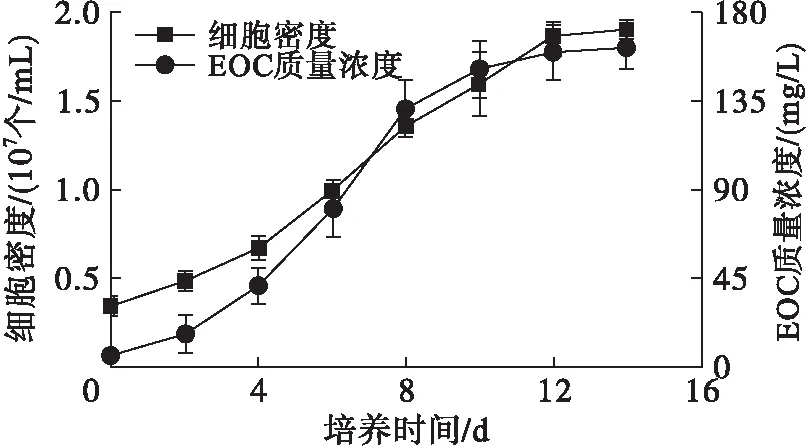
圖1 雨生紅球藻細胞密度及EOC質量濃度的變化
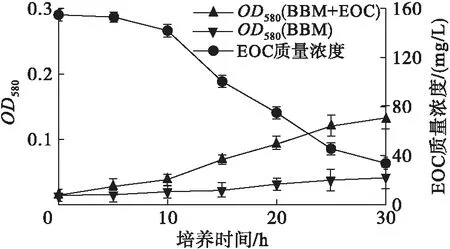
圖2 TD16在EOC中的生長及EOC質量濃度的變化
由圖1可見,雨生紅球藻EOC質量濃度隨藻細胞生物量的增加而增加,當藻細胞生長進入到穩定期,EOC質量濃度也逐漸趨于平穩,最大值為162.33 mg/L。由圖2可見,TD16與雨生紅球藻混合培養,TD16的生物量隨培養時間延長不斷增加,且隨著TD16的生長EOC質量濃度不斷降低,表明藻細胞分泌的EOC可以被TD16利用,為TD16與雨生紅球藻在光合自養條件下混合培養提供了基礎。
2.2 雨生紅球藻與TD16接種比例的確定
藻菌混合比例是影響體系中微藻生長的重要因素,本研究設置3組不同藻菌比(體積比)以確定最佳混合比例,結果如表1所示。
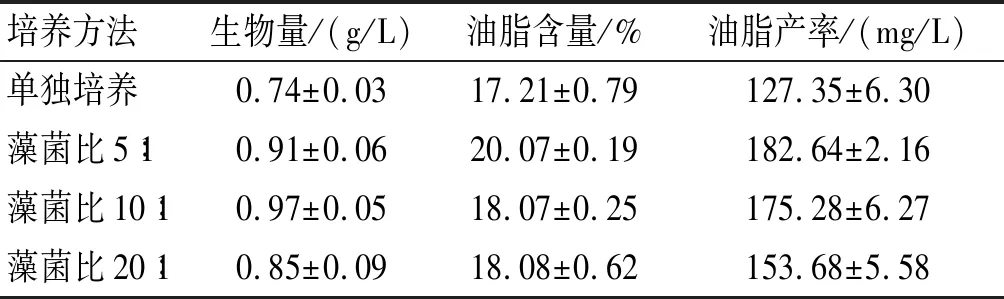
表1 藻菌比對雨生紅球藻生物量、油脂含量和油脂產率的影響
注:培養時間14 d。
由表1可見:混合培養與單獨培養相比,藻菌比為10∶ 1時對生物量的促進作用最明顯,此時生物量為0.97 g/L,比單獨培養提高31.08%;藻菌比為5∶ 1時油脂含量提高明顯,為20.07%,比單獨培養提高16.62%;油脂產率在藻菌比為5∶ 1時最高,達到了182.64 mg/L。因此,為提高油脂產率,以下實驗均采用藻菌比5∶ 1進行研究。
2.3 雨生紅球藻生物量和動力學參數的變化
雨生紅球藻單獨培養和與TD16混合培養過程中生物量的變化如圖3所示,藻細胞生長的動力學參數如表2所示。
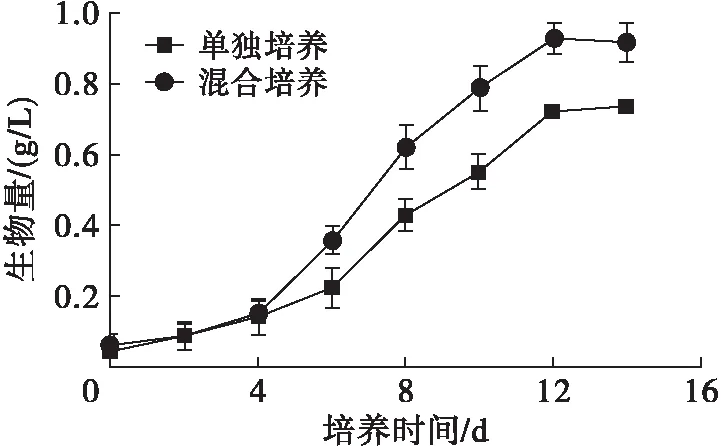
圖3 雨生紅球藻生物量的變化
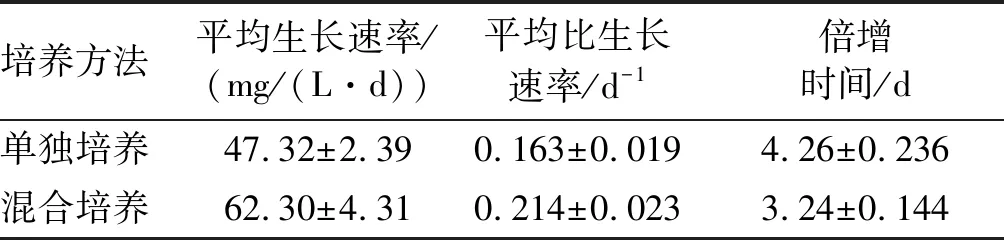
培養方法平均生長速率/(mg/(L·d))平均比生長速率/d-1倍增時間/d單獨培養47.32±2.390.163±0.0194.26±0.236混合培養62.30±4.310.214±0.0233.24±0.144
注:培養時間14 d。
由圖3可見,藻細胞生物量從第4天開始迅速增加,培養結束后,混合培養生物量為0.92 g/L,比單獨培養提高24.32%。由表2可見,混合培養中平均生長速率和平均比生長速率與單獨培養相比分別提高31.66%和31.29%,倍增時間縮短了23.94%。混合培養雨生紅球藻生物量提高的原因可能是TD16分泌促生長因子促進了藻細胞的的生長。Voinove等[26]發現淡紫擬青霉可以分泌植物激素β-吲哚乙酸(IAA),但楊婷等[27]提出淡紫擬青霉的促生長活性因子不是IAA。我們前期實驗證明TD16發酵液可明顯促進植物生長[20],經硫酸銨分級沉淀和SDS-PAGE確定促生長因子為蛋白類物質。與此一致,夏漢祥等[28]發現淡紫擬青霉對菜心種子生長具有顯著的促進作用,并確定其產生的類植物生長素為水溶性蛋白質。此外,雨生紅球藻單獨培養過程中由于光合作用導致培養液中O2濃度上升而CO2濃度下降,二者均導致光合作用效率下降[25],與其他藻-菌混合培養相似[6,22,25],混合培養過程中TD16吸收O2釋放CO2,并且TD16的菌絲有利于藻細胞附著,提高了菌絲和藻細胞之間的氣體傳質效率[16],促進了光合作用。
2.4 培養液中硝態氮質量濃度的變化
雨生紅球藻單獨培養和與TD16混合培養培養液中硝態氮質量濃度的變化如圖4所示。
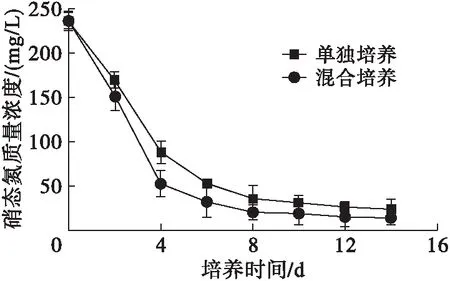
圖4 培養液中硝態氮質量濃度的變化
由圖4可見,混合培養和單獨培養培養液中硝態氮質量濃度均在培養前期迅速下降,到第4天分別下降了77.85%和62.79%,第4天后緩慢下降,另外混合培養硝態氮質量濃度的下降速度明顯快于單獨培養,說明混合培養過程中TD16提高了硝態氮的代謝速率。
2.5 培養液pH的變化
用pH計測定了雨生紅球藻單獨培養和與TD16混合培養過程中培養液pH的變化,結果如圖5所示。

圖5 培養液中pH的變化

2.6 雨生紅球藻葉綠素a質量濃度的變化
為了研究油脂合成與光合作用的關系,測定了雨生紅球藻單獨培養和與TD16混合培養葉綠素a質量濃度的變化,結果如圖6所示。
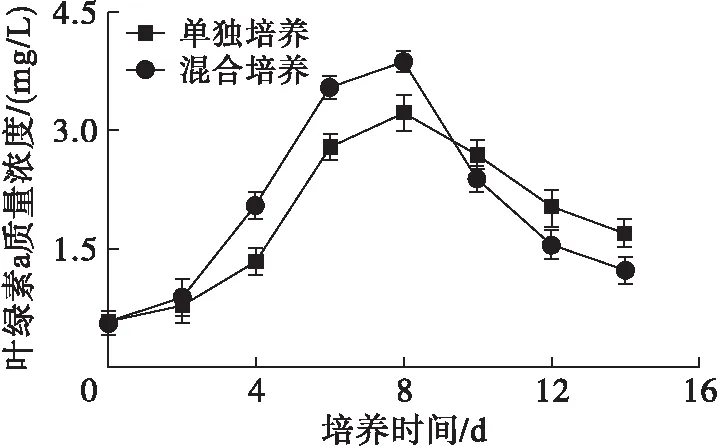
圖6 雨生紅球藻葉綠素a質量濃度的變化
2.7 雨生紅球藻油脂參數分析及脂肪酸組成的變化
培養14 d雨生紅球藻油脂含量、油脂產率和動力學參數如表3所示,脂肪酸組成分析結果如表4所示。

表3 雨生紅球藻油脂含量、油脂產率和動力學參數的分析
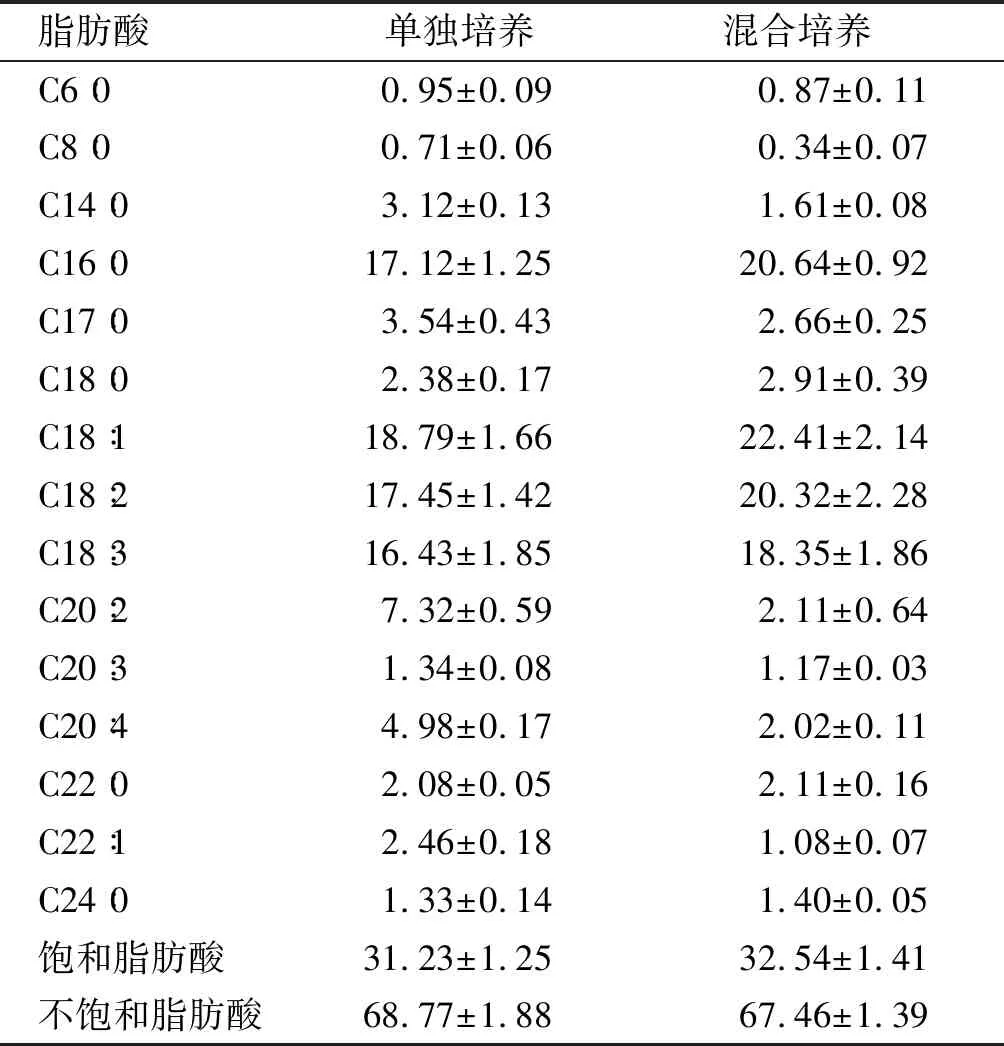
表4 雨生紅球藻脂肪酸組成及含量 %
由表3可見,混合培養與單獨培養相比雨生紅球藻的油脂含量、油脂產率、平均合成速率和平均比合成速率分別提高了16.97%、45.59%、45.64%和16.67%。混合培養過程中油脂產率的提高主要歸因于兩個方面,即生物量的提高和油脂合成速率的提高,后者的提高主要是由于混合培養過程中氮質量濃度的快速下降導致的氮饑餓和TD16釋放CO2提高了反應體系中CO2的濃度,二者均能提高油脂的合成速率[25]。
由表4可見,兩種培養方法雨生紅球藻油脂中脂肪酸組成基本相同,主要組分都為十六碳和十八碳脂肪酸,占總脂肪酸的72.17%~84.63%。混合培養與單獨培養相比,飽和脂肪酸從31.23%上升為32.54%,不飽和脂肪酸從68.77%下降為67.46%,其中C16∶ 0和C18∶ 1分別提高20.56%和19.27%,脂肪酸含量的改變可能是因為培養液中CO2和胞外有機物濃度的變化引起的[30]。
2.8 雨生紅球藻蝦青素的質量濃度和含量的變化
蝦青素是脂溶性次級產物,當培養液中硝態氮含量趨于0時才開始合成,為了研究油脂含量提高的同時蝦青素的變化,測定培養8 d后蝦青素的質量濃度和含量,結果如圖7所示。

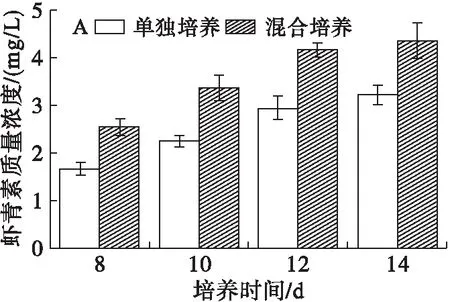

圖7 雨生紅球藻蝦青素的質量濃度和含量
3 結 論
本研究確定了雨生紅球藻與TD16混合培養的最佳接種比例,并證明混合培養過程中TD16能夠穩定pH、促進氮代謝和葉綠素的合成,提高雨生紅球藻的生物量、油脂產率、油脂平均合成速率和蝦青素含量。因此,雨生紅球藻與TD16混合培養為生物柴油的生產提供了一種新的反應模式。

