裂殖壺菌合成二十二碳六烯酸機理研究進展
楊 浩,金小琬,唐嘉淇,黃健庭,陳天曉,楊雪薇,黎雙飛
(深圳大學生命與海洋科學學院,廣東省植物表觀遺傳學重點實驗室,廣東 深圳 518055)
二十二碳六烯酸(DHA)屬于ω-3不飽和脂肪酸家族中的重要成員,含有多個順式的“戊碳雙烯”結構和5個活潑的亞甲基[1]。DHA對人體的生理調節和保健具有重要作用。DHA是大腦細胞膜的重要構成成分,可輔助腦細胞發育,對神經細胞軸突的延伸和新突起的形成有重要作用,能延緩大腦及神經衰老。研究表明,高齡大鼠腦內的DHA水平低于幼齡鼠,隨著腦內DHA水平的恢復,高齡大鼠學習與記憶的能力可提高至接近幼齡鼠[2]。此外,DHA還能抑制血小板聚集,使血栓形成受阻、血液黏度下降,改善血液循環,治療高脂血癥、動脈粥樣硬化[3]。DHA可以通過抑制類花生酸的生物合成、調控信號傳導通路、影響轉錄因子和基因表達、增強脂質過氧化等方法,抑制細胞內信號傳導途徑,誘導其分化、凋亡,提高患者的存活率,對多種癌細胞發揮抑制效應[4]。
DHA的主要來源是深海魚油(金槍魚油,松魚油[5])。然而,深海魚油產品存在一定缺陷:①市售魚油中的DHA結構屬于乙酯型,對于嬰兒來說,這種DHA的結構不能被很好吸收與利用[6];②魚油中DHA與EPA的比例約4∶ 1,該比例能達到最佳的抗動脈粥樣硬化效果[7],但不利于嬰幼兒的生長發育[6];③產品的魚腥味讓眾多消費者難以接受。相比動物來源,從海洋真菌(如破囊壺菌、裂殖壺菌)中獲取的DHA具有獨特優勢:①微藻類與菌類中所獲取的DHA均為甘油三酯型,對消化酶的抗性較高,更利于人體吸收利用;②無特殊氣味,其安全性較高,其DHA與EPA的比例大于20∶ 1,不會對花生四烯酸產生競爭性抑制,更適合嬰幼兒的使用[6]。與微藻相比,通過裂殖壺菌與破囊壺菌高密度發酵既可以提高產量,生長速度也較快,不飽和脂肪酸組成較少,是極具工業前景的DHA來源[8]。
1 裂殖壺菌合成DHA的主要途徑研究
1.1 聚酮合成酶(Polyketide synthase,PKS)途徑
聚酮合成酶(Polyketide synthase,PKS)途徑最早發現于產EPA的海洋細菌ShewanellapneumatophoriSCRC-2378中。隨后Mertz等通過同位素標記法,得出DHA和EPA是由一個類似聚酮合成酶的基因簇催化而成的,稱為聚酮合成酶(PKS)途徑[9]。PKS途徑有如下幾個階段:①脂酰-ACP與丙二酸單酰-ACP在3-酮脂酰-ACP合成酶的作用下縮合生成3-酮脂酰-ACP;②3-酮脂酰-ACP在3-酮脂酰-ACP還原酶作用下加氫還原生成3-羥脂酰-ACP;③3-羥脂酰-ACP在烯脂酰-ACP-脫水酶/異構酶的作用下脫去H2O引入雙鍵生成烯脂酰-ACP;④烯脂酰-ACP在烯脂酰-ACP-還原酶(ER)作用下脫氫生成酮脂酰-ACP[10]。裂殖壺菌體內PKS途徑合成DHA如圖1所示。
目前,部分裂殖壺菌PKS合成途徑中的相關基因實現了克隆、重組和外源表達。李清[12]分別對裂殖壺菌OUCl68的pks1和pks2基因進行了克隆,結果表明:pks1基因屬于PKS途徑8個酶域中的脫水/異構酶(DH);pks2基因整個序列包含兩個Ketoacyl-synthase的超家族,一個Acyl transferase超家族,一個TIM_phosphatebinding超家族。周兵兵[13]通過電轉化將含有丙二酰轉移酶基因的重組質粒轉入裂殖壺菌AurantiochytriumlimacinumOUC168,獲得了裂殖壺菌pks1基因部分酶域過表達菌株,轉化菌株生物量提高14.6%,DHA含量提高37.90%。李志平等[14]對裂殖壺菌Schizochytriumsp.FJU-512酰基載體蛋白(ACP)基因的克隆載體pET-30a/acp,實現了在大腸桿菌中的成功表達。婁菲等[15]研究發現,低溫發酵使裂殖壺菌S31的PFA1、PFA2、PFA3基因表達水平增長,促進了PKS途徑,提高油脂中不飽和脂肪酸的含量。Huang等[16]對裂殖壺菌的cDNA文庫中8 500多個基因進行克隆測序,發現了3個與PKS具有重大相關性的多功能域酶,這些基因以中至高豐度表達。Cheng等[17]克隆了來自Schizochytriumsp.TIO1101的酰基載體蛋白轉酰酶(fabD,MCAT,EC2.3.1.39)的cDNA全長,MCAT可以在體外與丙二酰輔酶A結合并催化丙二酰基與ACP結構域結合,生物量和脂肪酸積累分別增長了16.8%和62%。綜上所述,通過將裂殖壺菌PKS合成途徑中的關鍵作用酶,如丙二酰轉移酶、酰基載體蛋白等基因重組到裂殖壺菌中,可顯著提高DHA合成,這為基因工程構建高效合成DHA的優勢菌株提供了重要思路。
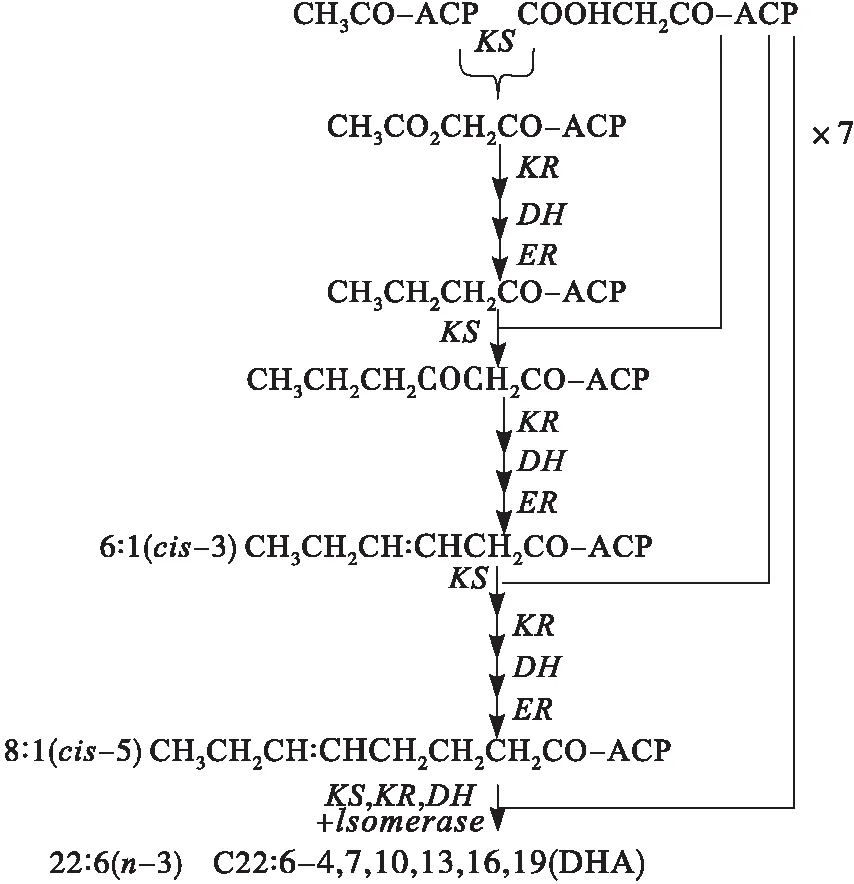
圖1 裂殖壺菌體內PKS途徑合成DHA示意圖[11]
1.2 脂肪酸合成酶(Fatty acid synthase,FAS)途徑
脂肪酸合成酶(Fatty acid synthase,FAS)是一個由多種酶構成的多酶復合體,在FAS的作用下,乙酰輔酶A和丙二酸單酰輔酶A經過縮合、還原、脫水、還原的循環,催化合成軟脂酸(16∶ 0),以酰基載體蛋白作為延長碳鏈的共價位點,再經碳鏈延長酶作用,最終分別形成二十碳四烯酸(ARA)、二十二碳五烯酸(DPA)或二十碳五烯酸(EPA)、DHA等多不飽和脂肪酸[18]。催化脂肪酸生物合成的酶系具有兩種類型FASⅠ和FASⅡ,FASⅠ存在于哺乳動物和酵母中,其中全部的酶活性都分別編碼在一條多肽鏈上,每一步脂肪酸合成反應都是由這個大的蛋白的不同功能域催化完成;FASⅡ存在于細菌和植物中,是由一系列小的分離的蛋白組成,每一步脂肪酸合成反應均是由截然不同的單功能酶催化完成的[19]。微生物體內PUFAs的傳統脂肪酸合成途徑如圖2所示。
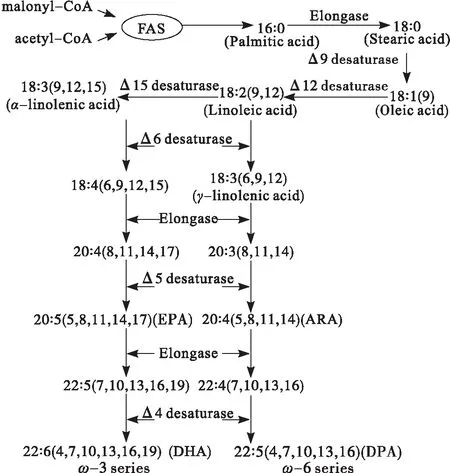
圖2 微生物體內PUFAs的傳統脂肪酸合成途徑(FAS system)示意圖[11]
陳偉[20]比較了葡萄糖和甘油兩種碳源培養條件下裂殖壺菌S056合成DHA的差異,研究發現甘油為碳源可以使FAS基因過量表達,DHA含量顯著提高,增幅達31.75%。程鈺蓉等[21]研究發現1 mmol/L的丙酮酸脫氫酶可顯著改變Aurantiochytriumsp.SD116的乙酰輔酶A在合成飽和脂肪酸的FAS途徑和合成不飽和脂肪酸的PKS途徑分配比率,導致不飽和脂肪酸含量下降。Metz等[22]通過對裂殖壺菌的脂肪酸合成酶(FAS)進行基因定點突變,突變株不能合成DHA,只能合成游離的脂肪酸,說明FAS合成酶是裂殖壺菌脂肪酸合成所必需的。綜上所述,通過對裂殖壺菌FAS途徑中的關鍵作用酶,如FAS合成酶、乙酰輔酶A、脫飽和酶基因進行外源表達和定點突變,證明了FAS途徑是存在于裂殖壺菌中,且能顯著影響DHA合成的一種途徑。
2 培養條件對裂殖壺菌合成DHA的影響
2.1 營養源對裂殖壺菌合成DHA的影響
2.1.1 碳源
碳源類型與濃度會對裂殖壺菌合成DHA的量產生較大的影響。研究表明,以葡萄糖作為單一碳源時,一定范圍內碳源質量濃度的升高(20~80 g/L),促進細胞的生長和總油脂產生,但過高的碳源濃度不利于細胞中總油脂的積累[23]。蔣曉艷[24]研究表明甘油有利于Schizochytriumsp. 20888生物量(4.5 g/L)和總脂(1.5 g/L)增長,葡萄糖則利于DHA(350 mg/L)含量增加。李婧[25]研究表明AurantiochytriumlimacinumSR21以葡萄糖和甘油為混合碳源;混合碳源(初始30 g/L葡萄糖進料,第3天補加40 g/L葡萄糖+10 g/L甘油,第4天補加20 g/L甘油)的DHA發酵效率顯著提高,經過5 d發酵,生物量達41.73 g/L,總脂含量63.85%,DHA含量48.51%,DHA 產量達12.93 g/L。裂殖壺菌不能利用多糖和二糖作為碳源;當選擇單糖作為碳源時,適當的葡萄糖濃度有利于DHA的積累;甘油也可以作為碳源促進裂殖壺菌的生長和總油脂的積累;采用葡萄糖和甘油作為混合碳源,比單一碳源更有利于DHA的合成。
2.1.2 氮源
氮源類型與濃度會顯著影響裂殖壺菌DHA的合成。在培養初期,氮源被大量用于菌體合成,細胞數量迅速增加。當氮源消耗至一定程度時,油脂開始大量積累。過高的初始氮源質量濃度有利于細胞的增殖,生物量會增加,但不利于油脂的合成和DHA的積累[26]。蔣曉艷[24]比較了不同質量濃度的谷氨酸鈉對裂殖壺菌Schizochytriumsp. 20888生長及油脂合成的影響,結果表明谷氨酸鈉質量濃度為8 g/L時,DHA的累積量最多。康晶等[27]研究發現,當使用玉米糖漿用作Schizochytriumsp.FJU-512的氮源時,DHA含量最高達4.1 g/L,酵母粉或谷氨酸作氮源時,油脂含量最高達15.1 g/L。劉源[23]研究發現,碳氮比過高,不利于脂質和類胡蘿卜素的合成;碳氮比過低,有利于生物量和類胡蘿卜素含量的提高,但不利于脂質積累,且DHA的比例較低。由此可知,氮源種類對DHA的積累影響顯著,以有機氮源如谷氨酸鈉、玉米糖漿、酵母粉作為氮源可促進油脂的合成;此外,碳氮比也會顯著影響脂質和類胡蘿卜素的合成。
2.2 溫度
溫度對調控裂殖壺菌胞內代謝及DHA合成有顯著影響。溫度從20℃升高到30℃,裂殖壺菌菌體生長良好;油脂含量在20~30℃之間呈先升高后下降的趨勢,但均高于15℃時的水平。37℃下菌迅速衰亡,且油脂含量也較低[28]。王澍等[26]研究發現,采取雙階段控溫,菌種在26℃下培養48 h后,再將發酵溫度降到22℃培養120 h,DHA含量為43.62%,相對26℃條件下提高7.6%。婁菲等[15]發現,將溫度升高至30℃將降低裂殖壺菌S31 DHA含量,FAS基因的轉錄水平高于PKS基因的轉錄水平; 將發酵溫度降低至20℃將增加其DHA含量,PKS基因的轉錄水平顯著高于FAS基因的轉錄水平。綜上可知,低溫能促進微生物合成不飽和脂肪酸,這是因為低溫能增加氧的可溶性,產生大量胞內分子氧,同時關鍵酶活性增強,有利于需氧參與的長鏈脂肪酸的去飽和作用。由于微生物培養前期主要是其增殖期,菌體快速生長,后期是油脂積累過程,兩個階段可以用不同的溫度控制,以達到最佳發酵目的。
2.3 無機鹽及微量元素
無機鹽作為微生物生長繁殖過程中較為重要的營養物質,在構成酶活性中心組分、維持細胞形態和氧化還原電位等方面具有重要作用。除了對磷、硫、鎂、鉀等的正常需求以外,裂殖壺菌作為海洋微生物,對氯化鈉的需求及含量相對較為敏感。類海水環境的氯化鈉質量濃度20 g/L,利于菌體的生長和 DHA 的積累[20]。滲透脅迫對裂殖壺菌發酵產DHA的性能影響較大[29],研究表明20 g/L NaCl最有利于裂殖壺菌HX-308細胞生長和DHA積累。裂殖壺菌產DHA需要比較適中的滲透壓環境,過高或過低都不利于裂殖壺菌發酵產DHA。在培養基中適量添加 Mn2+、Zn2+、CO2+對裂殖壺菌的生長速度和 DHA 的累積有顯著促進作用[30],通過調節微量元素組合(MnCl2·4H2O 32 mg/L;ZnSO4·7H2O 30 mg/L;CoCl2·6H2O 1.2 mg/L),裂殖壺菌生物量提高了61.38%,DHA含量提高了47.85%。綜上所述,滲透脅迫及無機鹽的添加能顯著影響裂殖壺菌的細胞生長和DHA合成。
2.4 其他前體物質或促進劑
多不飽和脂肪酸合成的前體物質及促進劑對裂殖壺菌DHA合成的促進作用顯著。Yokochi等[31]研究發現SchizochytriumlimacinumSR21能夠利用油酸和亞麻籽油之類的前體物質進行細胞的生物量及油脂積累。王申強等[32]研究表明,同時添加0.3 mg/L生物素、1 g/L 蘋果酸、0.4 mg/L洛伐他汀時,能夠顯著提高裂殖壺菌發酵產DHA的產量。在適宜的濃度下,細胞分裂素6-芐基腺嘌呤(BA)和糠基腺嘌呤(KT),赤霉素(GA),以及植物生長素吲哚丁酸(IBA)、萘乙酸(NAA)和吲哚乙酸(IAA)對裂殖壺菌生物量和DHA含量都有不同程度的促進作用,其中BA對DHA合成影響最大,而KT促進作用最不明顯[33]。維生素的添加對裂殖壺菌發酵產DHA的量有一定的影響,研究發現:VB12對菌體內油脂含量和油脂內DHA含量影響較大,對生物量沒有明顯影響;VB1對菌體生物量影響較大,對菌體內油脂含量和油脂內DHA含量沒有明顯影響;VB6和VB3則對這三者都有明顯影響[34]。綜上所述,通過添加棕櫚油、油酸、亞麻籽油等DHA前體物質或者適量的促進劑(BA、KT、GA等),對裂殖壺菌DHA含量有促進作用。
3 裂殖壺菌基因組或轉錄組研究
3.1 裂殖壺菌基因組測序
基因組測序是對未知基因組序列的物種進行個體的基因組測序,即是分析包括編碼序列和非編碼序列在內的全部DNA分子的堿基序列,可以確定重組DNA的方向與結構,對突變進行定位、鑒定和比較研究。第一代測序技術從固定的引物組合成DNA,并在特定堿基處終止其隨機合成,以獲得分別以A、C、T和G結尾的不同長度的一系列核苷酸,但該操作煩瑣且昂貴,并且不能滿足大規模測序的需要。第二代測序技術以焦磷酸測序為例,有著高通量、低成本的優點。通過在由4種酶(TP硫酸化酶,DNA聚合酶,腺苷三磷酸雙磷酸酶和熒光素酶)組成的相同催化反應系統中進行酶聯發光反應,對已知的短序列進行測序分析。基于納米孔水平的單分子閱讀平臺的第三代測序技術每次可以讀取數百萬個序列。因此,就測序讀取長度而言,第三代測序技術從第一代和第二代測序技術邁出了一大步,但其尚未被廣泛使用[35-36]。在基礎生物學研究及應用領域(如微生物學、合成生物學、生物系統學),基因組測序已成為不可缺少的手段。
目前進行基因組測序的裂殖壺菌及獲得的與脂肪酸合成相關結果如表1所示。
綜上所述,通過研究裂殖壺菌全基因組可明晰DHA的生物合成途徑及關鍵酶基因,為研究DHA的形成和調節機制提供重要依據,為高效合成DHA及基因工程改造菌株奠定理論基礎。
3.2 裂殖壺菌轉錄組測序
轉錄組測序是通過新一代高通量測序技術,得到特定細胞在某一狀態下轉錄出的所有RNA序列信息。轉錄組研究是基因功能及結構研究的基礎和出發點,是研究基因表達的主要手段,同時也是連接基因組遺傳信息與生物功能的蛋白質組的重要紐帶。轉錄水平的調控是目前研究最多的,也是生物體最重要的調控方式。目前用于研究轉錄組的方法主要包括:①基于雜交的方法,如cDNA芯片,寡核苷酸芯片等;②基于測序技術,如Sanger測序的SAGE(Serial analysis of gene expression)和MPSS(Massively parallel signature sequencing),全長cDNA文庫和EST(Expressed sequence tag)文庫測序分析;③RNA-Seq是第二代測序技術。與其他測序技術相比具有以下優點:高通量,通過轉錄組測序技術,不僅可以獲得數個甚至數十億個堿基序列,而且可以實現覆蓋所有轉錄組的要求;高分辨率,轉錄組測序技術可以高精度地區分單堿基,可以有效避免微陣列雜交的熒光模擬信號引起的背景噪聲,交叉反應等問題;高靈敏度,這種測序技術可以檢測細胞中稀有轉錄物的稀有拷貝[45]。
目前進行轉錄組測序的裂殖壺菌及獲得的與脂肪酸合成相關結果如表2所示。
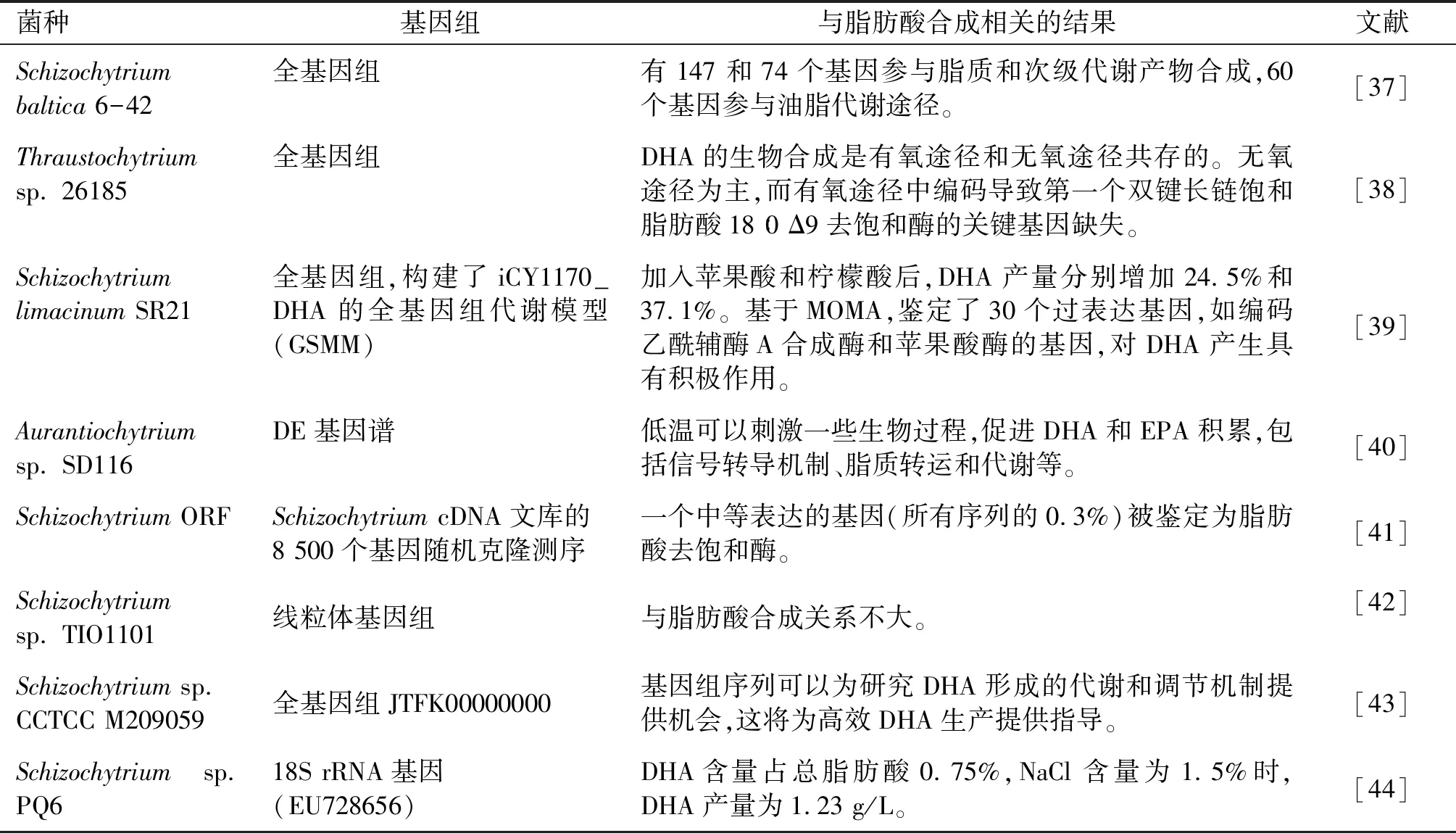
表1 進行基因組測序的裂殖壺菌及獲得的與脂肪酸合成相關結果
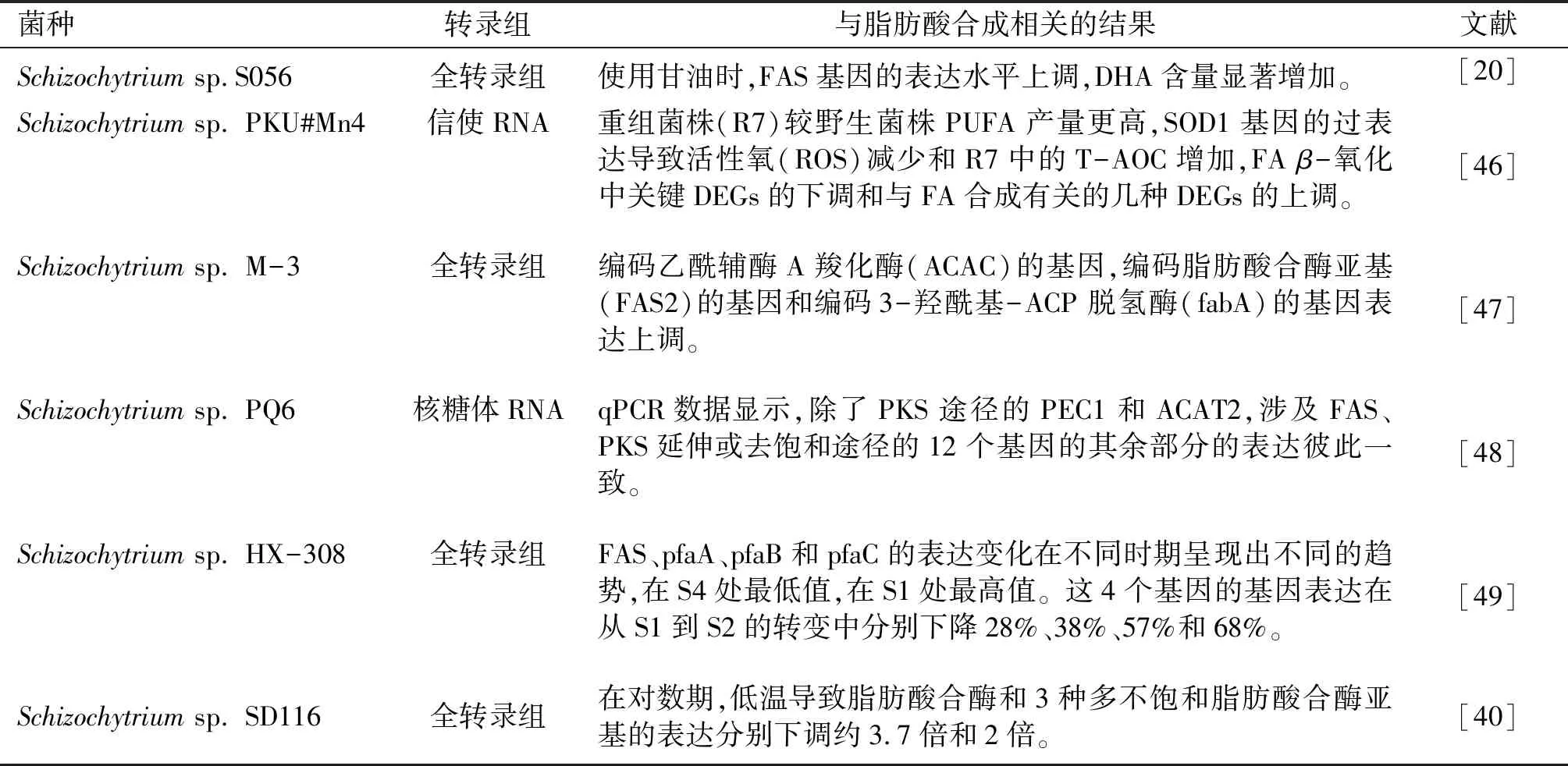
表2 進行轉錄組測序的裂殖壺菌及獲得的與脂肪酸合成相關結果
綜上所述,目前對不同限制條件下的菌株進行轉錄組測序發現,DHA合成關鍵酶基因的上調(FAS基因,編碼乙酰輔酶A羧化酶基因等)或下調(脂肪酸合酶,3種多不飽和脂肪酸合酶亞基等)都會對DHA合成產生顯著影響。
4 結束語
裂殖壺菌合成DHA主要有聚酮合成酶(Polyketide synthase,PKS)途徑和脂肪酸合成酶(Fatty acid synthase,FAS)途徑。通過基因工程技術,使DHA合成途徑中的關鍵酶基因在裂殖壺菌中過表達可促進DHA合成;培養條件的優化,如碳源、氮源、碳氮比、溫度、滲透壓、微量元素、前體物質及促進劑等對DHA的合成影響顯著;利用生物信息學技術如基因組和轉錄組測序,為明晰裂殖壺菌DHA的生物合成途徑及關鍵作用酶提供了重要的數據支撐,為構建基因工程藻株奠定了理論基礎。近年來,DHA的需求逐年增加,DHA相關產品市場潛力巨大。但我國企業存在產能低下,產品純度不高,國際競爭力較低等瓶頸問題。當下,我們除了優化高密度發酵參數以外,也要關注優良菌種的選育,從源頭上解決我國DHA純度低、難分離、高成本的現象。

