大鼠坐骨神經離斷后細胞增殖、遷移與凋亡在近遠端神經片段的表達研究
姜 南,張志雄,李俊瑩,劉天戟
(吉林大學中日聯誼醫院,吉林 長春130033)
周圍神經損傷所后,預后常不理想,肢體會留存不同程度的功能障礙,患者的身心受到莫大傷害,同時也給社會增加了沉重的負擔[1]。目前,各種新型的人工生物組織神經也已應用于臨床,但效果仍不能取代自體神經移植。究其原因,是由于周圍神經損傷后病理生理變化受諸多因素影響,且在損傷神經的近端和遠端會呈現不同的變化。遠端細胞會發生程序性凋亡,進而神經出現退行性變;近端神經組織的抗凋亡信號會比較明顯,促進沿損傷的軸突再生[2]。神經損傷后再生速度緩慢,近遠端具體變化的時間節點以及參與的主要調控因子,尚不完全明確,這些都對我們臨床工作中促進神經功能恢復有著莫大的影響[3]。本研究設計了大鼠坐骨神經離斷的模型,利用基因芯片技術對其近遠端基因所反映的細胞增殖、遷移和凋亡的變化趨勢進行分析并加以對比,已期能找到疾病發生發展和轉歸時期中的關鍵點,從而為臨床提供高效的治療方案。
1 材料與方法
1.1 實驗動物造模及取材
健康成年SPF級SD雄性大鼠,體重200±20 g,80只(10只備用),進行腹腔注射麻醉,采用復合麻醉劑(戊巴比妥鈉30 mg/kg)。麻醉生效后,無菌操作暴露右臀部,取縱行切口,分離臀大肌后,暴露坐骨神經臀部走行長約1 cm,于梨狀肌下緣行神經橫斷,兩側均簡單處理防止神經再生自行接觸。無菌化處置創口后,大鼠飼養于24-30攝氏度,30-50%濕度的籠箱中,飲水及攝食自由,保證足夠時間光照。對照組不做任何處理。
取材:于擬定的每個時間點:術后0天(即刻),1天,3天,6天,9天,12天,15天各取大鼠10只,沿原切口分離進入,取近端及遠端神經組織各0.3 cm,液氮凍存,以留實驗用。
1.2 RNA提取和基因芯片分析
將取材所得的大骨坐骨神經片段用于制備基因芯片,為減少異質化,分析重復3次。
基因芯片制備:提取RNA并沉淀,測定RNA序列,分別合成第一鏈與第二鏈cDNA,并純化,用生物素標記合成的cRNA,行純化并體外轉錄得到產物,分光光度計測定cRNA濃度,凝膠電泳檢測,然后片斷化cRNA,行分子探針雜交,洗脫和染色,最后得到基因數據。
基因篩選:根據每個時間點不同的基因比率,使用昂飛基因差異分析掃描系統進行分析,對長、短時間不同序列下的差異基因分別進行表達趨勢的顯著性分析,差異性表達基因的篩選依據為P<0.05,fold change>2,得到整體差異基因的數量。
1.3 生物學進程分析
我們應用DAVID生物信息數據庫對已經篩選出來的差異基因進行分析,通過Gene Ontology (GO)進行進一步篩選。根據已知的周圍神經損傷后再生的病理生理學特點,我們選出了細胞增殖、細胞遷移、細胞凋亡這3個生物學進程有關作為關鍵詞,對篩選基因的Entrez Gene ID號進行分類分析,找到與之相對應的基因,得到其在不同時間點的變化過程。
1.4 實時定量PCR(Real-time PCR)分析
先行設計引物序列,利用不同時間點取材的神經片段行總RNA的制備,逆轉錄反應擴增,96wells Real-time PCR檢測。 為減少實驗誤差,我們選取了內參GAPDH對所有的目的基因進行校正,在重復3次的基礎上,再進行δ配比進行相對定量分析。在每個擬定的時間點,所篩選基因的表達水平與0天(即刻)進行對比分析。本實驗所得數據采用SPSS21.0 軟件統計進行單因素方差分析處理,當P<0.05時認為基因差異性有統計學意義。
我們選取四個與細胞增殖、細胞遷移、細胞凋亡這3個生物學進程的特異基因進行驗證,即Areg、Gdnf、Shh、Mal。雙調蛋白(Areg,Amphiregulin)是表皮生長因子(EGF)家族成員之一,在細胞的增殖,侵襲,轉移,神經血管形成中發揮重要作用[4]。膠質細胞源性神經營養因子(Gdnf,glialcellline-derived neurotrophicfactor)一種神經營養因子,在生理功能、受體、信號傳導途徑等方面有著重要的作用[5]。音猬因子(Shh,Sonic Hedgehog)是重要的信號轉導因子,指導核內因子轉錄,起到調節細胞增殖代謝的作用[6]。Mal基因的作用是編碼髓磷脂和淋巴細胞蛋白,其失活及異常與細胞信號轉導、異型細胞的增殖凋亡等有一定關系[7]。
2 結果
2.1 基因芯片結果
從差異基因表達的數量可以看出,在近側端神經片段,細胞增殖、細胞遷移、細胞凋亡隨著實驗時間的推移,差異基因的表達數量逐漸增高,在第6天和第9天之間達到高峰,即達到了神經調控的高表達平臺;然后差異基因的表達數量逐漸下降,但仍處在一個相對較高的數量級,三者的整體趨勢基本一致(表1,圖1)。在遠端神經片段,細胞增殖、細胞遷移隨著時間的推移,差異基因的表達數量也是逐漸增高的,并且在第9天達到高峰,后呈下降趨勢,而細胞凋亡則全程表達逐漸增高,直到實驗的終點第15天至最高峰。遠端神經片段差異基因表達的數量較近端占優勢,尤其以細胞增殖和細胞凋亡為主(表1,圖2)。
2.2 實時定量PCR結果
我們篩選了四個與細胞增殖、細胞遷移、細胞凋亡這3個生物學進程相關的特異基因進行驗證,由實驗結果可以看出,Areg、Gdnf、Shh、Mal這四個典型的細胞因子的基因芯片表達趨勢與分子生物學驗證的RNA表達趨勢基本一致(表2,圖3和4)。
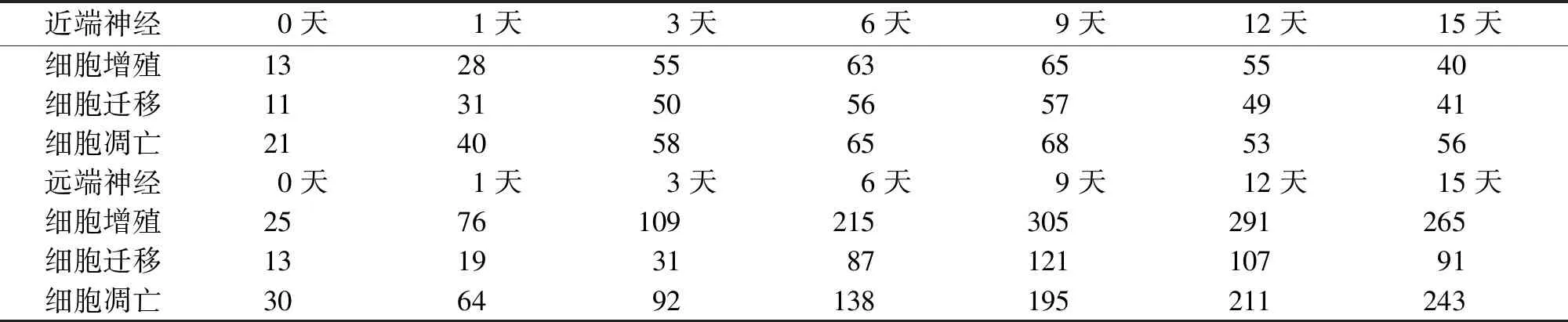
表1 近端與遠端神經片段差異基因的表達數量
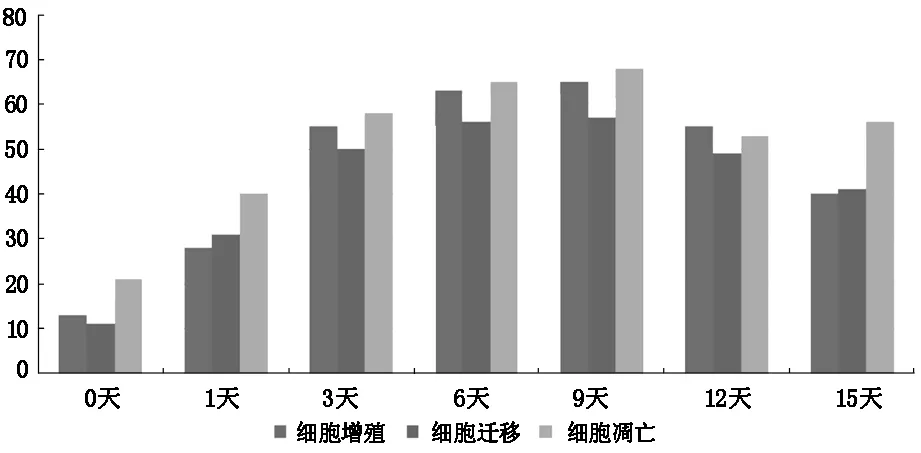
圖1 近端神經片段差異基因數量柱狀圖
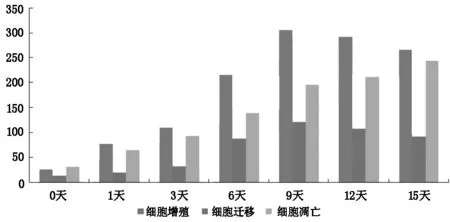
圖2 遠端神經片段差異基因數量柱狀圖
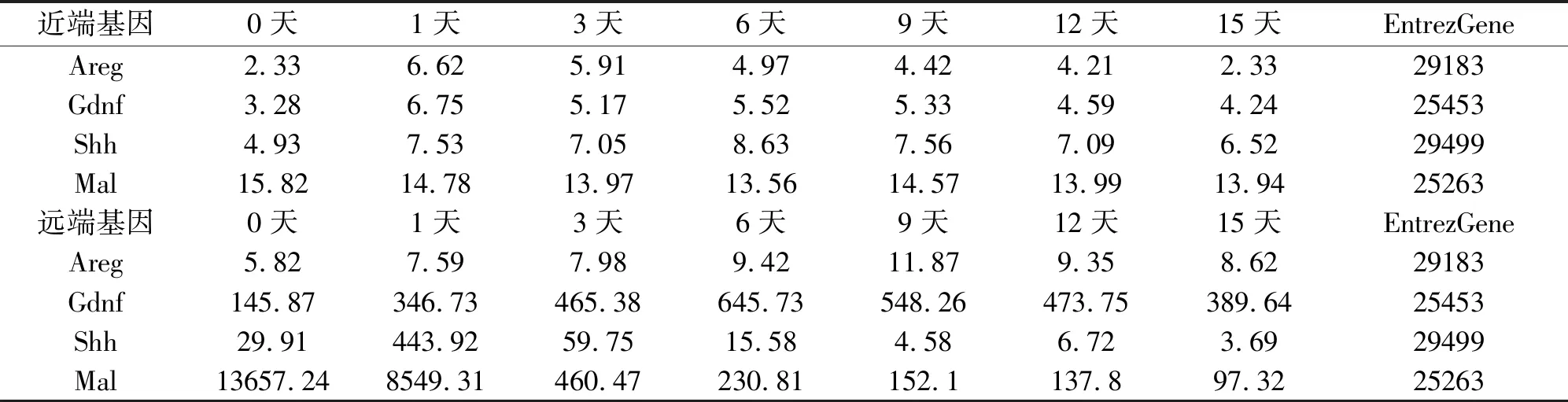
表2 近端與遠端相關差異基因表達值
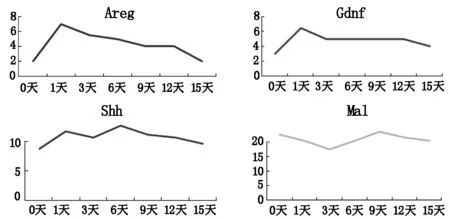
圖3 近端相關基因的RNA表達
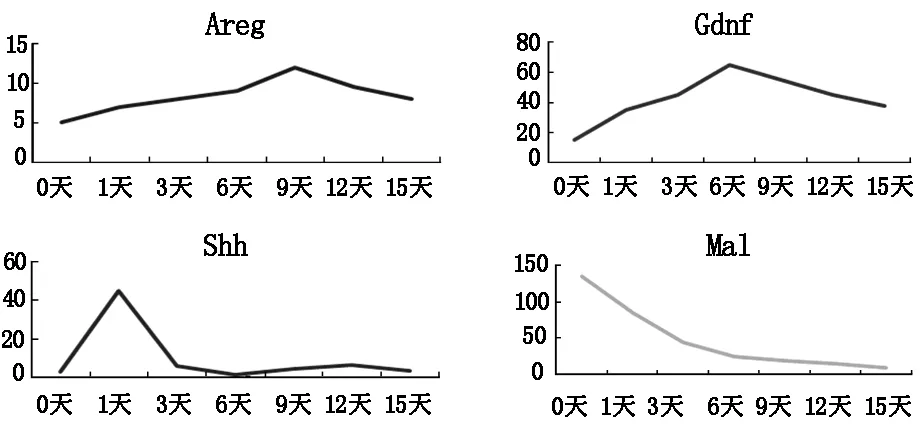
圖4 遠端相關基因的RNA表達
3 討論
神經發生損傷后,巨噬細胞會吞噬損傷細胞崩解成的碎片,為神經再生創造合適的微環境,而雪旺細胞會發生分化并進一步增殖以形成Bünger帶,其他分化形成的神經細胞會沿著其生長形成新的神經束。有學者研究發現,神經損傷后,位于不同位置雪旺細胞都會有不同表型的變化,在近端區域,隨著Bünger帶的形成,成熟的雪旺細胞會發生增殖和遷移,并附著于其上,結構還未完全穩定時,即向遠端區域靶向生長移動,新生者并已有了神經的相關結構和功能[8]。
在本研究中,近端神經片段細胞增殖的差異基因數量呈升高趨勢,并在第6天到第9天達到頂峰,后略有下降。遠側端差異基因的趨勢與其對應相似,但整體數量較其明顯增多。從此可以看出,無論在近遠端哪方面,細胞增殖都是一個高表達的因子系列,說明其貫穿于整個神經再生修復的始終。而在這里面,與雪旺細胞轉化增殖相關的基因在調控方面起到了主導作用[9]。
細胞遷移在整體趨勢方面,與細胞增殖近似。近端差異基因的數量逐漸增多,并在第6天至第9天達到達峰值,后開始下降;在遠端方面,高峰同樣出現在第9天,而后呈下降趨勢。細胞遷移是生命體發育和維持穩態的重要環節,無論是正常增殖,異常創傷等造成的組織正常或異常形成,以及免疫趨化反應,均需要特定細胞在特定信號因子的刺激介導下,朝特定部位定向移動,且過程被精細調控[10]。神經損傷后,對細胞遷移有調控功能的基因數量及表達水平在短期內迅速增多,考慮它們可以在識別損傷信號后,調控中性粒細胞、單核巨噬細胞等向損傷的部位迅速遷移,介導相關的炎癥與免疫反應。在后期階段,一些特定介導細胞吞噬功能的基因除了參與細胞遷移,可同時清除細胞碎片,并在軸突導向生長等方面起到協同的作用[11]。整體上來看,細胞遷移與細胞增殖的趨勢基本相同。不同在于早期階段,遠側端細胞遷移表達較弱,說明其早期刺激細胞遷移較弱,而分化吞噬作用起主導地位,為再生建立合適的內環境,而后維持動態平衡[12]。
在細胞凋亡方面,近側端差異基因呈顯著升高趨勢,在第6天至第9天維持相對高水平。與近側端結果不同,遠側端差異基因在整個實驗過程中呈高表達狀態,并持續上升,在實驗的最終日期15天達到最高。周圍神經損傷后,遠端組織會發生程序性退行性變,與此同時,損傷局部的抗凋亡信號會被激活。這種反饋性的保護作用在近遠端程度不同,近端較明顯,而遠端則凋亡信號占優勢,炎性細胞浸潤與吞噬細胞清除碎片比較明顯,組織會發生全長潰變[13]。
實驗結果說明,在神經損傷后,大量的炎癥細胞和免疫細胞在趨化作用下遷移到損傷局部,進一步通過增殖作用以維持相關反應的進行。在這些作用下,增殖和凋亡這兩個相反的過程既相互對抗,又互相聯動,達到了一個相對的平衡狀態[14]。遠側端神經凋亡基因隨時間呈持續高表達,到達實驗最遠的時間兩周,說明神經損傷后遠側端失去了近側端的支配調控,已不能保持相對的平衡,凋亡占絕對優勢,這也闡明了Wallerian變性的真實特點[15]。
周圍神經損傷后近遠端會呈現不同趨勢的變化,這是由不同的細胞因子來調控的,它們互相關聯,組成了一個動態發展的網絡。通過本研究,我們希望在周圍神經損傷后再生分子調控的機制上,可以通過基因水平的深入研究,找到其網絡調控的關鍵位點,以便為臨床工作帶來新的契機。

