例談基于數據推理的化學教學實踐
丁浩 黃金泉

摘要: 以四個化學教學實踐為案例,闡述立足課堂運用合理數據進行推理分析,解答學生疑問,培養學生尋找所需證據的途徑,增強學生的證據意識,發展學生化學學科核心素養。提升教師對教材、試題的洞察力和理解力,創設真實的學習情境,為學生的學科素養發展奠定基礎。
關鍵詞: 數據推理; 證據意識; 化學教學; 海水提鎂
文章編號: 10056629(2019)7005504中圖分類號: G633.8文獻標識碼: B
化學學科核心素養包括“宏觀辨識與微觀探析”“變化觀念與平衡思想”“證據推理與模型認知”“科學探究與創新意識”“科學態度與社會責任”五個方面[1]。其中證據意識,通過分析推理加以證實或證偽,建立觀點、結論和證據之間的邏輯關系是我們一線教師所追求的本真課堂之一。怎樣立足課堂和教材,挖掘素材,創設具體的教學情境,引導學生推理求真,培養他們的證據意識?為此,筆者結合自己的教學實踐就如何利用數據推理培養學生證據意識淺談自己的一些體悟,以求拋磚引玉并歡迎同行批評指正。
1 辨識除雜試劑是否合理
在講授蘇教版《化學1》[2]專題1第二單元中的“物質的分離與提純”時,筆者常以粗鹽(假定含Ca2+、 Mg2+、 SO2-4等雜質)為例進行教學。
教師: 欲除去這些雜質離子,應分別將Ca2+、 Mg2+、 SO2-4一一轉化為什么物質?
學生: 應轉化為相應的CaCO3、 Mg(OH)2、 BaSO4,然后通過過濾操作除去這些沉淀以達到去除雜質離子的目的。
教師: 為防止引入新的雜質離子,加入的除雜試劑分別是什么?
學生: 應分別為Na2CO3、 NaOH和BaCl2溶液。為確保雜質離子都已除盡,這些加入的試劑都應適度過量。
教師: 過量的BaCl2怎么去除?要不要另加試劑?
學生: (經一番討論后)沒必要,只需確保Na2CO3溶液在BaCl2溶液后面加入即可。也就是說,Na2CO3溶液起兩方面的作用,一是沉淀Ca2+;二是除去過量的Ba2+。適度過量的Na2CO3和NaOH溶液,都可以通過滴加鹽酸調節溶液pH的方式達到去除的目的。這樣加入的除雜試劑組合順序可能就有多種情況,但不管哪一種組合方式,Na2CO3溶液務必排在BaCl2溶液后面加入才算合理,其他除雜試劑的組合順序則無關緊要。這種除雜方式通常是一種除雜試劑只能沉淀一種雜質離子。
課上到這,問題都一一解決了,這時卻有學生提出: 能否加入Ba(OH)2溶液這一種試劑來同時替代NaOH溶液和BaCl2溶液這兩種試劑?這樣正好既沉淀了Mg2+,同時又沉淀了SO2-4。為撥開學生心中的疑團,課堂上筆者以資料卡的形式提供了模擬海水中幾種主要無機鹽的離子含量[3](見表1),對該問題進行了數據推理分析,得到了較為滿意的效果。同時,也培養了學生證據意識,提升了學生的學科素養。
經過這樣一番的推理分析,學生豁然開朗,臉上也都露出會心的笑容,同時也激勵了學生學化學的熱情。看得出,學生對這樣的解釋非常滿意。課的最后教師總結說這樣看似以一當二的做法其實是不科學的,工業上也并不采用。況且,就目前而言,Ba(OH)2·8H2O的價格比BaCl2·2H2O貴,不經濟、不實惠。可見,用Ba(OH)2來代替NaOH和BaCl2,根本達不到正好既沉淀Mg2+,又沉淀SO2-4的目的[4]。
2 辨別混有少量KCl的KNO3提純方案的合理性
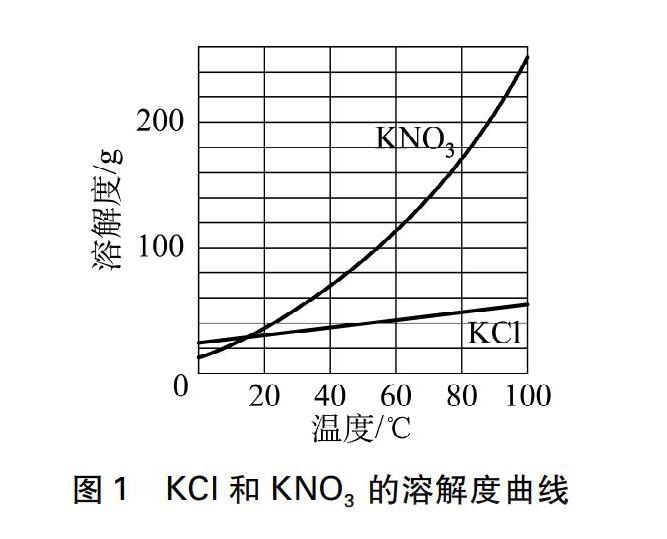
在講授“物質的分離與提純”時,教材中的交流與討論還涉及到這樣一個問題: 現有混有少量氯化鉀的硝酸鉀粉末,請參照溶解度曲線(見圖1),設計實驗方案提純硝酸鉀。教材文本的方案是:“在提純混有少量氯化鉀的硝酸鉀時,先在較高溫度下將混合物溶于水中形成濃溶液。然后冷卻到一定溫度,由于硝酸鉀的溶解度隨溫度降低急劇下降,因此有大量硝酸鉀晶體析出,而氯化鉀的溶解度隨溫度變化不大,因而不會有結晶析出。再過濾,即可得到純凈的硝酸鉀晶體”。可為什么氯化鉀在溫度降低的過程中不會同時析出?難道它不能達到飽和狀態嗎?它的溶解度不是也在隨溫度的降低而降低嗎?只是降低的幅度不大而已,我看肯定會析出那么一點點!因此得不到純凈的硝酸鉀!課堂上學生這樣“振振有詞”地反駁道。顯然,要徹底消除學生的疑慮,光定性講解是遠遠不夠的,教學中筆者結合了相關物質的一些溶解度數據進行推理,起到了事半功倍的教學效果。
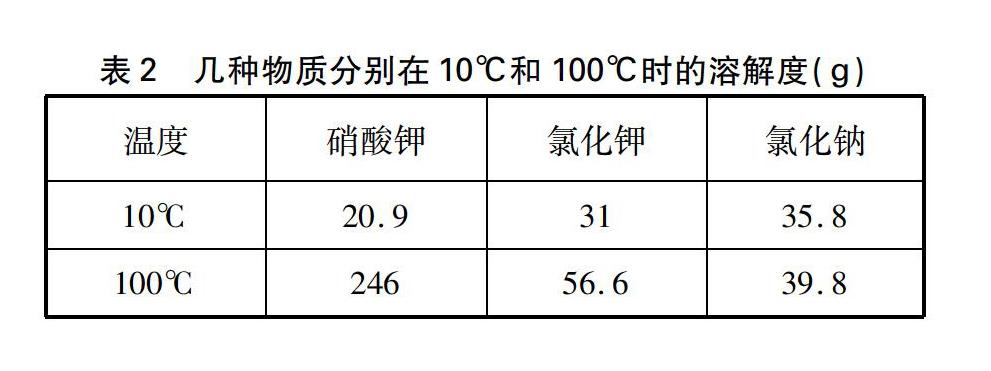
教師: 假設硝酸鉀和氯化鈉混合物的總質量為140.9g,其中硝酸鉀為123g,氯化鈉為17.9g(這樣的設定足以說明氯化鈉的量是少量的)。硝酸鉀、氯化鉀和氯化鈉分別在10℃和100℃時的溶解度數據見表2。若用10℃的水完全溶解此混合物,至少需要水多少克?(假設鹽類物質共存時,不影響各自的溶解度)
也就是說當溫度降低到一定數值時(假定為10℃),在此溫度下氯化鈉根本就不會析出結晶。通過這樣設定的數據進行推理,證實了將上述濃溶液冷卻到一定溫度時,氯化鈉的溶解度隨溫度變化不大,因而不會析出結晶的事實,水到渠成地解開了學生心中的疑慮,同時也詮釋了教材文本給出的提純方案的合理性。當然,如果將混合物中的氯化鈉換成氯化鉀,只需設定氯化鉀在混合物中的質量不超過15.5g,其他數據不變,利用所給的溶解度進行數據推理,同樣也能得出相同的結論,具體推算過程不再贅述了。
3 海水提鎂
在講授蘇教版《化學1》專題2第二單元中的“鎂的提取及應用”時,教材文本是這樣闡述從海水提鎂的步驟的:“將石灰乳加入海水沉淀池中,得到氫氧化鎂沉淀,再將氫氧化鎂與鹽酸反應,得到的溶液蒸發結晶,可得六水合氯化鎂晶體(MgCl2·6H2O)。將六水合氯化鎂晶體在一定條件下加熱生成無水氯化鎂,電解熔融氯化鎂可以得到金屬鎂”。應該說教材文本把從海水中如何提取鎂的過程概括得非常簡潔、精煉,涉及的反應原理也清晰明了。實際教學中,教師如果不能挖掘這段話里面的學科價值一帶而過,當學生細細“品味”這段話的含義,很有可能會在他們的腦海中產生這些疑問: (1)為什么是加石灰乳將海水中的鎂離子沉淀下來?改加氫氧化鈉溶液行不?(2)為什么海水中的鎂離子要以氫氧化鎂沉淀形式分離出來?以碳酸鎂、硫酸鎂、氯化鎂等其他形式分離行不?(3)為什么是選擇電解熔融的氯化鎂制取鎂?選擇電解熔融的氧化鎂制取鎂行不?選擇電解熔融的硫酸鎂行不?(4)不選用電解法制取鎂,而選用金屬置換法行不?如此一系列問題,如果課堂上不能及時加以分析、解決,學生就會帶著這些懸而未解的疑問貫穿于整個課堂,很可能導致聽課效率大大降低。那么,怎樣對上述問題一一進行“破解”呢?數據推理就起了至關重要的作用。
針對疑問(1),課堂上筆者以資料卡的形式給出了幾種常見堿的市場價格數據(見表3),讓學生自行評價為什么選用石灰乳而不選用氫氧化鈉溶液。學生根據提供的常見堿的價格能很快推理出氫氧化鈣不僅比其他堿便宜,而且更易就地取材。甚至還進一步解釋說按資源就近利用和原料廉價易得的原則,石灰乳可利用海邊大量存在的貝殼煅燒成石灰制得。如果氫氧化鈣成品加運輸成本低于制造成本,則直接購買。
4 高考試題中蘊含的數據
2016年江蘇高考試題第16題是一道工業流程圖題。原試題摘錄如下: 以電石渣[主要成分為Ca(OH)2和CaCO3]為原料制備KClO3的流程如下:
(1)(2) 略
(3) 向濾液中加入稍過量KCl固體可將Ca(ClO3)2轉化為KClO3,若溶液中KClO3的含量為100g·L-1,從該溶液中盡可能多地析出KClO3固體的方法是。
該試題將元素化合物、化學反應原理和化學實驗融為一體,意在引導化學教學關注化學學科內知識的融合,強化培養學生綜合運用化學知識解決真實而有意義的化學問題的能力,幫助學生樹立學科價值觀。當年該試題的第3小題失分較為嚴重,大多數學生直接回答“冷卻結晶”,有的只答“蒸發濃縮”,少數學生則錯答成“蒸發結晶”。究其原因,很多學生當時只注意到KClO3的溶解度隨溫度的升高而增大,沒有留意到“溶液中KClO3的含量為100g·L-1”這一信息,甚至視而不見;還有學生誤以為給出的這一數據純粹多此一舉。這道題應答全“蒸發濃縮、冷卻結晶”才能給分,為什么非要強調先蒸發濃縮呢?試題給出溶液中KClO3含量這一數據透露出什么信息?如何解讀?該信息對解題有什么幫助?如何處理?等等。如果試著假設溶液的體積為1L,則溶液中KClO3的質量為100g,若溶液的體積近似為水的體積,1000g水中大約溶解了100g KClO3,即近似于100g水中溶解了大約10g KClO3,從圖示中大致可以看出對應的溫度近似于30℃,也就是說KClO3大致在近似于30℃達到飽和狀態,在該溫度下直接冷卻(即使冷卻到0℃),只能得到較少的KClO3固體。相比其他三種鹽,KClO3的溶解度隨溫度的變化最大,且在低溫時溶解度很小。因此為了盡可能多地從濾液中析出KClO3固體,采取的方法應是蒸發濃縮、冷卻結晶。
高考命題者的目的是考查學生基于“溶液中KClO3的含量為100g·L-1”這一證據,去推理KClO3大致在什么溫度下能夠達到飽和狀態,從而判斷欲從該溶液中盡可能多地析出KClO3固體,應該采取什么樣的措施[5]。
可見,運用數據進行分析推理能夠培養學生的證據意識,有效提升學生的學科素養。基于證據進行推理,確定形成科學結論或解釋證據與結論之間的關系,是當前新課程標準所倡導的,也是化學學科核心素養所要求的。因此,我們要立足于教材,并加強教材到教學的深度研究,提升對教材的理解力,創設具有真實的化學學習情境,開展以素養為本的課堂教學實踐,為學生的學科核心素養發展奠定堅實的基礎。
參考文獻:
[1]中華人民共和國教育部制定. 普通高中化學課程標準(2017年版)[S]. 北京: 人民教育出版社, 2018: 3.
[2]王祖浩主編. 普通高中課程標準實驗教科書·化學1(必修)[M]. 南京: 江蘇教育出版社, 2014.
[3]郭琨編著. 海洋手冊[M]. 北京: 海洋出版社, 1984: 41.
[4]黃金泉. 對教學中幾個疑問的探討與思考[J]. 化學教學, 2015, (3): 83~84.
[5]黃金泉. 由蘇州市中學教師專業素養競賽備考說開去[J]. 化學教與學, 2017, (6): 74~75.

