小球藻固定CO2能力與油脂積累條件研究
梁梁 杜風光 陳嘉山 劉秀花 梁峰
摘 要:小球藻生長速率快、易于培養且能進行光合作用,可作為生物法固碳的優良材料。而CO2作為全球變暖的元兇,如何減少大氣中CO2含量已是當今熱門話題。但目前對小球藻去除CO2的研究中,大規模培養的較少。因此,本實驗以120L玻璃封閉的自制大容器為培養器,以HSM1添加植物激素6-BA 0.5mg/L為培養基,培養時持續通入CO2和空氣,通氣量為1L/min,CO2的濃度為6.56%,并進行光照、水循環等,對小球藻進行大規模培養。結果表明:小球藻對CO2的去除率最高達24.09%,鮮重為3.624g/L,產油能力為0.14g/L。
關鍵詞:小球藻;大規模培養;生物固碳;生物燃料
中圖分類號:Q945 文獻標識碼:A 文章編號:1003-5168(2019)17-0131-05
Abstract: Chlorella has a high growth rate, is easy to cultivate and can perform photosynthesis, and can be used as an excellent material for biological carbon fixation. CO2, as a greenhouse gas, is the main culprit of global warming. How to reduce CO2 content in the atmosphere is a hot topic today. In the current study of CO2 removal by Chlorella, large-scale cultures are less common. Therefore, in this experiment, a large-scale culture of Chlorella vulgaris was carried out in a 120L glass-enclosed self-made container with HSM1 and phytohormone 6-BA 0.5mg/L as the medium. During the culture, CO2 and air were continuously injected with a ventilation rate of 1L/min and a concentration of CO2 of 6.56%. Light and water circulation were also carried out to culture Chlorella vulgaris on a large scale. The results showed that the highest CO2 removal rate of Chlorella was 24.09%, fresh weight was 3.624g/L, and oil production capacity was 0.14g/L.
Keywords: Chlorella;large-scale culture;biological carbon fixation;biofuel
小球藻(Chlorella)為綠藻門小球藻屬普生性單細胞綠藻,是一種球形單細胞淡水藻類,直徑3~8μm,內有一個周生、杯狀或片狀的色素體,是一種高效的光合植物。微藻固碳已經成為消減溫室氣體排放的新的研究熱點[1]。自養型藻類主要依靠CO2和光能生長,在光合作用過程中,藻類吸收CO2,并將其轉化為糖、蛋白質、油脂等生物質能。藻類對光量子(太陽能)的吸收轉化率可達8%~10%,而一般農作物的光能轉化率只有1%~3%[2]。每生產100t微藻,約可吸收利用470t碳元素,可轉化掉185t CO2。因此,藻類養殖是控制和減少大氣中CO2的一種有效途徑[3]。在300mL的小培養容器中,對CO2的去除率為27.69%,固碳量達到256.86mg/(L·h)[4],而小球藻去除CO2的研究必將邁向大容器、大規模培養。小容器培養與大容器培養中存在許多微小且令人意想不到的問題,這些問題也是在實驗的深入研究中所必須要面臨的。
對于以消減大氣中CO2為目的大規模微藻培養,其主要利用微藻生長速度快、易于培養且能達到較高密度培養的特性來進行本次實驗。本實驗選用實驗室分離純化的一株小球藻,生長迅速,抗逆性強,且能在雜藻及雜菌中優勢生長,可作為CO2減排藻株。以HSM1添加6-BA為其培養基,并在培養過程中,對光照強度、通氣量、容器內水循環等進行控制。本文主要分析大容器培養中,每個時期的CO2去除率,并觀察其變化,分析變化的內外原因。同時,觀察并測量每個時期的生物量,最后將其回收并測量藻內含油量,以為后續生物精煉方向的研究提供參考。
1 材料與方法
1.1 試驗材料
試驗菌株為小球藻,來自于生物精煉河南省工程實驗室。本實驗的基本培養基為HSM1培養基,其成分為:NH4Cl 0.500g/L,K2HPO4 1.440g/L,KH2PO4 0.720g/L,MgSO4·7H2O 0.020g/L,CH3COONa 2.000g/L,CaCl2·2H2O 0.010g/L,Trace 1mL。其他涉及培養基有以下三種。
BBM培養基:NaNO3 0.250g/L,KH2PO4 0.175g/L,K2HPO4 0.075g/L,MgSO4·7H2O 0.075g/L,CaCl2·2H2O 0.025g/L,NaCl 0.025g/L,Trace 1mL。
DS培養基:NaNO3 0.300g/L,CO(NH2)2 0.150g/L,K2HPO4·3H2O 0.050g/L,FeC6H5O7 0.006g/L,CaCl2·2H2O 0.025g/L,Trace 1mL。
SE培養基:NaNO3 0.250g/L,K2HPO4·3H2O 0.075g/L,MgSO4·7H2O 0.075g/L,CaCl2·2H2O 0.025g/L,KH2PO4 0.180g/L,NaCl 0.025g/L,FeCl3·6H2O 0.010g/L,Fe-EDTA 1mL。
1.2 試驗方法
1.2.1 CO2發生器的制作。取兩個2L的雪碧空瓶,并貼上A、B標簽。A瓶裝200g檸檬酸加600mL水,B瓶裝200g小蘇打加300mL水,搖勻待用。然后取雙出口瓶蓋兩個,并貼上A、B標簽。A蓋頂部一個口接壓力表,另一個口連接B蓋,下部接有通到瓶底的管子;B蓋一個口連接A蓋,其接口下部接有連接斜三角的管子(使其內液體單向流動,即A瓶液體能進入B瓶,B瓶液體不能進入A瓶,且B瓶的氣體能進入A瓶),另一個口為出氣口,其上接有調節出氣量的閥門。
接著蓋上瓶蓋,擠壓A瓶,使其內檸檬酸進入B瓶與小蘇打反應;松開A瓶,B瓶氣體進入A瓶,所以兩瓶氣壓相等。重復擠壓幾次后,隨著小蘇打與檸檬酸反應,內部氣壓升高,以致擠壓不動時,打開出氣口5s左右,使B瓶氣壓降低,A瓶的檸檬酸就會再次進入B瓶,關緊出氣口。搖晃B瓶,使其產生更多CO2,待壓力表上壓力為1.5左右時,出氣口接上通往培養器內的管子即可。為了保證安全,在壓力表處接上自動泄壓閥,也可手動泄壓,防止瓶內壓力過高。
1.2.2 培養裝置的制作。光照:用8條LDE長條燈帶環繞在玻璃培養器周圍,頂部裝上吸頂燈環形替換光源。測得內部光照強度大約為3 000lx。循環:玻璃培養器內部裝上兩個多功能潛水泵,提供內部的水循環,且保證一定的攪拌效果,防止過多的小球藻沉淀。通氣:外部裝上超靜音增氧泵和CO2發生器,通過橡膠管接入培養器內;每根橡膠管裝上止逆閥,防止內部水倒流;培養器內的橡膠管末端接上空氣細化器,使氣體均勻進入培養器。電源的接通:以上儀器均接于智能控制插座上,可自動控制以上儀器開啟和關閉的時間。氣密性檢查:開啟增氧泵,同時集氣口接上集氣袋,觀察集氣袋是否有氣體進入,正常進入即制作完成。
1.2.3 培養基的選擇及改良。用250mL的三角瓶對本實驗室小球藻進行培養基的選擇及改良實驗。本實驗用BBM、DS、SE、HSM1四種培養基培養小球藻,對其生長情況及油脂積累情況進行比較,選出最優。同時,用最優培養基添加不同的植物激素2,4-D、6-BA 0.5mg/L,對其生長情況及油脂積累情況進行比較,選出最優作為大容器培養的培養基。
1.2.4 菌種的活化。配制HSM1固體培養基20mL,然后和事先包扎好的10個平板一起放入滅菌鍋滅菌。滅過菌之后,在超凈工作臺中開始倒完平板,待平板凝固后拿出斜面保存著的菌種,進行四區劃線。最后,將劃好線的平板放入培養箱內培養4~5d。
1.2.5 種子液的配制。配制好HSM1培養基后,對其進行滅菌。滅完菌,待冷卻后,拿出之前活化好的平板,在超凈工作臺中,挑取單菌落接入錐形瓶里的培養基中。將接好的種子液進行光照培養4~5d。
1.2.6 計數接種。對培養了5d的種子液進行計數,并通過計算得出大約接種子液100mL,使得玻璃培養器中的含藻量為105個/mL。
1.2.7 氣體的測量。用氣體收集袋收集培養器內1min所排出的氣體,再利用排水法得出氣體的體積。CO2濃度的測量:用收集袋收集培養器內的氣體,再用便攜紅外氣體分析儀測量收集袋中氣體的CO2濃度。根據氣體流量和通入氣體與流出氣體中CO2的濃度變化算出小球藻對CO2的去除量和去除率[5]。
1.2.8 生物量的測定。濁度法:從玻璃培養器中取小球藻培養液,合理稀釋后在680nm下測定其光密度值,以OD680來衡量小球藻的相對生長量。
鮮重法:在玻璃培養器充分攪拌后,取100mL培養液,8 000r/min離心后將上清液倒掉,并將離心管倒置于報紙上,使其水分充分流失,稱重。
1.2.9 回收及含油量的測定。將衰亡期的培養液進行沉淀、離心回收,并取10g的鮮菌于離心管中,加入6mol/L鹽酸6~8mL,用玻璃棒攪拌均勻,超聲波30min后放入沸水浴中水浴1d,取出放到冰中冷卻后,加入95%乙醇10mL,用力搖勻,置于冰浴中10min。向離心管中加入5mL石油醚(30~60),5mL乙醚搖勻,4 800r/min,離心4min,小心用吸管吸取醚層液,放入已知重量的試管中(重量記為[m1])。再加入3ml石油醚(30~60),3mL乙醚搖勻,4 800r/min,離心4min,小心用吸管吸取醚層液,放入同個試管中。在烘箱中由低到高逐漸升溫(不要暴沸),至85℃烘箱中干燥1h,取出冷卻稱重,直到達到恒重,重量記為[m2],既得小球藻油脂重(g)為[m=m2-m1],則可算得鮮菌的含油量。
2 結果分析
2.1 不同培養基對小球藻生長和油脂積累的影響
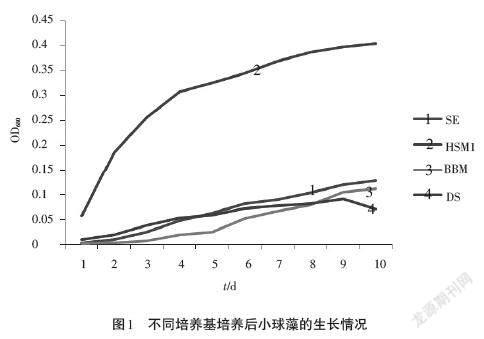
在培養小球藻的過程中,培養基是否合適至關重要。因此,在大規模培養之前,要對培養小球藻的培養基進行選擇優化,選出最優培養基,并將其改良成為適合本實驗的培養基,然后再開始進行實驗。小球藻L4在4種培養基BBM、DS、SE、HSM1中培養,培養10d后小球藻的生長情況如圖1所示。圖1中OD680為原液稀釋10倍的數值。從圖1可以看出,以HSM1為培養基能使小球藻迅速生長,且具有較大的生物量。這可能與HSM1含有較大量的NH4Cl和CH3COONa有關,NH4Cl為小球藻提供充足的氮源,而CH3COONa具有緩沖作用,防止培養基過酸而導致藻細胞大量死亡。
小球藻L4在4種培養基BBM、DS、SE、HSM1中培養,培養10d后小球藻的油脂積累情況如圖2所示。從圖2可以看出,以HSM1為培養基收獲的總油脂最多,這與其生物量大有關。因此,本實驗室保藏的小球藻適合生長于HSM1培養基中。該培養基能使小球藻在短時間內快速生長,符合培養小球藻去除CO2的實驗要求,并能在后期提供生物精煉方向的研究。在以下所有實驗中均以HSM1為基礎培養基。
2.2 不同植物激素對小球藻生長和油脂積累的影響
小球藻L4以HSM1培養基不加植物激素作為對照,添加植物激素6-BA、2,4-D培養10d,以100mL為培養單位的生長和油脂積累情況如表1所示。
從表1可以看出,在添加2,4-D的培養基中,小球藻的鮮菌重最高,但含油量低;而在添加6-BA的培養基中,雖然鮮菌重比添加2,4-D的培養基低,但含油量高。這主要是因為生物柴油是最常用的生物燃料之一,被公認為理想的可再生能源,因而也被看作為未來主要的能源來源。考慮到后期生物柴油方向的研究,選用HSM1添加植物激素6-BA為大容器培養的培養基。
2.3 大容器培養中小球藻的生物量變化
在以HSM1添加植物激素6-BA 0.5mg/L為培養基,培養時持續通入CO2和空氣,通氣量為1L/min,CO2的濃度為6.56%,光照強度為3 000lx的大容器培養中,小球藻受多種因素的影響,因此,和錐形瓶培養的結果會有所不同。大容器培養中小球藻的生長情況如圖3所示。
圖3中OD680為原液稀釋10倍的數值。從圖3可以看出,其延滯期比錐形瓶培養長了將近1d。因為通入CO2的原因,對數生長期生長情況優于錐形瓶培養。但是,在第6天提前進入了穩定期且OD680處于較低的狀態,這可能與內部水循環不充分有關,導致藻體沉淀以及生長不良。
2.4 大容器培養中小球藻對CO2的去除
小球藻在生長過程中會進行光合作用,從而吸收CO2產生O2,達到去除CO2的目的。在120L的大容器培養中,在優化的培養基中通入含6.56% CO2的空氣,通氣量為1L/min,觀察小球藻對CO2的去除情況,結果如圖4所示。
圖4上是大容器中CO2濃度的變化情況,圖4下是CO2去除率的變化情況。從圖4可以看出,小球藻在延滯期及對數生長前期吸收的CO2小于放出的CO2,之后對CO2的去除與生長具有一定的相關性。在此培養器中,有一段時間會有陽光直射,內部溫度可能會升高,使小球藻的呼吸作用加強。小球藻去除CO2的量最終會反映到生物量上來。隨著生物量的增加,顏色的加深,CO2的去除量及去除率逐漸與生長體現出相關性,培養8d時,去除率達到最高24.09%。最后,隨著小球藻生長速率減慢,對CO2的去除率逐漸降低。
2.5 大容器培養中小球藻的回收及含油量
因為小球藻具有多方面的價值,因而被廣泛應用于美容、醫療保健、生物精煉等行業。在大容器培養中,小球藻的生物量達到一定程度且穩定后,可對其進行回收利用,進行其他方面的檢測,從而充分體現小球藻的價值。培養10d,大容器中小球藻的生長已達到相對穩定。生長情況如圖5所示。
此時,生物量已達到穩定水平。但是,由于光線原因看起來會是不均勻的,后期將對光照裝置進行改良。
回收的方法是先關掉所有設備,使其沉淀2d,去除上清,留取約20L,取出用8 000r/min離心。此收集法獲得約200g鮮重,藻體含油量0.14g/L。小球藻藻體油滴的顯微拍照如圖6所示。
在圖(b)中,紅色為葉綠素,黃色為生物柴油。可見,大容器培養中小球藻的油脂較為明顯,可進一步改進提取油脂的方法。
3 討論
小球藻的生長繁殖快、抗逆性強、光合作用速率高、易于調控,適合用于生物工程技術方面的研究;同時,小球藻藻體具有很高的利用價值,具有較高的工業化潛力。因此,小球藻對CO2的固定有望成為一種可行性和經濟價值較高的CO2固定方法。
小球藻除了可應用于CO2的固定外,因營養豐富,細胞壁極薄,易于消化吸收,在水產養殖方面也具有重要的經濟價值;同時,小球藻的油脂含量高,微藻生物柴油是具有廣泛發展前景的生物柴油;在污水處理的研究中也有較大的進展等。
本文的研究僅僅是初步探索大規模培養小球藻所面臨的一些問題,而要真正深入探究及解決所帶來的問題,還需要迎接巨大的挑戰。
參考文獻:
[1]宋成軍,董保成,趙立欣,等.純二氧化碳條件下小球藻固定CO2[J].環境工程學報,2012(12):4566-4572.
[2] Morison J I L, M.T.F. Piedade, E. Müller, et al. Very high productivity of the C4aquatic grassEchinochloa polystachyain the Amazon floodplain confirmed by net ecosystem CO2 flux measurements[J]. Oecologia, 2000 125(3):400-411.
[3] Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances,2007(3):294-306.
[4] Multidisciplinary B – A. BioCO2 - a multidisciplinary, biological approach using solar energy to capture CO2 while producing H2 and high value products[J]. Biomolecular Engineering, 2007(4):405-413.
[5]楊凱,戰景明,高芬芳,等.小球藻用于生物柴油生產的研究進展[J].中國生物工程雜志,2015(11):99-104.

