益氣養陰清熱方對KKAy小鼠GLP-2、IFN-γ、NF-κB的影響
蔣云霞 陳文輝 李雙蕾 覃俏娜 陳薇宇
〔摘要〕 目的 探討益氣養陰清熱方對自發性2型糖尿病(KKAy)小鼠胰高血糖素樣肽2(glucagon-like peptide 2, GLP-2)、γ干擾素(interferon gamma, IFN-γ)、核因子κB(nuclear factor kappa beta, NF-κB)的影響。方法 取雄性SPF級KKAy小鼠50只,隨機分為模型組,二甲雙胍組,益氣養陰清熱方高、中、低劑量組,每組各10只;另取10只C57BL/6J小鼠作為正常組。各組予以相應干預。干預8周后檢測各組小鼠GLP-2、IFN-γ、NF-κB水平。結果 與正常組比較,模型組小鼠IFN-γ、NF-κB明顯升高(P<0.01),GLP-2水平明顯降低(P<0.01)。益氣養陰清熱方高、中、低劑量組均可降低KKAy小鼠IFN-γ水平(P<0.05);益氣養陰清熱方高劑量組可降低小鼠NF-κB水平(P<0.05);益氣養陰清熱方高、中、低劑量組均可升高小鼠GLP-2水平(P<0.05)。結論 益氣養陰清熱方能改善糖尿病小鼠血糖、胰島素抵抗,其作用可能與提高GLP-2水平、降低炎癥反應相關。
〔關鍵詞〕 糖尿病;益氣養陰清熱;胰高血糖素樣肽2;γ干擾素;核因子κB
〔中圖分類號〕R285.5;R255.4? ? ? ? 〔文獻標志碼〕A? ? ? ?〔文章編號〕doi:10.3969/j.issn.1674-070X.2019.06.006
〔Abstract〕 Objective To investigate the effects of Yiqi Yangyin Qingre Formula on glucagon-like peptide 2 (GLP-2), interferon-gamma (IFN-γ) and nuclear factor kappa B (NF-κB) in spontaneous type 2 diabetes (KKAy) mice. Methods A total of 50 male SPF KKAy mice were selected. They were randomly divided into a model group, a metformin group, as well as high, medium and low dose groups of Yiqi Yangyin Qingre Formula, with 10 mice in each group. And 10 C57BL/6J mice were taken as the normal group. Each group was given corresponding intervention. After 8 weeks of intervention, the levels of GLP-2, IFN-γ and NF-κB of mice were measured. Result Compared with the normal group, the levels of IFN-γ and NF-κB in the model group were increased significantly (P<0.01), and the GLP-2 level was decreased significantly (P<0.01). The IFN-γ level of KKAy mice could be decreased in the high, medium and low dose groups of Yiqi Yangyin Qingre Formula (P<0.05). The NF-κB level of mice could be decreased in the high dose group of Yiqi Yangyin Qingre Formula (P<0.05). And the GLP-2 level of mice could be increased in the high, medium and low dose groups of Yiqi Yangyin Qingre Formula (P<0.05). Conclusion Yiqi Yangyin Qingre Formula can reduce blood glucose and insulin resistance in diabetic mice, and its effects may be related to the increase of GLP-2 level and the reduction of inflammatory reaction.
〔Keywords〕 diabetes mellitus; Yiqi Yangyin Qingre; glucagon-like peptide 2; interferon-gamma; nuclear factor-kappa B
2型糖尿病發病早期多存在胰島素抵抗,研究表明,炎癥因子與糖尿病胰島素抵抗存在明顯相關[1],但是此慢性炎癥的啟動基點尚不清楚。進一步研究表明,腸黏膜屏障損傷可能是炎癥啟動的關鍵環節,而胰高血糖素樣肽2(glucagon-like peptide 2,GLP-2)有維持腸黏膜屏障功能的作用,GLP-2同時與糖代謝及胰島素抵抗也存在密切關系[2-5]。益氣養陰清熱方是廣西名中醫李雙蕾教授的經驗方,既往研究已經證實其可改善血糖及胰島素抵抗[6],有效降低2型糖尿病患者的炎癥因子水平[7]。前期實驗研究已表明益氣養陰清熱方能改善糖尿病小鼠胰島素抵抗,降低空腹及隨機血糖,其機制可能是通過抑制炎癥反應來實現[8]。本研究在此基礎上,擬進一步觀察益氣養陰清熱方對KKAy小鼠GLP-2、γ干擾素(interferon gamma, IFN-γ)、核因子κB(nuclear factor kappa beta, NF-κB)的影響,探討其可能通過改善腸道黏膜屏障,進而降低炎癥反應、改善胰島素抵抗的作用機制。
1 材料
1.1? 動物
SPF級5周齡雄性自發性2型糖尿病(KKAy)小鼠50只,5周齡雄性SPF級C57BL/6J小鼠10只,體質量均為19~33 g,由北京華阜康生物科技股份有限公司提供。動物許可證號:SYXK(桂)2014-0003。
1.2? 藥物與試劑
益氣養陰清熱方(由生黃芪30 g,黃連9 g,知母20 g,麥冬20 g,連翹9 g,淮山藥20 g組成),單味中藥濃縮顆粒劑,江陰天江藥業有限公司,批號:1611021。鹽酸二甲雙胍片:上海信誼天平藥業有限公司,批號:1660706;0.9%氯化鈉注射液:山東康寧藥業有限公司,批號:A16031901。
血糖試紙:羅氏卓越型血糖儀試紙,羅氏診斷產品有限公司。小鼠血清胰島素(fasting insulin,FINS)測定ELISA試劑盒、小鼠胰GLP-2測定ELISA試劑盒、小鼠IFN-γ測定ELISA試劑盒、小鼠NF-κB測定ELISA試劑盒,均由武漢華美生物工程有限公司提供。
1.3? 儀器
ACCU-CHEK Performa Nano血糖儀,德國羅氏;T-5000型電子天平,國雙杰兄弟(集團);Eppendorf5840R冷凍高速離心機,德國Eppendorf公司;型號5810R高速冷凍離心機,德國Eppendorf公司;型號Nanodrop2000微量紫外分光光度計,美國Thermo;Aeroset全自動生化分析儀,日本TOSHIBA公司;MK3酶標儀,芬蘭Labsystems Multiskan。
2 方法
2.1? 造模與干預
KKAy小鼠及C57BL/6J小鼠5周齡,以普通全價顆粒飼料適應性喂養1周后,KKAy小鼠改為高脂飼料(成分:粗蛋白17.98%,粗纖維4.45%,粗脂肪19.42%,粗灰分7.42%,水分8.98%,碳水化合物48.47%)喂養2周;尾靜脈取血測隨機血糖≥13.9 mmol/L[9],且維持72 h,為造模成功。將造模成功KKAy小鼠隨機分為模型組,二甲雙胍組,益氣養陰清熱方高、中、低劑量組(以下簡稱為中藥高、中、低劑量組),每組10只;另取C57BL/6J小鼠10只作為正常組。按二甲雙胍組(0.2 g/kg)、中藥高劑量組(2 g/kg)、中藥中劑量組(1 g/kg)、中藥低劑量組(0.5 g/kg)灌胃,灌胃容積0.5 mL。模型組、正常組:灌服等體積0.9%生理鹽水。干預周期為8周。
2.2? 觀察指標與檢測
于連續用藥8周后,停藥,禁食不禁水12 h,眶靜脈取血,靜置2~3 h后,4 ℃、3 000 r/min離心15 min,分離血清,分裝,-20 ℃保存,采用ELISA法測定GLP-2、IFN-γ、NF-κB水平。
2.3? 統計學處理
采用SPSS 22.0軟件分析,計量資料實驗數據以“x±s”表示,組間均數比較采用單因素方差分析,方差不齊時應用非參數秩和檢驗,P<0.05為差異有統計學意義。
3 結果
3.1? 對糖尿病小鼠IFN-γ、NF-κB水平的影響
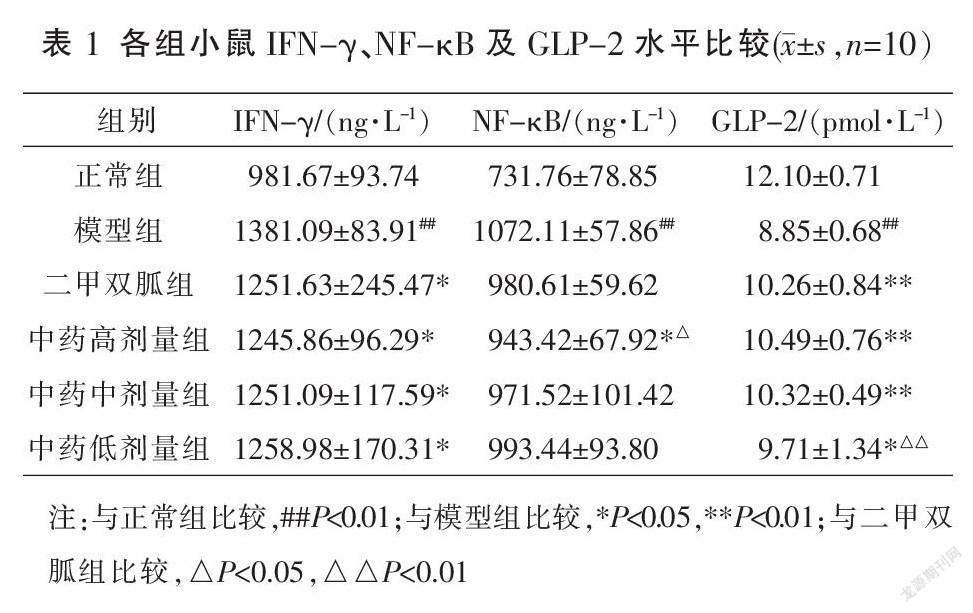
與正常組比較,模型組小鼠IFN-γ、NF-κB水平顯著升高(P<0.01)。與模型組比較,中藥高、中、低劑量組均可降低IFN-γ水平(P<0.05),其作用與二甲雙胍組相當(P>0.05)。中藥高劑量組可降低NF-κB水平(P<0.05),而中藥中、低劑量組及二甲雙胍組作用并不明顯(P>0.05)。見表1。
3.2? 對糖尿病小鼠GLP-2水平的影響
與正常組比較,模型組小鼠GLP-2水平顯著降低(P<0.01)。與模型組比較,中藥高、中、低劑量組均可升高GLP-2水平(P<0.05),中藥高、中劑量組其作用與二甲雙胍組相當(P>0.05)。見表1。
4 討論
2型糖尿病是一種以胰島素抵抗為主要機制的內分泌代謝性疾病。近年來對糖尿病胰島素抵抗機制的研究表明,IFN-γ、NF-κB等多種炎癥因子參與到了胰島素抵抗的過程中[8,10-12],胰島素抵抗是一種慢性炎癥過程。而在此過程中慢性炎癥是如何啟動的仍需要進一步研究。
正常狀態下,腸道中含有大量潛在的內毒素和致病菌,而完整健康的腸黏膜屏障可以有效地防止腸道內的內毒素和細菌進入體內,對機體形成天然的保護,維持機體內環境的相對穩定。一旦這種平衡狀態被打破,發生菌群失調,細菌及其毒素就可能通過啟動炎癥反應,破壞腸黏膜屏障功能,進而導致全身的慢性炎癥反應,參與肥胖和胰島素抵抗進程[13]。
而在維持腸黏膜屏障功能中GLP-2起到至關重要的作用。GLP-2被認為是一種生理狀態下的腸道營養因子,特異性地作用于腸道的黏膜、黏膜下和肌間神經元、柱狀上皮的祖細胞,促進柱狀上皮細胞增生和營養底物吸收,加速包括內分泌細胞在內的整個腸隱窩部細胞群的分化、生長和修復,從而增加小腸的重量、蛋白質的合成、絨毛的高度和隱窩深度,降低腸道通透性[2,14]。同時,GLP-2亦屬于胰高血糖素原衍生肽類,是胰高血糖素原基因的表達產物之一,有研究顯示,GLP-2可通過促進腸道葡萄糖吸收調節葡萄糖穩態[2],肥胖患者體內GLP-2水平與胰島素敏感指數呈明顯的正相關關系[3],同時,敲除中樞 GLP-2受體的大鼠葡萄糖耐量減低,并且表現出胰島素抵抗,而中樞輸注GLP-2可改善血糖[4]。2型糖尿病大鼠腸黏膜屏障受損,GLP-2水平也隨之下降[5]。因此,GLP-2在維持腸道屏障功能,抑制炎癥反應,改善胰島素抵抗方面具有重要作用。
中醫學認為,糖尿病屬“消渴”“消癉”等范疇[15],許多學者也從“虛”“熱”論治其重要性[16]。《證治要訣·三消》曰:“三消得之氣之實,血之虛,久久不治,氣盡虛,則無能為力矣。”因而采用益氣養陰清熱治法在糖尿病治療中具有獨特療效。
李雙蕾教授根據多年臨床經驗,在“氣陰虧虛,熱毒為患”的理論基礎上,精選藥物組成益氣養陰清熱方,該方由生黃芪、黃連、知母、麥冬、連翹、淮山藥組成。《神農本草經》談到黃芪可“補丈夫虛損,五勞羸瘦,止渴,腹痛泄痢,益氣,利陰氣”,故以黃芪為君,補中益氣,脾氣健旺,則水道通調;山藥健脾補肺,固腎益精,黃連清熱解毒,燥濕堅陰,二者為臣;知母瀉三焦虛火,麥冬養陰除煩,滋養匱乏之胃陰,二者相和,養陰清熱而共為佐藥;連翹清熱解毒,散結消腫,一清熱毒,二防補益太過,聚而為毒,為佐使之用。全方共奏益氣養陰,清熱解毒之效。
本研究結果顯示,KKAy小鼠血清中的IFN-γ、NF-κB明顯升高,說明胰島素抵抗糖尿病小鼠處于炎癥反應狀態,與課題組以往研究結果一致。而益氣養陰清熱方能夠降低IFN-γ、NF-κB水平,說明其具有抑制低度炎癥的作用。同時研究結果顯示,KKAy小鼠血清中的GLP-2水平明顯降低,說明胰島素抵抗糖尿病小鼠的腸道黏膜屏障功能下降。而益氣養陰清熱方可升高小鼠體內GLP-2水平,提示益氣養陰清熱方可能通過提高體內GLP-2水平,改善腸道黏膜屏障功能,進而減少慢性炎癥反應,改善胰島素抵抗和血糖水平。
參考文獻
[1] BOLAND L, BURAND A J, BROWN A J, et al. IFN-γ and TNF-α Pre-licensing protects mesenchymal stromal cells from the pro-inflammatory effects of palmitate[J]. Molecular Therapy, 2018,26(3):860-873.
[2] GUAN X, STOLL B, LU X, et al. GLP-2-mediated up-regulation of intestinal blood flow and glucose uptake is nitric oxide-dependent in TPN-fed piglets 1[J]. Gastroenterology, 2003,125(1):136-147.
[3] GELONEZE B, LIMA M M, PAREJA J C, et al. Association of insulin resistance and GLP-2secretion in obesity: a pilot study[J]. Arquivos Brasileiros de Endocrinologia & Metabologia, 2013,57(8): 632-635.
[4] SHI X, ZHOU F G, CHANG? B, et al. Central GLP-2 enhances hepatic insulin sensitivity via activating PI3K signaling in POMC neurons[J]. Cell Metabolism, 2013,18(1):86-98.
[5] SHAN C Y, YANG J H, KONG Y, et al. Alteration of the intestinal barrier and GLP2 secretion in Berberine-treated Type 2 diabetic rats[J]. Journal of? Endocrinology, 2013, 218(3): 255-262.
[6] 李雙蕾,陳文輝,陳莉娜,等.益氣養陰清熱方對初發2型糖尿病患者胰島素抵抗的影響[J].廣西中醫藥,2012,35(4):9-12.
[7] 李雙蕾,陳莉娜,趙? 偉,等.益氣養陰清熱方對2型糖尿病患者炎癥因子的影響[J].中華中醫藥雜志,2013,28(3):474-748.
[8] 蔣云霞,李雙蕾,陳文輝,等.益氣養陰清熱方對糖尿病KKAy小鼠血清胰島素及TNF-α、IL-6的影響[J].世界中西醫結合雜志,2018,13(9):1248-1251.
[9] 劉曉丹,楊? 剛,范秋靈,等.自發性2型糖尿病動物模型KKAy小鼠腎臟損害的特征與演變[J].中國醫科大學學報,2011,40(2):104-106.
[10] SCHMIDT F M, WESCHENFELDER J, SANDER C, et al. Inflammatory cytokines in general and central obesity and modulating effects of physical activity[J]. PloS ONE, 2015, 10(3):e0121971.
[11] GUZIK T J, SKIBA D S, TOUYZ R M, et al. The role of infiltrating immune cells in dysfunctional adipose tissue[J]. Cardiovascular Research, 2017,113(9):1009-1023.
[12] KIECHL S, WITTMANN J, GIACCARI A, et al. Blockade of receptor activator of nuclear factor-κB (RANKL) signaling improves hepatic insulin resistance and prevents development of diabetes mellitus[J]. Nature Medicine, 2013,19(3):358-363.
[13] SHI H, KOKOEVA M V, INOUYE K, et al. TLR4 links innate immunity and fatty acid- induced insulin resistance[J]. The Journal of Clinical Investigation, 2006,116(11):3015-3025.
[14] CAMERON H L, PERDUE M H. Stress impairs murine intestinal barrier function: improvement by glucagon-like peptide-2[J]. The Journal of Pharmacology and Experimental Therapeutics, 2005,314(1):214-220.
[15] 仝小林.糖尿病中醫藥臨床循證實踐指南[M].北京:科學出版社,2016:19.
[16] 張? 翔,喻? 嶸,曾? 婧,等.從“熱”論消渴[J].湖南中醫藥大學學報,2015,35(6):27-31.

