3種白鯽雜交子代的轉錄組學分析
周大顏 張志新 黃彩林 招志杰 莫飛龍


摘要:【目的】研究3種白鯽雜交子代轉錄組學特征,為揭示鯽鯉雜交優勢的分子機理提供理論依據,同時為在生產上培育出生長速度快、肉質好、適應能力強的雜交品種提供技術參考。【方法】以白鯽(♀)×黑龍江野鯉(♂)雜交子代(簡稱HB)、白鯽(♀)×散鱗鏡鯉(♂)雜交子代(簡稱SB)和白鯽(♀)×興國紅鯉(♂)雜交子代(簡稱XB)為研究對象,利用RNA-seq高通量測序技術構建3種白鯽雜交子代轉錄組文庫,以HiSeq PE150進行測序分析,原始序列經Trinity組裝后進行功能注釋(E-value<1e-5);以DESeq2 R鑒定差異表達基因,利用GOseq R和KOBAS分別對差異表達的基因進行GO和KEGG富集分析;并采用MicroSAtellite對轉錄本中的SSR位點進行挖掘。【結果】共組裝得225858條unigenes,平均長度為668 bp,N50為938 bp,有171461條unigenes可注釋到蛋白質數據庫(Nr)、非冗余核苷酸數據庫(Nt)、蛋白質序列數據庫(SwissPort)、基因本體論(GO)、直系同源基因簇(COG/KOG)和京都基因與基因組百科全書(KEGG)數據庫中,注釋比例為75.92%。其中,52630條unigenes注釋到NR數據庫,43659條unigenes注釋到SwissPort數據庫,35756條unigenes注釋到COG/KOG數據庫,包括生化代謝、信號轉導機制、防御系統和細胞結構等。差異表達基因KEGG分析結果顯示,較多的差異表達基因注釋到內吞作用、Jak-STAT信號通路、溶酶體、吞噬體和Wnt信號通路等免疫相關及與生長發育相關的MAPK信號通路、Hippo信號通路和背腹軸形成等通路中。此外,從獲得的轉錄組序列中共鑒定出20272個SSR位點,大多數為二核苷酸重復基元(占62.15%)。【結論】不同白鯽雜交子代間存在較多的差異表達基因,從中獲得參與抗氧化、免疫和生長發育相關的通路和基因序列,且挖掘出20272個SSR位點,有助于選擇性育種、分子標記開發及開展遺傳多樣性、遺傳圖譜構建和QTL定位等研究。
關鍵詞: 白鯽;雜交子代;轉錄組;信號通路;SSR位點
中圖分類號:? S965.117? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼: A 文章編號:2095-1191(2019)06-1328-11
Abstract:【Objective】Transcriptomics characteristics of three Carassius auratus cuvieri hybrids were studied to provide reference for molecular mechanism of hybrid heterosis of the hybrids, and also to offer technical support for breeding hybrids with rapid growth, quality meat and strong adaptability. 【Method】Three white crucian carp hybrids i.e. C. auratus cuvieri(♀)×Cyprinus carpio haermatopterus(♂)(abbreviated as HB), C. auratus cuvieri(♀)×C. carpio L.(♂)(abbreviated as SB) and C. auratus cuvieri(♀)×C. carpio var. singuonensis(♂) (abbreviated as XB) were used as research objectives. RNA-seq high-throughput sequencing was used to construct C. auratus cuvieri hybrids transcriptome library.? HiSeq PE150 was used to conduct sequencing analysis, and the function annotation on original sequence after Trinity assembling was carried out(E-value<1e-5). Differentially expressed genes was identified by DESeq2 R, then GO and KEGG enrichment analysis of differentially expressed genes were conducted by GOseq R and KOBAS respectively. MicroSAtellite was used to dig SSR loci in transcript. 【Result】A total of 225858 unigenes, with average length of 668 bp and N50 of 938 bp were generated. Of these, a total of 171461 unigenes could be annotated in protein sequence database(Nr), non-redundant nucleotide database(Nt), protein sequence database(SwissProt), Gene Ontology database(GO), Clusters of Ortho-logous Groups(COG/KOG) and Kyoto Encyclopedia of Genes and Genomes(KEGG) database. The annotation ratio was 75.92%. There were 52630 unigenes annotated in NR database, 43659 unigenes annotated in SwissPort database, 35756 unigenes annotated in COG/KOG database, including biochemical metabolism, signal transduction mechanism, defensive system and cell structure. KEGG analysis of differentially expressed genes showed that more differentially expressed genes were involved in immune-related pathways such as endocytosis, Jak-STAT signaling pathway, lysosome, phagosome and Wnt signaling pathways, and growth and development related pathways such as MAPK signaling pathway, Hippo signaling pathway and dorso-ventral axis formation. In addition, 20272 SSR loci were identified from transcriptome sequence and majority of which were dinucleotide repeats units(accounted for 62.15%). 【Conclusion】There are many differentially expressed genes in different hybrids. Some pathways and gene sequences involved in antioxidation, immunity, growth and development are preliminarily obtained. A total of 20272 SSR loci are dug. This result is helpful for selective breeding, molecular markers development, researches in genetic diversity, genetic map construction and QTL mapping.
Key words: Carassius auratus cuvieri; hybrid; transcriptome; signal pathway; SSR locus
收稿日期:2018-10-13
基金項目:農業部物種品種資源(漁業)保護費項目(171721301354052099);廣西海洋和漁業廳預算項目(桂海漁財〔2018〕97號)
作者簡介:周大顏(1981-),主要從事水產動物遺傳育種與養殖推廣研究工作,E-mail:4948738@qq.com
0 引言
【研究意義】我國水生生物多樣性豐富,許多種類經人工馴化及繁育后已發展成為重要的經濟水產品種。其中,鯉科(Cyprinidae)的多樣性尤為突出,在現存的800余種淡水魚中,鯉科魚類約占50%。鯉魚養殖迄今已有2400余年歷史,是池塘、稻田和網箱等養殖的主要對象,在天然水域產量中也占有很高比例(朱健等,2000)。遺傳組成不同的個體或群體結合后,其遺傳物質重新組合而形成新品種的現象稱為雜交(Zhang et al.,2014),在自然界中普遍存在。雜交育種作為一種常規的育種手段,在水生生物品種改良和生產中發揮重要作用,是獲得新品種的重要途徑之一(Arcella et al.,2014),且雜交獲得的F1代通常在生產、生活、繁殖和適應性等方面具有優于雙親均值或超過親本的雜交優勢(Jin et al.,2017)。因此,基于轉錄組學分析技術開展雜交優勢分子機理研究,對加速水產動物選擇性育種、分子標記開發及遺傳多樣性分析等具有重要意義。【前人研究進展】目前,國內外關于水產動物雜交的研究已有大量報道,如梭子蟹(Portunus trituberculatus)(Gao et al.,2014)、牙鲆(Paralichthys olivaceus)(Liu et al.,2014)、鯰魚雜交種(Pseudoplatystoma sp.)(Sinhorin et al.,2014)、石斑魚(Epinephelus fuscoguttatus ♀×E. lanceolatus ♂)(Firdaus et al.,2016)、鮑魚(Haliotis discus hannai)(Li et al.,2017)、牡蠣(Crass-ostrea sikamea×C. angulata)(Yan et al.,2017)和中華鱉(Pelodiscus sinensis)(Zhang et al.,2017b)等,其中又以不同鯉魚品種間雜交的效果最好(樓允東,1999)。我國已培育出具有顯著雜種優勢的豐鯉(Cyprinus carpio var. singuonensis ♀×C. carpio L.♂)、荷元鯉(C. carpio var. wuyuanensis ♀×C. carpio var. yuankiang ♂)、荷花鯉(C. carpio L. ♀×C. carpio var. singuonensis ♂)和三雜交鯉(Heyuan carp ♀×C. carpio L. ♂)等雜交種(Liu et al.,2017),且均已得到推廣養殖,但目前針對雜交鯉的研究仍停留在形態學特征、主要經濟性狀、遺傳變異及親子鑒定等方面(劉義新等,2007;武耀等,2012;Liu et al.,2018)。隨著基因組測序技術的快速發展,轉錄組測序技術已成為挖掘缺乏基因組信息物種功能基因的重要手段(唐玉娟等,2018),在經濟魚類雜交后代的雜種優勢研究中得到廣泛應用。Bougas等(2010)對3個美洲紅點鮭(Salvelinus fontinalis Mitchill)群體及其雜交后代進行轉錄組學分析,結果顯示不同群體雜交后代表現出不同的基因表達模式和生長優勢。Gao等(2013)對雜交河豚(Jiyan-1 Puffer)及其親本(Takifugu rubripes ♀×T. flavidus ♂)進行轉錄組測序分析,結果發現雜種優勢的形成可能與能量代謝、離子結合和激酶激活等過程有關。Liu等(2018)對白鯽(Carassius auratus ♀)和紅鯽(C. auratus red var. ♂)及其雜交F1代的轉錄組進行測序,GO分析結果顯示,F1代的雜合基因與代謝過程、免疫系統和生長發育有關。【本研究切入點】白鯽(C. auratus cuvieri)又稱日本白鯽,隸屬于鯉形目(Cypriniformes)鯉科(Cyprinidae)鯉亞科(Cyprinae)鯽屬(Carassius),原產于日本琵琶湖,于1976年引進我國,體色為白色,具有繁殖力強、食性廣、生長速度快、適應性強等優點,但其肉質欠佳(王靜等,2015)。黑龍江野鯉(C. carpio haermatopterus)與黃河、長江、遼河等野鯉同屬一個亞種,起源于歐洲野鯉,在長期的進化過程中黑龍江野鯉對于黑龍江流域多變的水溫環境已完全適應,具有極強的抗寒能力和抗病能力(朱健等,2014)。散鱗鏡鯉(C. carpio L.)原產于前蘇聯,于1959年引入我國,抗逆性強、生長速度快,是雜交選育的重要親本來源(李盛文等,2014)。興國紅鯉(C. carpio var. singuonensis)主要分布在江西興國縣,已有超過1300年的養殖歷史,其溫度適應范圍廣、易于飼養、產卵量大,是重要的雜交親本,在我國魚類雜交育種中占據重要地位(岳華梅等,2016)。以白鯽為母本,分別與黑龍江野鯉、散鱗鏡鯉和興國紅鯉雜交,均可獲得具有明顯雜交優勢的雜交F1代,但其雜交優勢的分子機理尚未明確,因此有必要利用轉錄組測序技術從基因層面揭示鯉魚雜交優勢的分子機理。【擬解決的關鍵問題】通過RNA-seq高通量轉錄組測序、組裝和分析,對3種白鯽雜交子代進行轉錄組學特征研究,以期為揭示鯽鯉雜交優勢分子機理提供理論依據,同時為在生產上培育出生長速度快、肉質好、適應能力強的雜交品種提供技術參考。
1 材料與方法
1. 1 試驗材料
供試魚為白鯽(♀)×黑龍江野鯉(♂)雜交子代(簡稱HB)、白鯽(♀)×散鱗鏡鯉(♂)雜交子代(簡稱SB)和白鯽(♀)×興國紅鯉(♂)雜交子代(簡稱XB),由廣西水產引育種中心武鳴基地提供。試驗前,先在室內養殖池中隔離暫養10 d,饑餓48 h后從不同雜交子代中分別挑選200尾體質健康、規格一致的供試魚。經測量發現,HB、SB和XB供試魚的平均體重分別為31.9、32.0和32.3 g/尾,并分別在腹腔注射PIT電子標記,記錄標記號后放入池塘殖。
1. 2 養殖管理
每天上、下午各投喂1次;每晚開增氧機增氧;每隔25 d潑灑聚維酮碘(水產用)1次,進行水體消毒和疾病預防。養殖周期共90 d(2017年7月25日—2017年10月24日)。
1. 3 樣品采集
養殖結束后,從HB、SB和XB供試魚中隨機抽取樣品魚各30尾,用無菌手術刀剪取肌肉、魚肝和魚皮,分別裝入標識好的無RNA酶試管中,經液氮速凍后置于-80 ℃冰箱中保存備用。
1. 4 RNA提取
取樣品魚的肌肉、肝臟和魚皮,置于經高壓滅菌的研缽中加液氮研磨成粉狀,然后參照Invitrogen公司的TRIzol Reagent說明提取組織總RNA。以TURBO DNA-FreeTM Kit(Ambion,Thermo Fisher Scientific,USA)消除總RNA中的DNA后,分別用1%非變性瓊脂糖凝膠電泳(120 V,10 min)檢測RNA的完整性、NanoDrop 2000超微量分光光度計(Thermo Fisher Scientific,USA)檢測RNA純度和濃度。
1. 5 轉錄組文庫構建及測序
取檢測合格的各組織RNA等量混合(總量1 μg)后進行文庫構建和測序。用攜帶Oligo(dT)的磁珠富集含poly(A)尾巴的mRNA,隨后加入Fragmentation Buffer打斷mRNA,以片段化的mRNA為模板,采用六堿基隨機引物合成單鏈cDNA;再加入緩沖液、dNTPs、RNase H和DNA聚合酶I合成cDNA第二鏈,經QiaQuick PCR試劑盒純化并加入EB緩沖液洗脫后進行末端修復及加poly(A)尾巴,并連接測序接頭;以瓊脂糖凝膠電泳進行片段大小篩選,最后進行PCR擴增,構建好的文庫采用HiSeq PE150進行測序分析。
1. 6 序列組裝及功能注釋
由測序獲得的數據稱為raw reads,先對raw reads進行質控(QC),去除測序過程中低質量序列及不確定序列;采用轉錄組組裝軟件Trinity對過濾后的clean reads進行組裝,選取每個transcript cluster中最長的轉錄本作為unigene。以NCBI蛋白質數據庫(Nr)、非冗余核苷酸數據庫(Nt)、蛋白質序列數據庫(SwissPort)、基因本體論(GO)、直系同源基因簇(COG/KOG)和京都基因與基因組百科全書(KEGG)數據庫作為參考,對所獲得的unigene進行功能注釋(E-value<1e-5)(Zhang et al.,2017a)。
1. 7 差異表達基因分析
采用RPKM(Reads per kilo bases per million reads)衡量基因表達量(Li and Dewey,2011),并以DESeq2 R進行差異表達基因篩選,篩選標準為錯誤發現率P≤0.05,|log2ratio|≥1(Yan et al.,2017)。利用GOseq R(Young et al.,2010)和KOBAS(Mao et al.,2005)分別對差異表達的基因進行GO和KEGG富集分析,其中,GO富集分析以corrected-pvalue≤0.05為閾值,滿足此條件即定義為在差異表達基因中顯著富集的GO term;Pathway顯著性富集分析以KEGG Pathway為單位,應用超幾何檢驗,當Q value≤0.05即定義為在差異表達基因中顯著富集的Pathway。
1. 8 SSR分子標記鑒定
利用MicroSAtellite(MISA,http://pgrc.ipk-gater-sleben.de/misa/)對轉錄本中的SSR位點進行挖掘,為鑒定二、三、四、五和六核苷酸重復基元,對應的閾值分別被設為 6、5、4、4和4(Zhou et al.,2013)。根據堿基互補配對原則,將所有互補的簡單重復序列視為一類,其中,二核苷酸重復基元4種(AT、AG、AC和CG),三核苷酸重復基元10種,四核苷酸重復基元33種,五核苷酸重復基元102種,六核苷酸重復基元350種。
2 結果與分析
2. 1 測序數據的產出和組裝結果
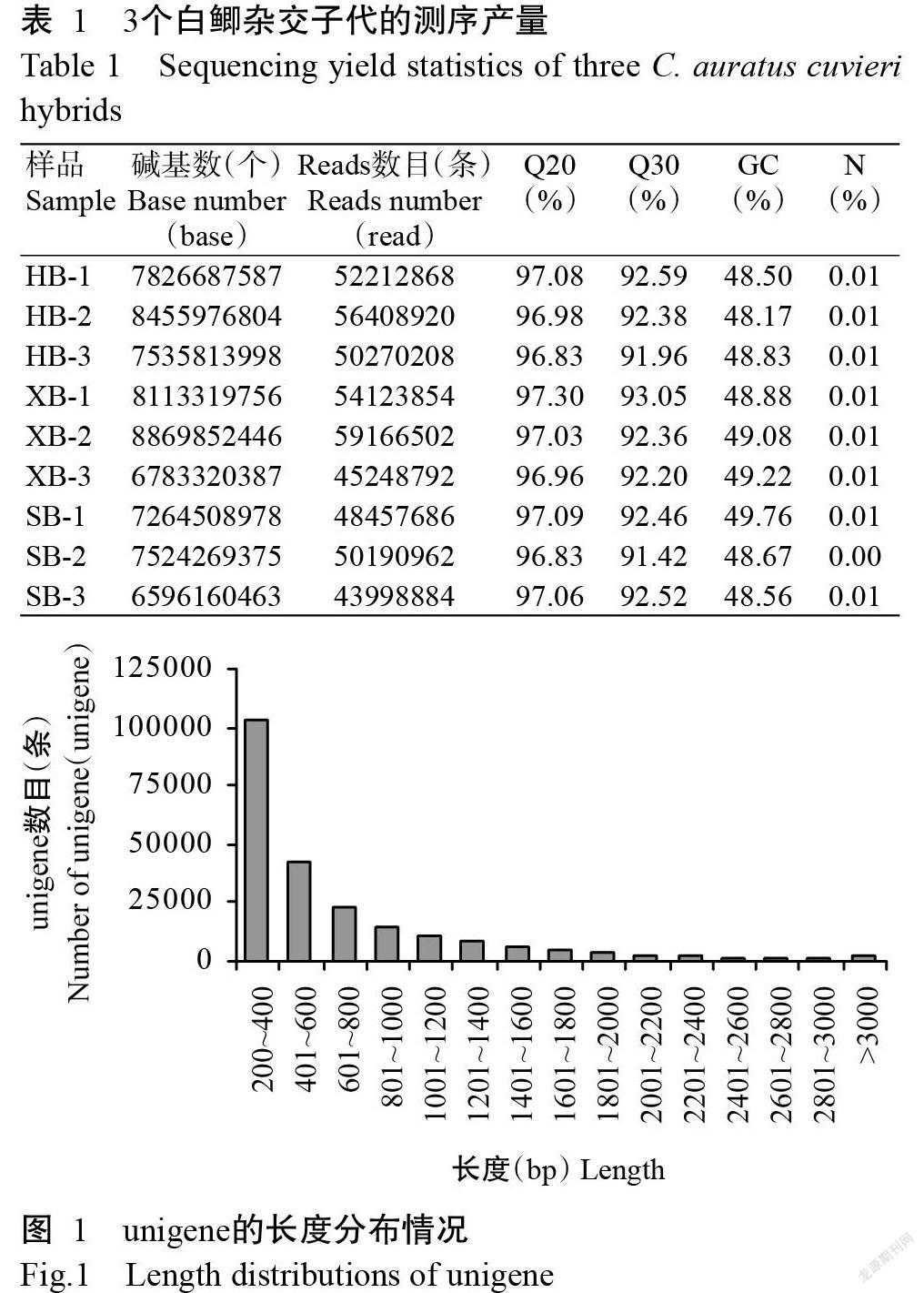
為保證數據質量,對各測序樣品的原始數據進行質控和過濾。去除低質量、含接頭序列的reads后,得到的clean reads如表1所示。各樣品測序質量不低于20(Q20)的堿基占總堿基比例均在96.00%以上,質量不低于30(Q30)的堿基占比在90.00%以上,GC含量則低于50.00%。采用Trinity對所有clean reads進行從頭組裝后,共得到225858條unigenes,總長150956990 bp,平均長度668 bp,N50為938 bp。其中,有102591條(45.42%)的unigenes長度在200~400 bp,42555條(18.84%)的unigenes長度在400~600 bp,長度在1000 bp以上的unigenes有42723條(18.91%)(圖1)。
2. 2 功能注釋及分類結果
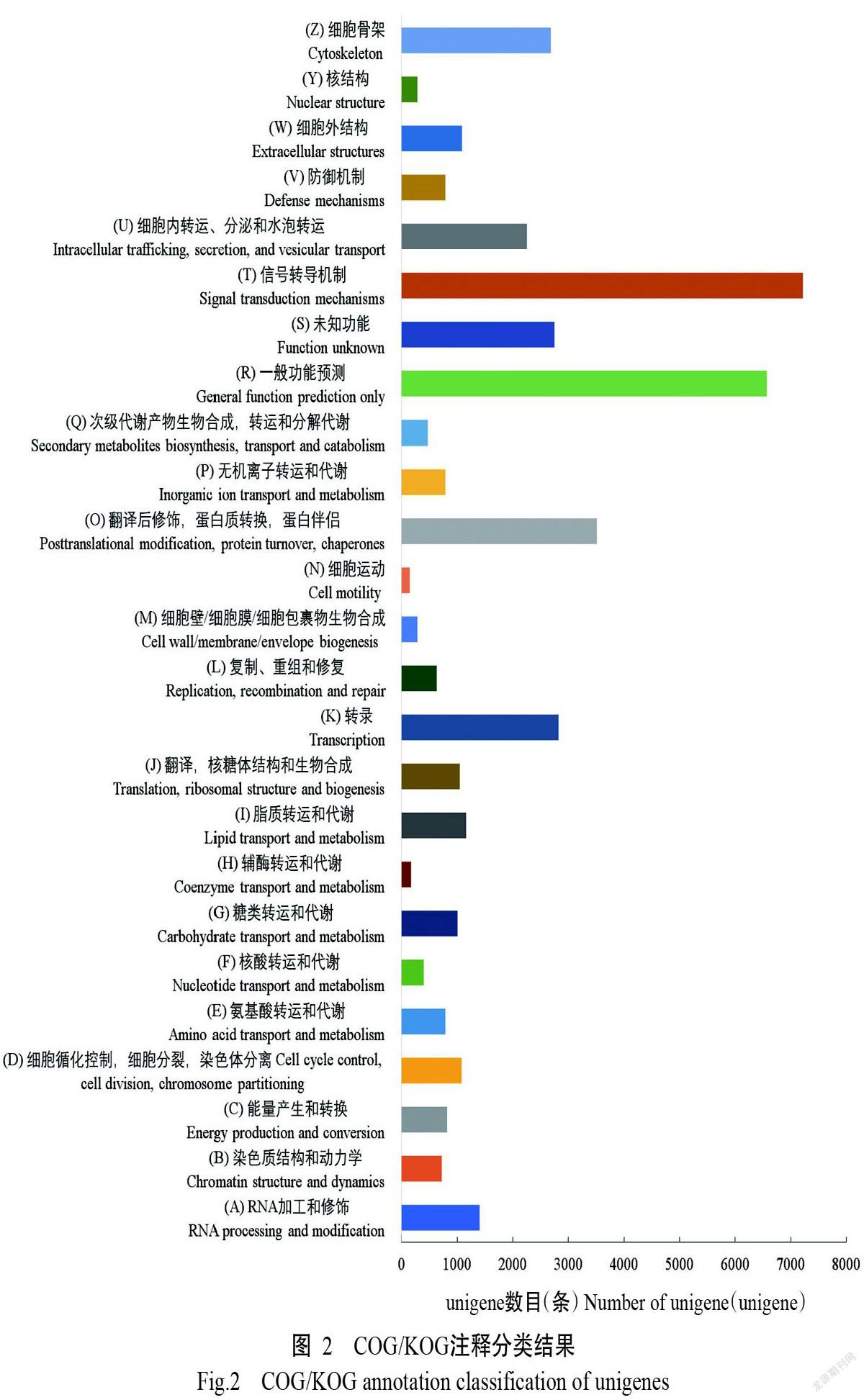
將所有unigenes分別與NR、SwissProt、KEGG和COG/KOG(E-value<1e-5)等數據庫中的相關序列進行BLASTx比對分析,找出與指定unigene具有最高序列相似性的蛋白,從而獲知unigene的蛋白功能注釋信息。結果顯示,在225858條unigenes中有171461條獲得蛋白功能注釋信息,注釋比例為75.92%。其中,52630條unigenes注釋到NR數據庫,43659條unigenes注釋到SwissPort數據庫,35756條unigenes注釋到COG/KOG數據庫,包括生化代謝、信號轉導機制、防御系統和細胞結構等(圖2)。此外,有28164條unigenes注釋到不同的KEGG通路中(圖3),最有代表性的是信號轉導通路(4215條)、細胞通訊(2253條)、內分泌系統(2059條)及轉運和分解代謝(2058條)(表2)。
2. 3 差異表達基因的篩選及其功能注釋
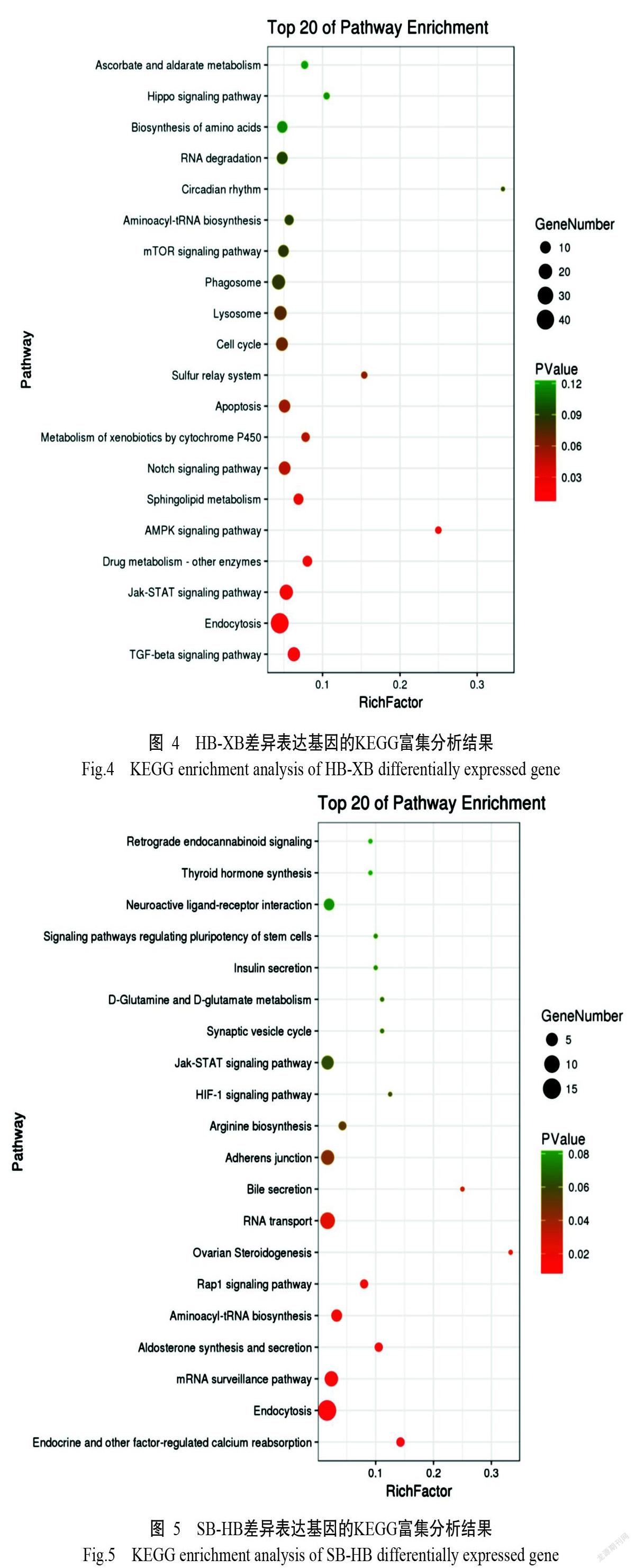
HB、SB和XB 3種雜交子代兩兩進行差異表達基因篩選分析,結果顯示,HB和XB間(HB-XB)的差異表達基因有6448個,其中上調基因2064個、下調基因4384個;SB和HB間(SB-HB)的差異表達基因有1615個,其中上調基因1053個、下調基因562個;SB和XB間(SB-XB)的差異表達基因有4249個,其中上調基因2290個、下調基因1959個。對這些差異表達基因進行KEGG通路分析,結果發現,在HB-XB的差異表達基因中,有較多基因注釋到內吞作用、Jak-STAT信號通路、溶酶體和吞噬體(圖4);在SB-HB的差異表達基因中,以注釋到內吞作用、mRNA監測通路、RNA轉運和粘著連接中注釋的差異表達基因較多(圖5);在SB-XB的差異表達基因中,較多基因注釋到內吞作用、吞噬作用、Wnt信號通路和RNA轉運通路中(圖6)。
2. 4 SSR位點鑒定結果
將拼接所得序列提交至MISA進行分析,共得到20272個SSR位點,其中有2359條序列包含1個以上的SSR位點。根據重復單元的類型和重復次數對SSR位點進行分類,結果發現二核苷酸重復基元的SSR位點數最多,為12594個,占全部重復序列的62.15%;其次是三核苷酸重復基元的SSR位點(5318個),占26.25%;四、五和六核苷酸重復基元的SSR位點較少(1826、371和163個),占比分別為9.00%、1.80%和0.80%。
2. 5 重復性檢驗結果
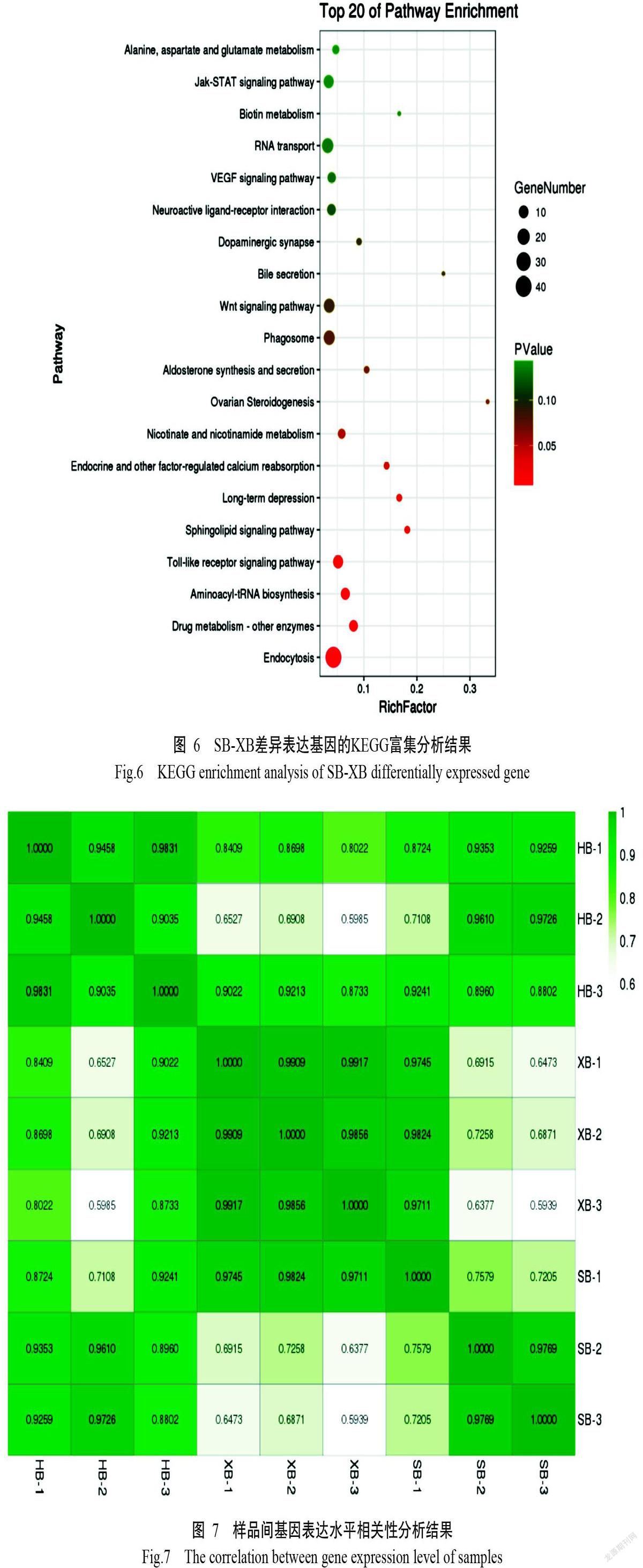
在轉錄組學研究中通常以相關性熱圖展示樣品間的關系,而樣品間基因表達水平相關性是檢驗試驗可靠性和樣品選擇是否合理的重要指標。根據RPKM定量結果,計算出所有樣品(每個樣品3個重復)兩兩間的相關系數(圖7),發現相關系數均在0.5900以上,說明樣品檢測的重復性較好,結果可信度較高。
3 討論
近年來,高通量測序技術已廣泛應用于模式和非模式生物的相關研究領域,如在興國紅鯉、白鯽、紅鯽及紅白鯽雜交子代中均有利用高通量測序技術進行轉錄組學分析的研究報道(岳華梅等,2016;Zhang et al.,2017c;Liu et al.,2018)。在轉錄組學研究中,為獲取較多轉錄本以避免個體變異而產生的負面影響,通常從不同組織或個體中提取RNA,等體積混合后進行轉錄組測序分析(Huang et al.,2012;Li et al.,2012;Liao et al.,2013;李冰冰等,2017)。本研究利用RNA-seq高通量測序技術對3種白鯽雜交子代進行轉錄組學測序分析,共得到225858條unigenes,平均長度為668 bp,N50為938 bp。與紅白鯽雜交子代轉錄組學分析結果(Liu et al.,2018)相比,本研究中的unigene數目較多,且質量較好,可能與本研究利用多個樣本多個組織的總RNA進行測序有關,所獲得的轉錄組數據相比單個組織或單個樣品測序更全面。
目前,有關水產動物雜交分子機理的研究主要集中在差異表達基因與雜種優勢的相關性方面(Zhai et al.,2013;Zhang et al.,2017a)。孫穎(2016)通過對棕點石斑魚(E. fuscogutatus ♀)×鞍帶石斑魚(E. lanceolatus ♂)雜交F1代(虎龍斑)生長優勢的轉錄組學進行研究,結果在虎龍斑中找到大量的差異表達基因,且這些差異表達基因主要分布在GH/IGF軸及其下游涉及蛋白與糖原合成的信號通路上,對虎龍斑生長優勢有重要貢獻。本研究結果表明,在白鯽(♀)×黑龍江野鯉(♂)與白鯽(♀)×興國紅鯉(♂)的雜交子代中差異表達基因最多,為6448個;其次是白鯽(♀)×散鱗鏡鯉(♂)與白鯽(♀)×興國紅鯉(♂)的雜交子代,為4249個;差異表達基因最少的是白鯽(♀)×散鱗鏡鯉(♂)與白鯽(♀)×黑龍江野鯉(♂)的雜交子代,僅有1615個;3個轉錄組的共有基因為43個。差異表達基因的KEGG分析結果顯示,大多數差異表達基因注釋到免疫相關通路中,包括內吞作用、Jak-STAT信號通路、溶酶體、吞噬體和Wnt信號通路等;也有差異表達基因注釋到Toll樣受體信號通路和NOD樣受體信號通路中。此外,從差異表達基因中鑒定出過氧化氫酶(unigene071729)、鐵蛋白(unigene045233)、peroxiredoxin-6(unigene058224)及α-2M(unigene079502)等抗氧化和免疫相關的基因,在3個白鯽雜交子代中這些基因的表達量均呈不同程度上調趨勢。免疫系統可保護生物體免受自然環境中寄生蟲或致病菌的感染,是機體產生抗病性的生理基礎,也是育種過程中進行人工選擇的重要指標之一(Rauw,2012)。免疫相關基因或通路的鑒定,既可為鯽鯉雜交的人工選育提供依據,又能佐證這些基因或通路對3個白鯽雜交子代的生長優勢具有重要貢獻。
生長速度和體重一直是選育過程中的關鍵指標。本課題組的前期研究結果表明,3種白鯽雜交子代間的體重存在顯著差異。本研究也鑒定出與生長和發育相關的差異表達基因通路,如MAPK信號通路(ko04010)、Hippo信號通路(ko04390)和背腹軸形成(ko04320)等。Zhang等(2017b)對中華鱉(Pelodiscus sinensis)的雜交子代進行轉錄組學分析,也曾鑒定出這3條通路,說明這3條通路在促進雜交子代生長和發育的過程中發揮重要作用。其中,MAPK信號通路(ko04010)和Hippo信號通路(ko04390)在調節器官發育及器官發育過程中發揮重要作用(Schaeffer and Weber,1999;Yu et al.,2012)。此外,與生長相關的表皮生長因子受體(unigene078218)、微管相關蛋白(unigene024234)、血小板源生長因子受體(unigene038197和unigene068685)等基因均明顯上調,而生長抑制蛋白(unigene067656)明顯下調。這些基因的差異表達有助于開展雜交子代的生長性狀比較分析。
分子標記是進行種群遺傳學、生物地理學及進化關系研究的關鍵(Li and Gui,2007;Jia et al.,2008;Wang et al.,2011;陳春林等,2018)。通過高通量測序技術獲得的轉錄組序列,可為分子標記的挖掘和開發提供一種更直觀、高效的方法(Davey et al.,2011;Fu and He,2012;Ji et al.,2012)。至今,利用轉錄組測序技術進行SSR分子標記挖掘在國際上已有很多成功的報道(Tian et al.,2014;Chen et al.,2015;Xiao et al.,2015)。Liao等(2013)從鯽魚的轉錄組數據庫中挖掘到11295個SSR位點,且大多數SSR位點為二核苷酸重復基元。岳華梅等(2016)從興國紅鯉的轉錄組中鑒定出13652個SSR位點,并從中隨機篩選出30個進行PCR驗證,發現有20對SSR分子標記可擴增出清晰穩定的條帶。本研究從3個白鯽雜交子代中鑒定出20272個SSR位點,其中有62.15%的SSR位點為二核苷酸重復基元,與Liao等(2013)的研究結果相似。這些挖掘獲得的SSR位點可為后續的遺傳多樣性、遺傳圖譜構建及QTL定位等研究打下基礎。
4 結論
不同白鯽雜交子代間存在較多的差異表達基因,從中獲得參與抗氧化、免疫和生長發育相關的通路和基因序列,且挖掘出20272個SSR位點,有助于選擇性育種、分子標記開發及開展遺傳多樣性、遺傳圖譜構建和QTL定位等研究。
參考文獻:
陳春林,田易萍,陳林波,鄧少春,徐丕忠,李朝云. 2018. 基于熒光標記的紫娟茶樹轉錄組EST-SSR標記開發[J]. 江蘇農業學報,34(4):747-753. [Chen C L,Tian Y P,Chen L B,Deng S C,Xu P Z,Li C Y. 2018. EST-SSR marker development of Zijuan tea tree transcriptome based on the fluorescent labeling[J]. Jiangsu Journal of Agricultural Sciences,34(4):747-753.]
李冰冰,趙振利,鄧敏捷,曹亞兵,董焱鵬,范國強. 2017. 鹽脅迫對南方泡桐基因表達的影響[J]. 河南農業大學學報,51(4):471-480. [Li B B,Zhao Z L,Deng M J,Cao Y B,Dong Y P,Fan G Q. 2017. Effect of salt stress on gene expressions of different genotypes of Paulownia australis[J]. Journal of Henan Agricultural University,51(4):471-480.]
李盛文,賈智英,柏盈盈,李池陶,石連玉. 2014. 散鱗鏡鯉兩個保種群體的遺傳多樣性[J]. 水產學雜志,27(2):1-8. [Li S W,Jia Z Y,Bai Y Y,Li C T,Shi L Y. 2014. Microsatellite marker analysis of genetic diversity in two sca-ttered scale mirror carp populations[J]. Chinese Journal of Fisheries,27(2):1-8.]
劉義新,肖祖國,徐振秋. 2007. 幾種雜交鯉的形態學特征及主要經濟性狀[J]. 水產科學,26(11):619-621. [Liu Y X,Xiao Z G,Xu Z Q. 2007. Morphological and main economic characteristics of several common carp(Cyprinus carpio L.) hybrids[J]. Fisheries Science,26(11):619-621.]
樓允東. 1999. 我國魚類育種研究五十年回顧[J]. 淡水漁業,29(9):1-3. [Lou Y D. 1999. Review of fish breeding research in China in the past fifty years[J]. Freshwater Fishe-ries,29(9):1-3.]
孫穎. 2016. 棕點石斑魚(♀)×鞍帶石斑魚(♂)雜交F1代生長優勢的轉錄組學研究[D]. 廣州:中山大學. [Sun Y. 2016. Transcriptomic studies on the growth superiorities in grouper hybrid(Epinephelus fuscogutatus ♀)×(Epinephelus lanceolatus ♂)[D]. Guangzhou:Sun Yat-sen University.]
唐玉娟,黃國弟,羅世杏,周俊岸,莫永龍,李日旺,趙英,張宇,宋恩亮,寧琳. 2018. 芒果2個不同花芽分化時期轉錄組分析[J]. 南方農業學報,49(7):1257-1264. [Tang Y J,Huang G D,Luo S X,Zhou J A,Mo Y L,Li R W,Zhao Y,Zhang Y,Song E L,Ning L. 2018. Transcriptome of Mangifera indica L. in two different flower bud differentiation stages[J]. Journal of Southern Agriculture,49(7):1257-1264.]
王靜,肖軍,曾鳴,徐康,陶敏,張純,段巍,劉文彬,羅凱坤,劉筠,劉少軍. 2015. 白鯽×紅鯽雜交后代的遺傳變異[J]. 中國科學:生命科學,45(4):371-380. [Wang J,Xiao J,Zeng M,Xu K,Tao M,Zhang C,Duan W,Liu W B,Luo K K,Liu Y,Liu S J. 2015. Genomic variation in the hybrids of white crucian carp and red crucian carp[J]. Scien-tia Sinica(Vitae),45(4):371-380.]
武耀,賈智英,李池陶,葛會爭,石連玉. 2012. 篩選雜交鯉親子鑒定的微衛星標記(英文)[J]. 農業生物技術學報,20(5):549-559. [Wu Y,Jia Z Y,Li C T,Ge H Z,Shi L Y. 2012. Microsatellite markers for parentage identification of cross-breeding carp(Cyprinus carpio) in a selective breeding programme[J]. Journal of Agricultural Biotechnology,20(5):549-559.]
岳華梅,翟晴,宋明月,葉歡,楊曉鴿,李創舉. 2016. 基于轉錄組測序的興國紅鯉微衛星標記篩選[J]. 淡水漁業,46(1):24-28. [Yue H M,Zhai Q,Song M Y,Ye H,Yang X G,Li C J. 2016. Development of microsatellite mar-kers in Cyprinus carpio var. singuonensis using next-ge-neration sequencing[J]. Freshwater Fisheries,46(1):24-28.]
朱健,柴學森,李冰,張成鋒. 2014. 建鯉和黑龍江野鯉自交以及正反交子代生長比較[J]. 漁業科學進展,35(2):35-41. [Zhu J,Chai X S,Li B,Zhang C F. 2014. Growth comparison of inbreeds of Cyprinus carpio var. Jian,Cyprinus carpio haermatopterus and the reciprocal F1 hybrid[J]. Progress in Fishery Sciences,35(2):35-41.]
朱健,王建新,龔永生,郁桐炳. 2000. 我國鯉魚遺傳改良研究概況[J]. 浙江海洋學院學報(自然科學版),19(3):266-271. [Zhu J,Wang J X,Gong Y S,Yu T B. 2000. An introduction to the studies on common carp genetic improvement in China[J]. Journal of Zhejiang Ocean University(Natural Science),19(3):266-271.]
Arcella T E,Perry W L,Lodge D M,Feder J L. 2014. The role of hybridization in a species invasion and extirpation of resident fauna:Hybrid vigor and breakdown in the rusty crayfish,Orconectes Rusticus[J]. Journal of Crustacean Biology,34(2):157-164.
Bougas B,Granier S,Audet C,Bernatchez L. 2010. The transcriptional landscape of cross-specific hybrids and its possible link with growth in brook charr(Salvelinus fontinalis Mitchill)[J]. Genetics,186(1):97-107.
Chen X,Mei J,Wu J,Jing J,Ma W,Zhang J,Dan C,Wang W,Gui J. 2015. A comprehensive transcriptome provides candidate genes for sex determination/differentiation and SSR/SNP markers in yellow catfish[J]. Marine Biotechnology,17(2):190-198.
Davey J W,Hohenlohe P A,Etter P D,Boone J Q,Catchen J M,Blaxter M L. 2011. Genome-wide genetic marker discovery and genotyping using next-generation sequencing[J]. Nature Reviews Genetics,12:499-510.
Firdaus R F,S L L,Kawamura G, Shapawi R. 2016. Assessment on the acceptability of hybrid grouper,Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus ♂ to soybean meal-based diets[J]. AACL Bioflux,9(2):284-290.
Fu B D,He S P. 2012. Transcriptome analysis of silver carp (Hypophthalmichthys molitrix) by paired-end RNA sequencing[J]. DNA Research,19(2):131-142.
Gao B Q,Liu P,Li J,Wang Q Y,Li X P. 2014. Genetic diversity of different populations and improved growth in the F1 hybrids in the swimming crab(Portunus trituberculatus)[J]. Genetics & Molecular Research,13(4):10454-10463.
Gao Y,Zhang H,Gao Q,Wang L L,Zhang F C,Siva V S,Zhou Z,Song L S,Zhang S. 2013. Transcriptome analysis of artificial hybrid pufferfish Jiyan-1 and its parental species:Implications for pufferfish heterosis[J]. PLoS One,8(3):e58453.
Huang Q,Dong S,Fang C,Wu X,Ye T,Lin Y. 2012. Deep sequencing-based transcriptome profiling analysis of Oryzias melastigma exposed to PFOS[J]. Aquatic Toxicology,120-121:54-58. doi: 10.1016/j.aquatox.2012.04.013.
Ji P F,Liu G M,Xu J,Wang X M,Li J T,Zhao Z X,Zhang X F,Zhang Y,Xu P,Sun X W. 2012. Characterization of common carp transcriptome:Sequencing,de Novo assembly,annotation and comparative genomics[J]. PLoS One,7(4):e35152.
Jia Z Y,Shi L Y,Liu X F,Sun X W. 2008. The genetic diversity of diploid and triploid crucian carp from six populations in Heilongjiang River System[J]. Hereditas,30(11):1459-1465.
Jin J J,Sun Y W,Qu J,Syah R,Lim C H,Alfiko Y,Rahman N,Suwanto A,Yue G,Wong L,Chua N H,Ye J. 2017. Transcriptome and functional analysis reveals hybrid vi-gor for oil biosynthesis in oil palm[J]. Scientific Reports,7(1):439. doi: 10.1038/s41598-017-00438-8.
Li B,Dewey C N. 2011. RSEM:Accurate transcript quantification from RNA-seq data with or without a reference genome[J]. BMC Bioinformatics,12:323. doi:10.1186/1471-2105-12-323.
Li C,Zhang Y,Wang R,Lu J,Nandi S,Mohanty S,Terhune J,Liu Z,Peatman E. 2012. RNA-seq analysis of mucosal immune responses reveals signatures of intestinal barrier disruption and pathogen entry following Edwardsiella ictaluri infection in channel catfish,Ictalurus punctatus[J]. Fish & Shellfish Immunology,32(5):816-827.
Li F B,Gui J F. 2007. Clonal diversity and genealogical relationships of gibel carp in four hatcheries[J]. Animal Genetics,39(1):28-33.
Li J Q,Wang M L,Fang J G,Liu X,Mao Y Z,Liu G M,Bian D P. 2017. Reproductive performance of one-year-old Pacific abalone(Haliotis discus hannai) and its crossbreeding effect on offspring growth and survival[J]. Aquaculture,473:110-114.
Liao X,Cheng L,Xu P,Lu G,Wachholtz M,Sun X,Chen S. 2013. Transcriptome analysis of crucian carp (Carassius auratus),an important aquaculture and hypoxia-tolerant species[J]. PLoS One,8(4):e62308.
Liu Q,Qi Y,Liang Q,Xu X,Hu F,Wang J,Xiao J,Wang S,Li W,Tao M,Qin Q,Zhao R,Yao Z,Liu S. 2018. The chimeric genes in the hybrid lineage of Carassius auratus cuvieri(♀)×Carassius auratus red var.(♂)[J]. Scien-ce China. Life Sciences,61(9):1079-1089.
Liu X J,Liang H W,Li Z,Liang Y J,Lu C,Li C,Chang Y,Zou G,Hu G. 2017. Performances of the hybrid between CyCa nucleocytplasmic hybrid fish and scattered mirror carp in different culture environments[J]. Scientific Reports,7:46329. doi: 10.1038/srep46329.
Liu Y F,Ma D Y,Zhao C Y,Wang W Q,Zhang X L,Liu X,Liu Y,Xiao Z Z,Xu S H,Xiao Y S,Liu Q H,Li J. 2014. Histological and enzymatic responses of Japanese flounder(Paralichthys olivaceus) and its hybrids(P. olivaceus♀×P. dentatus ♂) to chronic heat stress[J]. Fish Physiology and Biochemistry,40(4):1031-1041.
Mao X Z,Cai T,Olyarchuk J G,Wei L. 2005. Automated genome annotation and pathway identification using the KEGG Orthology(KO) as a controlled vocabulary[J]. Bioinformatics,21(19):3787-3793.
Rauw W. 2012. Immune response from a resource allocation perspective[J]. Frontiers in Genetics,3:267. doi: 10.3389/fgene.2012.00267.
Schaeffer H J,Weber M J. 1999. Mitogen-activated protein kinases:Specific messages from ubiquitous messengers[J]. Molecular and Cellular Biology,19(4):2435-2444.
Sinhorin V D G,Sinhorin A P,Teixeira J M D S,Miléski K M L,Hansen P C,Moreira P S A,Kawashita N H,Baviera A M,Loro V L. 2014. Effects of the acute exposition to glyphosate-based herbicide on oxidative stress parameters and antioxidant responses in a hybrid Amazon fish surubim(Pseudoplatystoma sp)[J]. Ecotoxicology and Environmental Safety,106:181-187.
Tian C X,Liang X F,Yang M,Dou Y Q,Zheng H Z,Cao L,Yuan Y C,Zhao C. 2014. New microsatellite loci for the mandarin fish Siniperca chuatsi and their application in population genetic analysis[J]. Genetics and Molecular Research,13(1):546-558.
Wang Z W,Zhu H P,Wang D,Jiang F F,Guo W,Zhou L,Gui J F. 2011. A novel nucleo-cytoplasmic hybrid clone formed via androgenesis in polyploid gibel carp[J]. BMC Research Notes,4(1):82. doi: 10.1186/1756-0500-4-82.
Xiao T Q,Lu C Y,Xu Y L,Li C,Zheng X H,Cao D C,Cheng L,Mahboob S,Sun X. 2015. Screening of SSR markers associated with scale cover pattern and mapped to a genetic linkage map of common carp(Cyprinus carpio L.)[J]. Journal of Applied Genetics,56(2):261-269.
Yan L L,Su J Q,Wang Z P,Yan X W,Yu R H,Ma P,Li Y,Du J. 2017. Transcriptomic analysis of Crassostrea sikamea× Crassostrea angulata hybrids in response to low salinity stress[J]. PLoS One,12(2):e0171483.
Young M D,Wakefield M J,Smyth G K,Oshlack A. 2010. Gene ontology analysis for RNA-seq: Accounting for selection bias[J]. Genome Biology,11(2):R14. doi:10.1186/ gb-2010-11-2-r14.
Yu F X,Zhao B,Panupinthu N,Jewell J L,Lian I,Wang L H,Zhao J,Yuan H,Tumaneng K,Li H,Fu X D,Mills G B,Guan K L. 2012. Regulation of the Hippo-YAP pathway by G-protein-coupled receptor signaling[J]. Cell,150(4):780-791.
Zhai R R,Feng Y,Wang H M,Zhan X D,Shen X,Wu W,Zhang Y,Chen D,Dai G,Yang Z,Cao L,Cheng S. 2013. Transcriptome analysis of rice root heterosis by RNA-seq[J]. BMC Genomics,14:19. doi:10.1186/1471-2164-14-19.
Zhang C B,Lin C J,Fu F Y,Zhong X,Peng B,Yan H,Zhang J,Zhang W,Wang P,Ding X,Zhang W,Zhao L. 2017a. Comparative transcriptome analysis of flower heterosis in two soybean F1 hybrids by RNA-seq[J]. PLoS One,12(7):e0181061.
Zhang H,Xu X,He Z,Zheng T,Shao J. 2017b. De novo transcriptome analysis reveals insights into different mechanisms of growth and immunity in a Chinese soft-shelled turtle hybrid and the parental varieties[J]. Gene,605:54-62.
Zhang Y Q,Liu J H,Fu W,Xu W T,Zhang H,Chen S,Liu W,Peng L,Xiao Y. 2017c. Comparative transcriptome and DNA methylation analyses of the molecular mechanisms underlying skin color variations in crucian carp (Carassius carassius L.)[J]. BMC Genetics,18(1):95. doi: 10.1186/s12863-017-0564-9.
Zhang Z H,Chen J,Ling L I,Tao M,Zhang C,Qin Q B,Xiao J,Liu Y,Liu S J. 2014. Research advances in animal distant hybridization[J]. Science China. Life Scien-ces,57(9):889-902.
Zhou Z C,Dong Y,Sun H J,Yang A F,Chen Z,Gao S,Jiang J W,Guan X Y,Jiang B,Wang B. 2013. Transcriptome sequencing of sea cucumber(Apostichopus japonicus) and the identification of gene-associated markers[J]. Molecular Ecology Resources,14(1):127-138.
(責任編輯 蘭宗寶)

