柔性有機硅疏水涂層的制備及其抑菌活性
沈啟慧,單驛軒,連朋亮,劉巖,于東冬,周建光
(1.吉林化工學院化學與制藥工程學院,吉林吉林,132022;2.浙江大學醫院,浙江杭州,310027;3.浙江大學控制科學與工程學院工業控制技術國家重點實驗室,浙江杭州,310058)
在日常生活與工作中,人們時刻都在接觸很多致病微生物如大腸桿菌、雙歧桿菌、金黃色葡萄球菌[1-4]。研發具有抑菌和抗菌活性的材料,可以降低疾病危害,營造健康的生活環境[5]。隨著抗生素、消毒劑和殺菌劑的濫用,耐藥性變異的微生物種群隨之增多,細菌的耐藥性逐漸發展為一個全球性問題[6],新型抗菌材料的研發和應用成為防止微生物危機發生的重要內容[7]。無機抗菌材料具有抑菌持久性好和不易產生抗藥性等優點[8-9],尤其是納米銀及其復合材料具有低毒性、抗菌活性強、抗菌譜廣等優點,在醫療和保健領域有廣闊的應用前景[10-12],從而使得其相關納米材料的開發和應用成為目前納米發展戰略的主要內容之一。有機硅材料具備無機與有機材料性能,具有耐高溫、電氣絕緣、無毒無味、化學惰性等特點,被廣泛地應用于航空航天、化工、電子電氣、紡織、食品、醫療等領域,尤其在醫療器械上如醫用導管、人工器官及組織替代品、可移植的高密度微電極陣列[13-14]等得到應用。對有機硅表面進行功能性修飾成為該領域的研究熱點。本文作者介紹一種對有機硅表面修飾具有抗菌活性的納米銀疏水涂層(水接觸角WCA=90.33°)的制備方法。采用光化學反應在柔性硅膠基質上組裝微球陣列,并利用其微球表面巰基的還原性原位生長納米銀顆粒,使硅膠表面具有良好的抑菌活性,改變通過短期提高硅膠表面的親水性進而增強抑菌活性的方法[15]。該硅膠表面自組裝微球及微球表面原位生長納米銀顆粒的過程,均在水體系、室溫環境下完成,尤其在原位生長納米銀的反應未使用額外的穩定劑及還原劑,不產生廢棄物,屬于綠色制備技術。通過抗菌活性研究發現,該疏水涂層對革蘭氏陽性/陰性細菌的具有良好的抗菌活性,但不會傷害人類細胞,具有較低的細胞毒性。
1 實驗
1.1 試劑與儀器
試劑:γ-巰基丙基正硅酸甲酯(MPTMS,97%);氨水(分析純);乙醇(分析純);濃硫酸(98%);過氧化氫(30%);甲苯(≥99.5%);烯丙基三乙氧基硅烷(>96.0%);硝酸銀(99.8%);胰酪大豆胨瓊脂培養基;胰酪大豆胨液體培養基;磷酸二氫鉀(分析純);磷酸氫二鈉(分析純);Hoechst33342/PI雙色染色劑;枯草芽孢桿菌菌種均為普通市售試劑;聚二甲基硅氧烷(PDMS,自制);大腸桿菌菌種(吉林大學饋贈)。
儀器:隔水式恒溫培養箱(常州諾基儀器有限公司制造);立式壓力蒸汽滅菌箱(上海博訊實業有限公司制造);超凈工作臺(濟南杰康凈化設備廠制造);CFT-1材料表面性能綜合測試儀(蘭州中科凱華科技開發有限公司制造); 熒光正置顯微鏡(Leica DM4000B)。
1.2 負載納米銀PDMS(Ag-PDMS)的制備
首先,將PDMS 置于體積比為3:1 的濃H2SO4和H2O2混合溶液中浸泡5 min,取出后用大量H2O 沖洗;然后,迅速浸泡到1 mmol/L 烯丙基三乙氧基硅烷的甲苯溶液中,10 min后取出用乙醇沖洗,表面略微吹干備用。
將表面活化后的PDMS放入表面富含巰基的SiO2微球(按文獻方法[16]制備)懸浮液中,紫光燈照射30 min后取出用水沖洗,隨后放置在AgNO3(1 mol/L)溶液中浸泡24 h。水洗后保存在水中。
1.3 摩擦實驗
在室溫下對二氧化硅微球和PDMS鍵合的材料進行摩擦學性能考察,載荷為20 N,轉速為500 r/min,實驗時間為3 min,所用鋼球直徑為4 mm,洛氏硬度為61~66,摩擦因數為0.29~0.36。
1.4 抑菌實驗
在無菌操作臺內,將滅菌(121 ℃,15 min)后的胰酪大豆胨液體培養基分別接種大腸桿菌或枯草芽孢桿菌,在37 ℃時恒溫培育12 h。用滅菌(121 ℃,15 min)后生理鹽水調整菌液濃度為1.3×108個/mL,作為原菌液待用。
在無菌操作臺內,將滅菌(121 ℃,15 min)后的胰酪大豆胨固體培養基加入原菌液,凝固后表面放置Ag-PDMS 和未經處理的PDMS 薄膜作為對照,于37 ℃恒溫培育12 h。
按照染色劑說明書要求,在錐形瓶內配制磷酸緩沖溶液(PBS),于121 ℃滅菌15 min。將已處理好的Ag-PDMS 薄膜從培養基中取出,放入染色液中避光冰水浴30 min,將PBS 沖洗干凈用于熒光顯微鏡檢測。
2 結果與討論
2.1 硅表面微球的自組裝
PDMS 作為一種有機硅,具有柔軟、光學透明、無毒、不易燃、良好的化學惰性和生物相容性等特點,廣泛地應用于隱形眼鏡、人造肌肉、醫用導管、生物傳感器、微流控系統[17-19]等。由于其表面具有憎水性,因而很容易黏附生物膜,滋生細菌,影響PDMS在醫療材料領域的應用。雖然等離子體、臭氧輻射處理能夠有效提高PDMS表面親水性,在一定程度上抑制生物膜的黏附,但隨著時間延長,表面潤濕性逐漸變差,這是由于處理后的極性基團(—OH,—COOH)隨擴散作用而引發的分子鏈遷移,即極性基團向PDMS內部遷移[20]。
將粒徑較大的微球(直徑約為1 μm)通過自組裝的方法鍵合在PDMS表面,能夠有效地避免分子鏈遷移導致的表面變性,永久性地提高抗黏附生物膜的性能。圖1所示為微球自組裝在PDMS表面的點擊化學反應示意圖,圖2所示為PDMS表面自組裝微球的紅外光譜和顯微成像圖片。圖1中PDMS 表面修飾端烯,圖2中的紅外光譜在1 655 cm-1和1 676 cm-1處的峰為端烯的特征吸收峰,這說明PDMS表面已經存在大量的端烯基團[21];在光照條件下,微球表面的巰基將與端烯發生親電加成反應,紅外譜圖中原端烯吸收峰消失,在619 cm-1和1 132 cm-1處出現新的吸收峰(硫醚鍵),證實通過點擊化學反應能夠將微球鍵合在PDMS表面[22]。圖2中的顯微及AFM圖像表明,通過自組裝的方法能夠實現微球在PDMS表面上規則有序地排列。

圖1 在PDMS表面微球自組裝的點擊化學反應Fig.1 Silica microspheres anchored to surface of PDMS by“Click reaction”between thiol group and vinyl-silica

圖2 PDMS表面自組裝微球的紅外光譜和顯微成像圖片Fig.2 FTIR spectrum and microscope image of silica microspheres assembled on surface of PDMS
通過對照摩擦實驗,將組裝微球與空白的PDMS進行對照。結果發現:空白PDMS基片在第3次測試時,基片發生破損;而組裝后微球的基片在第6次測試時,只有摩擦因數小幅度降低,持續到第10次時,依然未發生基片斷裂現象,證實微球在PDMS表面自組裝的穩定性,并且能夠有效地緩沖摩擦對基片的影響。
2.2 納米銀在微球表面的原位生長
自組裝到PDMS表面的微球表面依舊存在大量巰基,利用雙巰基鍵合生成二硫鍵的同時為銀離子還原提供電子,并且PDMS具備遠距離(約5 nm)傳輸電子的特性,吸附在微球表面的銀離子自動被還原為納米銀顆粒,隨著微球提供的電子衰竭,納米銀的生長逐漸停止(~15 nm),通過調節溶液中銀離子的濃度也可以控制納米銀的粒徑[23]。圖3所示為原位生長在微球表面的納米銀顆粒的TEM 成像圖片,球形的納米銀顆粒單層生長在微球表面并具有清晰的晶格線,晶格線間距為0.236 nm,證實納米銀顆粒在微球表面的生成,同時XPS 圖譜中Ag 3d3/2和Ag 3d5/2在374.1 和368.1 eV位置出現明顯譜峰,這也證實銀離子轉變為銀原子[24]。
2.3 菌落計數法

圖3 微球表面AgNPs的TEM圖片和XPS譜圖Fig.3 TEM image and XPS spectrum of silver nanoparticles generated on surface of silica microspheres
納米銀是一種常用的廣譜抗菌劑,且不會導致抗藥性菌種出現,因此,含納米銀的抗菌用品應用非常廣泛。本次實驗通過平板菌落計數的方法對材料的抑菌性能進行評價。如圖4所示為負載納米銀抑制大腸桿菌和枯草桿菌生長的平板菌落計數結果。從圖4可見:與革蘭氏陰性菌(大腸桿菌)共同培養的Ag-PDMS上及周圍沒有菌落出現(圖4(a)中A處),而未經處理過PDMS 的表面長滿菌落(圖4(a)中B處),說明修飾納米銀后的PDMS基片對大腸桿菌有良好的抑菌效果。同樣,與革蘭氏陽性菌(枯草芽孢桿菌)共同培養的Ag-PDMS 上及周圍也沒有菌落生長(圖4(b)中C處),而未處理過的PDMS 上長滿菌落(圖4(a)中D處),所以,生長納米銀顆粒的PDMS 對革蘭氏陽性菌枯草芽孢桿菌也有良好的抑菌效果。通過菌落計數法對照實驗,證明經修飾納米銀后的PDMS呈現良好的抑菌活性。
2.4 細菌染色法

圖4 負載納米銀抑制菌種生長的平板菌落計數結果Fig.4 Colony counting results of inhibiting the growth of bacterial by AgNPs

圖5 用不同樣品孵育后細菌的熒光顯微鏡圖像Fig.5 Fluorescent microscopy images of bacteria after incubation with different samples
將未經過處理的PDMS 和Ag-PDMS 分別與大腸桿菌或枯草芽孢桿菌共同培養,將培養后的薄膜使用熒光染色劑染色,根據染色部位和熒光顏色的差異,可以區分細菌的生存狀況,其中藍色熒光主要是活細菌,紅色熒光則對應死亡細菌,熒光強度越高說明相應的細菌數量越多。圖5所示為用不同樣品孵育后的活/死大腸桿菌和枯草芽孢桿菌的熒光顯微鏡圖像。其中,圖5(a)和(b)所示為大腸桿菌的熒光顯微鏡圖像,可見未經染色的薄膜表面生長著大量的細菌,而復合納米銀顆粒的PDMS 表面只能觀察到微球存在。經過染色對比后,活/死細菌的數量PDMS 遠遠比Ag-PDMS 復合薄膜的多。圖5(c)和(d)所示為枯草桿菌的熒光顯微鏡圖像,與大腸桿菌的檢測結果類似,Ag-PDMS表面生長的細菌量很少,說明Ag-PDMS具有良好的抑菌活性。
2.5 納米銀修飾PDMS表面的細胞毒性
實驗結果表明:納米銀修飾PDMS表面具有很好的抑制革蘭氏陽性/陰性細菌的活性,即對原核微生物具有很好的抑制作用,但同時需要保證該材料對哺乳性動物細胞特別是人類細胞不要造成傷害。為驗證經納米銀修飾PDMS 的安全性,采用MTT 方法以細胞存活率作為定量的標準,選用蜂毒肽作為陽性參照物,空白磷酸緩沖溶液作為陰性對照物,與納米銀修飾的PDMS進行比較,實驗選用人腦微血管內皮細胞(hCMEC/D3),該細胞與普通人體細胞非常接近,具有良好的形態學特征,適合開展細胞毒性實驗[25]。
細胞毒性曲線如圖6所示。從圖6可見:蜂毒肽對hCMEC/D3 細胞具有強烈的殺傷作用;當蜂毒肽的質量濃度為16 mg/L 時,hCMEC/D3 細胞全部死亡;而當PDMS 表面納米銀的質量濃度低于64 mg/L時,細胞存活率并未受到影響(約100%),因此,可認為當納米銀的質量濃度低于64 mg/L時,不具備殺傷性;而隨著樣品中納米銀質量濃度逐漸增加,達到128~256 mg/L 時,依然有50%~90%的細胞存活,此時,其質量濃度相比蜂毒肽的致死質量濃度高8~16 倍,這表明當PDMS 表面納米銀質量濃度低于128 mg/L時,幾乎不抑制人類細胞的增值。
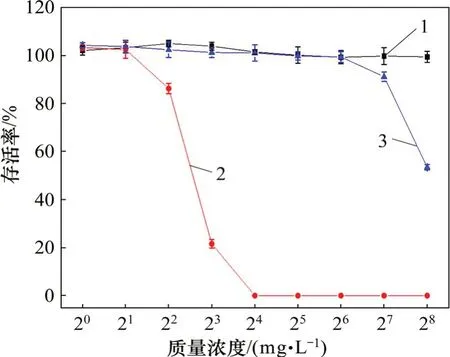
圖6 細胞毒性曲線Fig.6 Curves of cytotoxicity
3 結論
1)利用光點擊化學反應通過二氧化硅微球將納米銀顆粒鍵合在柔性硅基質材料(PDMS)表面,利用納米銀顆粒獨特的抑菌性能,降低PDMS吸附和滋生細菌的可能性。
2)Ag-PDMS 薄膜對大腸桿菌和枯草芽孢桿菌的生長均有明顯的抑制作用,同時具有較低的生物毒性,在一定程度上可以替代抗生素、消毒劑或殺菌劑,為食品安全及醫用衛生等無菌操作的領域提供材料。

