水熱合成二氧化鈦納米顆粒及光致發光性能研究
付 新
(渭南師范學院化學與材料學院,陜西渭南714099)
TiO2因其無毒、高效、價格低廉等優點,一直以來備受人們的青睞,成為目前研究最多且應用最廣泛的納米材料之一[1]。納米TiO2在很多領域都有著廣泛應用,例如:光催化劑、廢水處理、染料廢物的降解及燃料電池等領域[2-4]。目前,可以通過不同的方法諸如化學沉淀法、水熱合成法等控制合成納米TiO2顆粒[5-6]。 M.Niederberger等[7]利用溶膠-凝膠法制備得到了小于10 nm的銳鈦礦TiO2納米顆粒。G.Melcarne等[8]通過水熱合成法得到了直徑較小的棒狀TiO2納米顆粒。M.Sedlacik等[9]利用微波輔助的熔鹽法得到了棒狀的TiO2納米顆粒。相比于其他制備納米TiO2的方法,水熱合成法具有無污染、產品純度高、操作簡便等優點。本文采用價格低廉的鈦酸丁酯為鈦源,通過改變十六烷基三甲基溴化銨(CTAB)的量,制備得到了不同粒徑的銳鈦礦納米TiO2顆粒,分析了粒徑大小,討論了顆粒堆積所形成的孔結構,探討了粒徑和孔徑大小對TiO2納米顆粒光致發光性能的影響。
1 實驗方法
1.1 原料與試劑
鈦酸丁酯(C16H36O4Ti),質量分數為 98%,AR;十六烷基三甲基溴化銨(C19H42BrN),質量分數為99.0%,AR;無水乙醇(CH3CH2OH),質量分數為 99%,AR;以及一些常用試劑。
1.2 儀器與設備
電子天平,AL204;立式電熱鼓風干燥箱,DHG-9005A(300℃規格);馬弗爐,KSL-1700X;氮吸附儀,ASAP 2406;X 射線衍射儀,XRD-6100; 熒光光譜儀,F-7000;掃描電鏡,SIGMA 500;水熱反應釜(100 mL);磁力攪拌機。
1.3 合成方法
第一步,稱取一定量的CTAB,并滿足n(CTAB)/n(Ti)分別為 0.25%、0.5%、0.75%、1.0%,分別溶于盛有30 mL去離子水的燒杯中,并在600 r/min的轉速下攪拌30min,使模板劑充分溶解,直到溶液變透明。
第二步,用小燒杯分別稱取30 g鈦酸丁酯,并用膠頭滴管以0.5滴/s的速度分別滴入相應的模板劑溶液中,待滴定結束后,繼續攪拌30 min。
第三步,用玻璃棒將第二步所得到的4種溶液分別攪拌均勻,將其依次倒入相應的水熱反應釜中,置于鼓風干燥箱中,并在180℃下保溫600 min。
第四步,待水熱反應結束后,將所得到的溶液分別抽濾,然后將所得白色沉淀放入鼓風干燥箱。等水分烘干后,置于馬弗爐中,在300℃下煅燒50 min,從而得到TiO2納米材料。所得樣品分別記為:TiO2-1、TiO2-2、TiO2-3、TiO2-4。
2 結果與討論
2.1 XRD分析
圖1為不同模板劑添加量下所得樣品的XRD譜圖。由圖1可以看出,在模板劑添加量不同時,所得XRD譜圖均具有相同的衍射峰,衍射峰位置與銳鈦礦TiO2的JCPDS標準卡片相對應,8個主要衍射峰對應銳鈦礦的(101),(004),(200),(105),(211),(204),(220),(215)晶面特征峰,沒有發現其他雜質的衍射峰,由此表明所有樣品晶型相同均為銳鈦礦型,且在 2θ為 25.46°附近出現最強峰[10]。 但是,因為模板劑添加量的不同,TiO2材料所對應衍射峰的強度以及峰寬都不一樣,并且在添加量為0.5%時,譜圖中(101)晶面的衍射峰相對較寬,表明晶粒尺寸相對較細小。根據謝樂公式:D=Kγ/Bcosθ(其中K為常數;D為晶粒粒徑;γ為衍射線波長,0.154056 nm;B為實測樣品衍射峰的半高寬;θ為衍射角)[8],計算出在添加量為0.5%時,晶粒尺寸為12.8 nm。同樣,可得添加量為0.25%、0.75%及1.0%時,晶粒尺寸分別為24.2、19.6、21.7 nm。由此可見,當模板劑添加量為0.5%時,所獲得的晶粒尺寸最小。
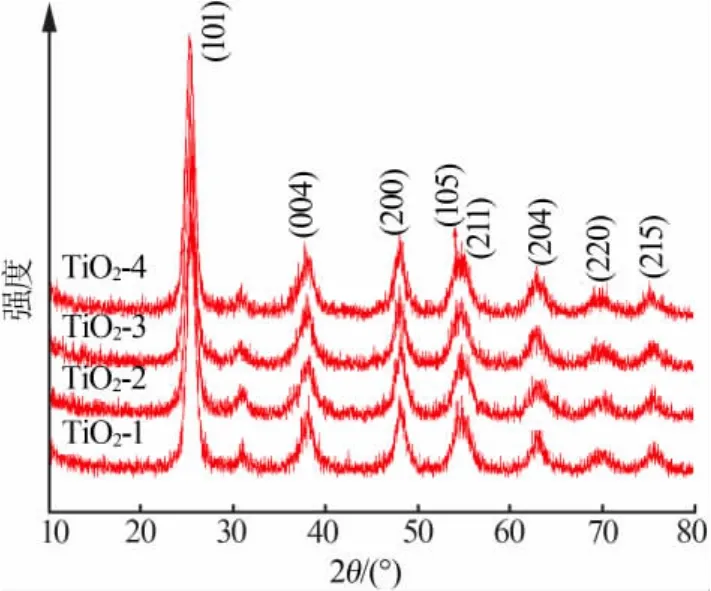
圖1 4組樣品的XRD譜圖
2.2 掃描電鏡分析
圖2 為4組樣品的SEM圖片。由圖2得出,不同添加量所得的TiO2納米材料形貌基本一致,都由納米顆粒堆積而成,但顆粒大小有所區別,顆粒與顆粒之間形成了一定的孔隙。在添加量為0.25%時(圖2a),納米顆粒直徑約為12~30 nm,堆積形成的孔徑約為8~15 nm;在模板劑添加量為0.5%時(圖2b),其顆粒直徑約為8~20 nm,孔徑約為5~12 nm;隨著添加量增加到0.75%時(見圖2c),所得樣品的直徑約為 10~25 nm,孔徑約為 5~12 nm;當添加量為1.0%時(圖2d),所得TiO2納米顆粒粒徑約為 12~28 nm,孔徑約為5~12 nm。由于納米粒子其本身表面活性較大,容易引發團聚現象,而過多的模板劑縮短了粒子之間的距離,導致水分子與羥基結合形成的氫鍵相互作用,從而生成了新的化學鍵,引起納米顆粒的大量堆積[5]。隨著模板劑添加量的不同,所生成的TiO2納米顆粒粒徑有所區別,由納米顆粒堆積所形成的孔徑之間也有所差異。所以適量的模板劑可以抑制顆粒間的毛細管力、靜電引力、范德華力等相互作用力,從而得到了分散性較好的納米顆粒。

圖2 4組樣品的SEM圖
2.3 氮吸附
采用氮吸附分析所制備TiO2納米材料的孔結構。圖3是不同模板劑下所制備的4組TiO2納米材料N2吸附等溫線和BJH孔徑分布圖。從圖3a可以看出,等溫線隨相對壓力的變化基本呈現出3個特征。1)低比壓段,P/P0小于0.3時,該段曲線平緩,在這一階段,N2分子以單層到多層的形式吸附于材料介孔內表面。2)中等比壓段,P/P0為0.3~0.85時,吸附等溫線的斜率迅速增大,這是樣品發生毛細凝聚現象所引起的。并且,此段曲線的突越幅度明顯,說明樣品的孔徑分布比較均勻,有序度較高。3)高比壓段,P/P0>0.85,N2的吸附量隨著P/P0的增大呈現出較為緩和的增加,說明此階段有著多層吸附,TiO2表層以單層到多層的形式吸附N2分子。由以上結果可確定所合成的4組材料具有典型的介孔結構。
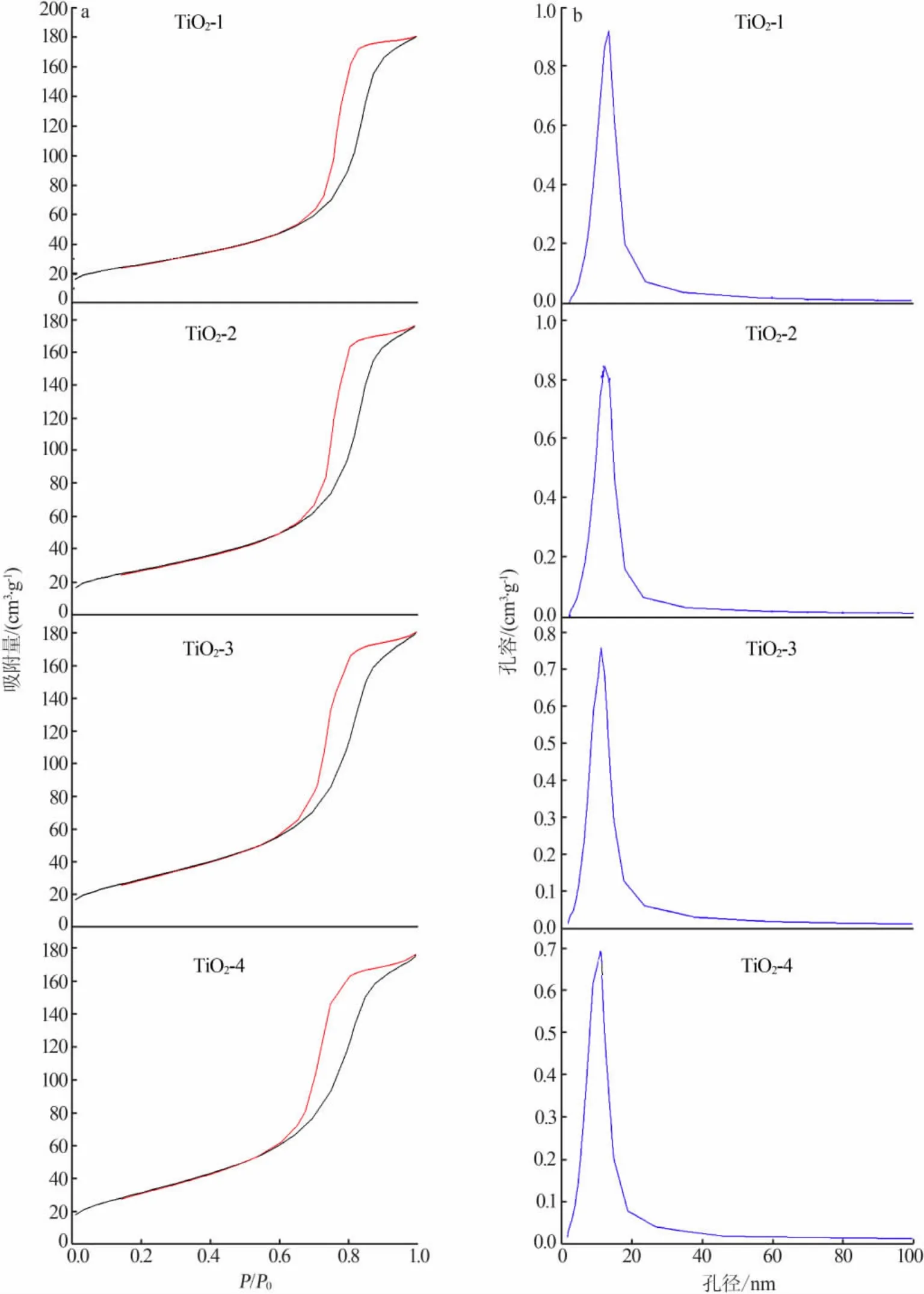
圖3 4組TiO2納米材料的氮氣洗脫附等溫線(a)及孔徑分布圖(b)
從圖3b結合表1可以看出,4組樣品具有較窄的孔徑分布,隨著模板劑添加量的增加,孔徑逐步減小,比表面積逐步增大,但孔容基本沒變化。所有樣品的孔徑主要集中在10 nm左右,當模板劑添加量為0.25%時,孔徑分布主要位于10.5 nm;當添加量增加到1.0%時,孔徑分布位于8.0 nm。以上結果充分說明隨著CTAB用量的不斷增大,TiO2納米顆粒的尺寸會發生變化,堆積所形成的孔結構比表面積不斷增加,孔徑逐步減小。
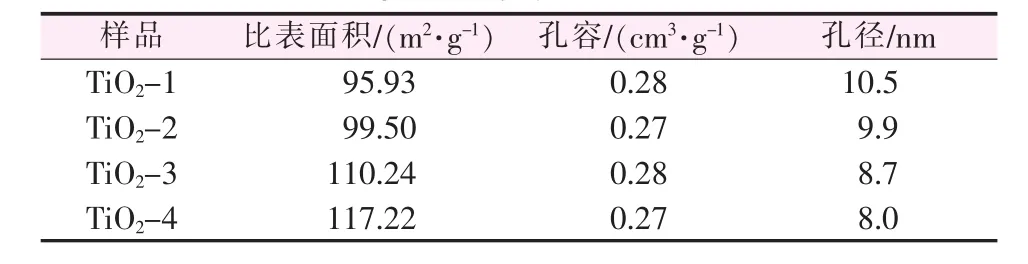
表1 不同模板劑添加量下TiO2納米材料的氮吸附數據
2.4 熒光光譜
圖4是不同模板劑添加量下的光致發光光譜。從圖4 可見,TiO2-1、TiO2-2、TiO2-3、TiO2-4 發射峰的中心位置分別集中在 378、393、378、375 nm。發射峰的強度隨著模板劑添加量的增加,出現了先增大后減小的趨勢,其中TiO2-2發射峰的強度最大。造成這種現象的主要原因是TiO2-2顆粒尺寸較小,受到納米顆粒的限域效應[11],電子-空穴對在小體積中運動,增加了顆粒內部的內應力,導致電子波函數重疊加大,從而形成了強發射峰。此外,TiO2-2的發射峰的中心位置393 nm相比于其他3組樣品的發射峰中心位置發生了明顯的紅移。這主要是由于受到量子尺寸效應的影響[12],粒子粒徑越小,造成未被電子占據的分子軌道能級與已被電子占據的分子軌道之間的禁帶寬度增大,從而出現“紅移”。此外,由于孔結構的存在,納米TiO2粒子表面結構出現變化,使原來的禁止電子躍遷變成允許電子躍遷,因此會看到相比于其他3組樣品,TiO2-2的發射峰更強,且有紅移變化的現象。
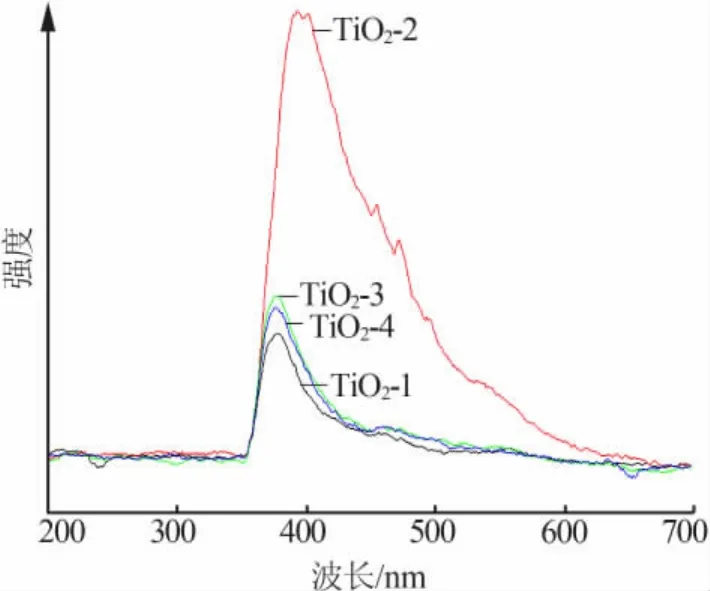
圖4 4種樣品的光致發光光譜
3 結論
1)采用水熱法,改變模板劑CTAB的添加量,能夠獲得粒徑小、孔道結構豐富、粒度分布窄及分散性較好的銳鈦礦TiO2納米材料。2)4組樣品具有特殊的光致發光特性。由于TiO2-2顆粒尺寸較小,TiO2-2在393 nm處出現了最強的發射峰。受到量子尺寸效應和表面孔結構的影響,導致TiO2-2的發射峰的中心位置相比于其他3組樣品的發射峰中心位置發生了明顯的紅移。

